基本介紹
- 中文名:阻轉異構體
- 外文名:atropisomer
- 所屬一級學科:化學
- 所屬二級學科:有機化學
- 實例:鄰取代聯苯
概念,實例,
概念
在有機物分子中,當連線在某一單鍵上的幾個基團在圍繞該單鍵旋轉時,它們相對於同一分子中其它基團的空間位置就發生了變化,這樣就形成了不同的構象。

可以看出,在最中間的 C-C 鍵 (正丁烷有三個 C-C 鍵)一端的兩個氫原子和一個甲基在圍繞該 C-C 鍵轉動時,形成了無數個不同的構象,每個構象都有自己的勢能。隨著轉動角度的變化,勢能起伏變化,呈現出幾個極小值。具有極小值勢能的幾個構象互為構象異構體。
當一個構象異構體轉變為另一個構象異構體時,需要越過一個能壘,也就是上圖中勢能的“峰”。當能壘很高的時候,兩個構象異構體不能輕易互相轉換,這種情況中的兩個構象異構體就互為旋轉異構體了。 當能壘足夠高時,旋轉異構體能在很長時間內維持自己的構象,不會轉變為別的旋轉異構體,此時這個旋轉異構體被視為新的化學物種了,這樣的旋轉異構體被稱為阻轉異構體。有的科學家認為,在常溫下,一個旋轉異構體轉變為另一個旋轉異構體時,只有當半衰期大於 1000 秒時,這個旋轉異構體才是阻轉異構體。 但是別的科學家並不這么認為。旋轉異構體到底維持多長時間才能被視為阻轉異構體,這個在化學界並沒有統一的說法。
研究表明,繞單鍵旋轉時相互靠近的兩個基團的半徑越大,它們之間的排斥力就越大,因此轉動能壘就越高。
實例
最常見的阻轉異構體就是鄰取代聯苯了。6,6'-二硝基-2,2'-聯苯二甲酸就是其中一個:

當兩苯環以它們之間的 C-C 鍵為軸相對轉動時,-NO2 與 -COOH 互相靠近並互相排斥,導致轉動受阻。因此,6,6'-二硝基-2,2'-聯苯二甲酸其實是一對阻轉異構體。兩個阻轉異構體之間的能壘為 42—210 kJ/mol。
除了四個取代基的聯苯,三個取代基的聯苯也會產生阻轉異構體,比如下圖中的例子:

無論是-NO2 還是 -COOH,與 -OMe 靠近時都會產生排斥,因而產生一對阻轉異構體。
只有兩個鄰位取代基的聯苯也可以產生阻轉異構體,比如下圖中的例子:

異丙基體積很大,與 -H 和 -CH3 靠近都會產生排斥,導致一對阻轉異構體出現。兩個阻轉異構體之間的能壘約 93 kJ/mol。
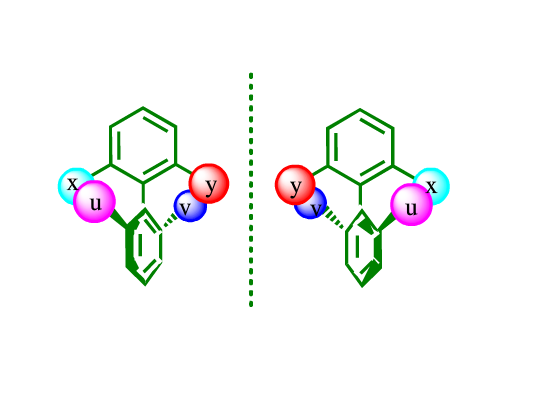
另外,鄰取代聯萘也會產生阻轉異構體,如下圖中的例子:

由於兩個 -OH 互相之間有排斥,並且它們和對面的萘基也有排斥,導致生成一對阻轉異構體。