鐵調素是由肝臟合成並分泌的富含半胱氨酸的抗菌多肽,在免疫過程中能夠大量表達參與免疫反應;在機體內鐵平衡的調節中起到負性調節的作用,其在鐵代謝疾病的相關臨床套用上有一定療效。
基本介紹
- 中文名:鐵調素
- 外文名:hepcidin,Hepc
Hepc分子由8個半胱氨酸殘基形成含有4個二硫鍵的單一髮夾結構,其胺基酸序列在不同哺乳動物中都高度保守,已發現三種Hepc,分別為Hepc22、Hepc25和Hepc20,後兩者是Hepc的主要存在形式,Hepc25存在於人的血液和尿液中,尿中的Hepc22和Hepc20比Hepc25的N端少3個或5個胺基酸,被認為可能是Hepc25的降解產物。CD光譜學特性研究證實,在磷酸緩衝液中Hepc具有兩個穩定的β摺疊結構,這一結構與抗菌多肽的胱氨酸結構非常相似,屬於防禦素家族,參與宿主的天然防禦。
人類Hepc基因位於19號染色體,有三個外顯子和兩個內含子,其中第三個外顯子編碼其胺基酸序列。Hepc基因的上游與上游刺激因子(upstream stimulatory factor2,USF2)基因緊密相連,兩者間只有1.24kb的間隔,在這一部位存在著轉錄因子CAAT增強子結合蛋白、核因子κB和肝細胞核因子的結合位點。
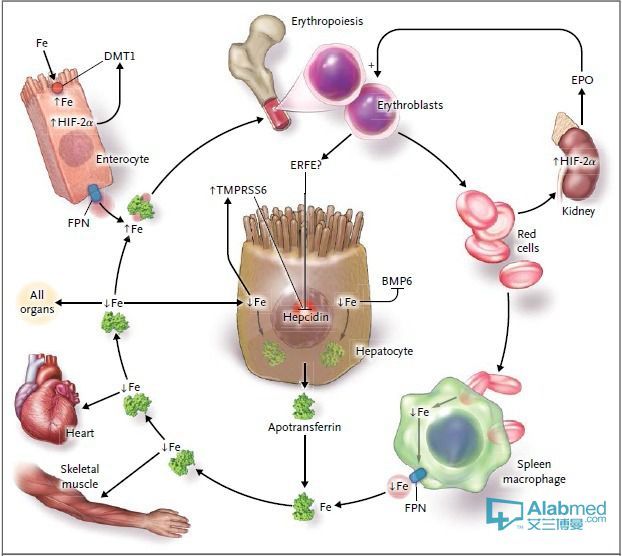
人體鐵大部分來源於衰老的紅細胞被巨噬細胞吞噬後血紅素鐵的再循環,另一部分來源於食物鐵的吸收,小腸是吸收鐵的唯一部位,胃和十二指腸的細胞色素b(duodenal cytochromeb,Dcytb)首先將食物中的Fe3+還原成Fe2+,而後被二價金屬離子轉運蛋白(divalent metal transporter 1,DMT 1)轉運至小腸上皮細胞內,同時,血紅素(Heme)也可由腸上皮細胞吸收降解後釋放其中的Fe2+,以上途徑吸收的Fe2+一方面以鐵蛋白的形式儲存在肝臟、小腸和巨噬細胞內,供機體需要時利用。另一方面在膜鐵轉運蛋白1(ferroportin 1,FPN1)和膜鐵轉運輔助蛋白(hephaestin,Hp)的共同作用下穿過腸上皮細胞基底膜,釋放入血液中,並被氧化成Fe3+與轉鐵蛋白(transferrin,Tf)結合,以Tf-Fe2的形式運輸,通過門脈系統到達肝臟,肝細胞在轉鐵蛋白受體2(transferrin receptor 2,TfR2)的介導下攝取這些結合鐵,部分鐵經血液到達骨髓用於血紅蛋白合成及紅細胞生成,或與幼紅細胞上的TfR1結合進入網織紅細胞中用於紅細胞分化過程中血紅蛋白的合成,最終鐵在各個組織器官和細胞中被利用。
無論是何種生物,在生理狀態下都缺少排泄鐵的機制,所以機體的鐵穩態關鍵依賴於小腸鐵吸收和機體鐵需要之間的平衡。
2.鐵調素在免疫過程的表達和調節
近年來有研究發現炎症等免疫因素可以導致機體鐵代謝發生明顯的改變,Hepc的發現為解釋免疫反應與鐵代謝間的聯繫提供了途徑。在炎症病人和實驗室誘導產生炎症反應的小鼠的尿中Hepc含量明顯升高,Hepc mRNA的水平也明顯上升。炎症主要通過IL-6引起Hepc表達升高。在離體實驗和在體實驗中均發現IL-6可引起Hepc表達增加,而IL-6基因敲除的小鼠即使注射內毒素也不能引起Hepc表達的增加。免疫反應時,IL-6與IL-6受體α結合後激活JAKs(Janus kinase)使得STAT蛋白磷酸化,尤其是STAT3。磷酸化的STAT蛋白進入細胞核,直接與Hepc基因啟動子相應位點結合,促進Hepc的表達。也有學者認為IL-6是通過SMAD4來調節Hepc表達的,當它抑制了肝細胞中的SMAD4後,便不再對Hepc的表達產生影響。還有學者認為炎症反應時通過NF-κB調節Hepc的表達,在大鼠的Hepc基因中也發現有NF-κB的結合位點。另外也有學者認為感染或炎症反應時,巨噬細胞和嗜中性粒細胞通過產生TLR-4引起Hepc的表達增加,但免疫反應中Hepc具體的調節機制尚未明確。
3.鐵調素的臨床套用價值
傳統治療方法和藥物對鐵代謝紊亂疾病始終未起到很好的效果,Hepc作為鐵負性調節激素,本身可成為一種降低機體鐵水平的外源性藥物治療鐵過載疾病。國內外均有學者發現,補充外源性Hepc,對遺傳性血色病(hereditaryhemochroma-tosis,HH)、鐵相關神經退行性疾病及伴有鐵沉積的慢性肝臟疾病等鐵代謝相關疾病,都有不同程度的療效。另外,研製一種Hepc抑制劑或Hepc阻斷劑對治療慢性炎症性貧血等由Hepc長期過度表達所導致的疾病也是非常有用的。