物化性質
CAS號:1309-37-1;1317-60-8;1332-37-2
EINECS號:215-168-2;215-275-4;215-570-8
分子量:159.6882
穩定性:穩定,溶於鹽酸、稀硫酸生成
鐵鹽。鐵單質在置換反應中生成亞鐵離子。
Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
儲運條件:存放於乾燥處,勿使受潮,避免高溫,並與酸鹼物隔離。按上述保管條件,未拆包裝的產品有效貯存期為三年。
溶解性:難溶於水,不與水反應。溶於酸,與酸反應。不與NaOH反應。
氧化性:高溫下被CO、H2、Al、C、Si等還原。
Fe2O3+2Al=點燃=2Fe+Al2O3
Fe2O3+3CO=高溫=2Fe+3CO2
2Fe2O3+3C=高溫=4Fe+3CO2↑
2Fe2O3+3Si=高溫=4Fe+3SiO2
化學性質
⑴氧化鐵與酸反應生成鐵鹽和水。
例:Fe2O3+6HCl=2FeCl3+3H2O
⑵鋁熱反應
鋁與氧化鐵混合後組成鋁熱劑,加熱後生成
氧化鋁和
鐵。
化學式:2Al+Fe2O3=高溫=Al2O3+2Fe
⑶碳、一氧化碳還原性
氧化鐵可以與碳混合後加熱,鐵和二氧化碳提取出來。
化學式:3C+2Fe2O3=高溫=4Fe+3CO2↑
氧化鐵可以和一氧化碳混合後加熱,生成鐵和二氧化碳。
化學式:3CO+Fe2O3=高溫=2Fe+3CO2
物理性質
性狀:紅棕色粉末
密度:5.24 g/cm3
熔點:1565℃(分解)
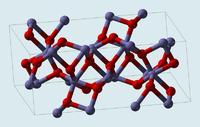 來源於維基百科
來源於維基百科存在形式:礦物:赤鐵礦、赭石
α型晶胞結構:
磁性:在自然狀態下,氧化鐵屬於α型晶胞結構,並不具有磁性。但如果用四氧化三鐵經過特殊處理後會形成γ型
晶胞結構,具有磁性,但並不穩定,易變為α型。
製備方法
製備方法有濕法和乾法。濕法製品結晶細小、顆粒柔軟、較易研磨,易於作顏料。乾法製品結晶大、顆粒堅硬,適宜作磁性材料、拋光研磨材料。
濕法
FeSO4+2NaOH=Fe(OH)2+Na2SO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4FeSO4+4H2O+O2=2Fe2O3↓+4H2SO4
Fe+H2SO4=FeSO4+H2↑
將一定量的5%硫酸亞鐵溶液迅速與過量氫氧化鈉溶液反應(要求鹼過量 0.04~0.08g/ml),在常溫下通入空氣,使之全部變為紅棕色的氫氧化鐵膠體溶液,作為沉積氧化鐵的晶核。以上述
晶核為載體,以
硫酸亞鐵為介質,通入空氣,在75~85℃,在金屬鐵存在下,硫酸亞鐵與空氣中氧氣作用生成氧化鐵(即鐵紅)沉積在晶核上,溶液中的硫酸根又與金屬鐵作用重新生成硫酸亞鐵,硫酸亞鐵再被空氣氧化成鐵紅繼續沉積,這樣循環至整個過程結束,生成紅色氧化鐵。
4Fe3O4+O2=高=溫=6Fe2O3
在潮濕的空氣中,鋼鐵表面吸附了一層薄薄的水膜,這層水膜里含有少量的H
+和OH
-,還溶解了氧氣,結果在鋼鐵表面形成了一層電解質溶液,它跟鋼鐵里的鐵和少量的碳(因鋼鐵不純)恰好形成無數微小的原電池。在這些
原電池里,鐵是負極,碳是正極。鐵失去電子而被氧化:
負極:2Fe_4e-=2Fe2+
正極:2H2O+O2+4e-=4OH-
電化學腐蝕是造成鋼鐵腐蝕的主要原因。
在此之後繼續反應:
Fe2+2OH-=Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3+nH2O=Fe2O3·nH2O+3H2O
在國中的化學裡,可用鹽酸(HCl)來除鐵鏽。
方程式為:Fe2O3+6HCl=2FeCl3+3H2O
乾法
硝酸與鐵屑反應生成硝酸亞鐵,經冷卻結晶、脫水乾燥,經研磨後在600~700℃煅燒8~10h,在經水洗、乾燥、粉碎製得氧化鐵紅產品。也可以
氧化鐵黃為原料,經600~700℃煅燒製得氧化鐵紅。4Fe(NO
3)
3→2Fe
2O
3+12NO
2↑+3O
2↑ Fe
2O
3·nH
2O→Fe
2O
3+nH
2O;先製得透明氧化鐵黃(製法參見透明氧化鐵黃),經煅燒脫水,製得透明氧化鐵紅。其2α-FeOOH
==△==2α-FeSO
3+H
2O。
採用中和沉澱法。先製得氧化鐵黑,再高溫灼燒製得透明氧化鐵線。將0.5mol/L濃度的FeCl3·6H2O溶液加熱沸騰水解至紅棕色膠粒出現為止(溶液1)。取與溶液1等體積的0.25mol/L的FeCl2溶液(由金屬鐵與鹽酸作用製得),用稀氨水調至白色沉澱不再消失為止(溶液2)。將溶液1和溶液2合併,攪拌,並加入適量的羥基羧酸絡合劑和緩衝劑,維持恆溫80℃。隨反應的進行,不斷有黑色Fe3O4生成。反應結束,將Fe3O4結晶轉移至pH8、含有為Fe3O4質量比為10%~20%的油酸鈉溶液中進行表面處理,攪拌懸濁液,恆溫80℃,0.5h後將懸濁液用稀鹽酸(1:3)調pH=6~6.5,將Fe3O4油酸吸附包覆物(黑色絮凝體)抽濾,熱水攪洗數次,50~60℃真空烘乾,製得疏鬆的粉體Fe3O4。將上述油酸包覆的Fe3O4慢速升溫至550~600℃焙燒0.5h,得到均勻分散的透明鐵紅α-Fe2O3微粒子。
由天然黃鐵礦製得。由
硫酸亞鐵或草酸鐵經風化得
硫酸鐵,再經煅燒而得。由氫氧化鐵脫水而得。製造硫酸、
苯胺、
氧化鋁等過程中的副產物。由
碳酸鐵、
硝酸鐵等經強熱而得。硫酸亞鐵加熱至650℃以上而得。
雲母赤鐵礦法:雲母赤鐵礦石精選後,經濕球磨機磨成精礦粉,脫水,烘乾,冷卻,粉碎至325目,過篩,製成雲母氧化鐵。
硫酸亞鐵氧化法:將硫酸與鐵屑反應製得硫酸亞鐵,除砷及重金屬,經氧化而得。流程參見
氧化鐵黃。
製備方法有濕法和乾法。濕法製品結晶細小、顆粒柔軟、較易研磨,適宜作顏料。乾法製品結晶大、顆粒堅硬,適宜作磁性材料、拋光研磨材料。濕法將一定量的5%硫酸亞鐵溶液迅速與過量燒鹼溶液反應(要求鹼過量0.04~0.08 g/ml),在常溫下通入空氣使之全部變成紅棕色的氫氧化鐵膠體溶液,在金屬鐵存在的條件下,硫酸亞鐵與空氣中氧作用,生成氧化鐵(即鐵紅)沉積在晶核上,溶液中的硫酸根又與金屬鐵作用,重新生成硫酸亞鐵,
硫酸亞鐵再被空氣氧化成鐵紅繼續沉積,如此循環到整個過程結束,生成氧化鐵紅。其乾法硝酸與鐵片反應生成硝酸亞鐵,經冷卻結晶,脫水乾燥,經研磨後在600~700℃煅燒8~10h,再經水洗、乾燥、粉碎製得氧化鐵紅產品。也可以
氧化鐵黃為原料,經600~700℃煅燒製得氧化鐵紅。其4Fe(NO
3)
3=△=2Fe
2O
3+12NO
2↑+3O
2↑Fe
2O
3+n H
2O
==△==Fe
2O
3+nH
2O
主要用途
用於油漆、橡膠、塑膠、建築等的著色,是無機顏料,在塗料工業中用作防鏽顏料。用作橡膠、人造大理石、地面水磨石的著色劑,塑膠、石棉、人造革、皮革揩光漿等的著色劑和填充劑,精密儀器、光學玻璃的拋光劑及製造磁性材料鐵氧體元件的原料等。
用於電子工業、通訊整機、電視機、計算機等磁性原料及行輸出變壓器、開關電源及其高U及高UQ等的鐵氧體磁芯
用於各類藥片、藥丸的外衣糖衣著色用
用作磁性材料、顏料及製取還原劑、拋光劑、催化劑等;用於藥片糖衣和膠囊等的著色
用作防鏽漆的顏料。因該品製成的雲母氧化鐵防鏽漆抗水滲性好,防鏽性能優異,可以取代
紅丹食用紅色素。日本用於赤豆飯、魔芋粉食品。對曾用防腐劑處理果柄切口的香蕉加以識別時用。美國多用於貓食、狗食和包裝材料
無機紅色顏料主要用於硬幣的透明著色,也用於油漆、油墨和塑膠的著色
廣泛用於油漆、橡膠、塑膠化妝品、建築精磨材料、精密五金儀器、光學玻璃、搪瓷、文教用品、皮革、磁性合金和高級合金鋼的著色;主要用作磁性材料、顏料、擦光劑、催化劑等,還用於電訊、儀表工業;主要用作磁性材料、顏料、擦光劑、催化劑等,還用於電訊、儀表工業無機紅色顏料。
用於和CO反應煉製生鐵(H2,C,Al)
Fe2O3+3CO=高溫=2Fe+3CO2
Fe2O3+3H2=高溫=2Fe+3H2O
2Fe2O3+3C=高溫=4Fe+3CO2↑
Fe2O3+ 2Al=高溫=2Fe+Al2O3
 來源於維基百科
來源於維基百科
 來源於維基百科
來源於維基百科