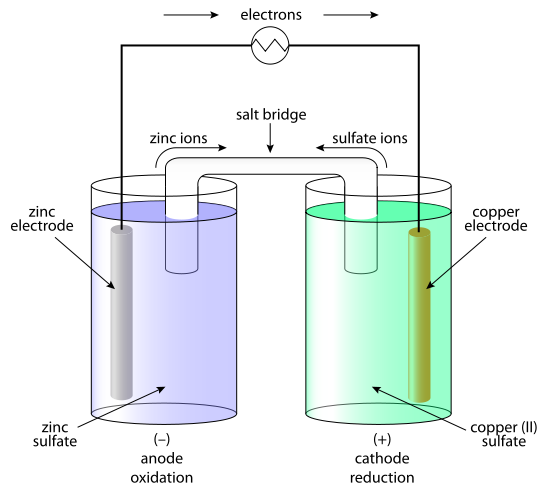
基本介紹
- 中文名:鋅銅電池
- 別名:丹尼爾電池
- 發明人:John Frederic Daniell
- 發明時間:1836年
簡介,熱力學理論,
簡介

熱力學理論

其中,U 是內能, S 是熵, T 是絕對溫度,V 是體積, P 是壓強。
假設電池為丹尼耳電池,由於在這種電池內進行的反應不會產生氣體,系統體積不變,方程式簡化為

讓熵 S 為T 和 Z 的函式,熵的全微分為

假設等溫過程,那么,方程式右手邊的第一個項目等於零:

將這方程式帶入內能的方程式:

這方程式右手邊的第二個項目是“充電熱”(heat of charging),定義為在一個等溫可逆的充電過程,系統的熱能吸收率 :
:


吸收率 比較不容易計算,可以找更有用的變數替換。思考亥姆霍茲自由能 F :
比較不容易計算,可以找更有用的變數替換。思考亥姆霍茲自由能 F :


所以, 是一對共軛變數(Conjugate variables)。其馬克士威關係式為:
是一對共軛變數(Conjugate variables)。其馬克士威關係式為:


帶入內能的方程式:

通常,電動勢跟溫度T 、電荷量 Z 有關。假若,能夠使丹尼耳電池內的溶液保持飽和狀態,有很多離子化合物隨時準備分解進入溶液,則電動勢跟電荷量無關,只跟溫度有關:

對於丹尼耳電池,體積不變,假設等壓過程,則焓的改變 ,稱為“反應熱”,等於內能的改變:
,稱為“反應熱”,等於內能的改變:


使得一莫耳的金屬原子進入溶液所需要的電荷量為

其中, z 是金屬離子的電價, 是亞佛加厥常數, e 是基本電荷量。
是亞佛加厥常數, e 是基本電荷量。

假設恆壓、恆體積,則電池的熱力學性質與電動勢的緊密關係,以方程式表達為