基本介紹
- 中文名:銀鋅蓄電池
- 外文名:Silver zinc battery
- 電解液:氫氧化鉀溶液
- 特點:正極為氧化銀,負極為鋅
- 用途:宇宙航行、人造衛星的電源
- 優點:放電電壓平穩、自放電小
- 缺點:壽命短、造價很高
發展歷程,工作原理,放電特性,電動勢,內電阻,放電電壓,充電,充電電壓,充電方法,注意問題,主要故障,
發展歷程
這種電池是由一系列圓形鋅片和銀片相互交迭而成的裝置,在每一對銀片和鋅片之間,用一種在鹽水或其他導電溶液中浸過的紙板隔開。銀片和鋅片是兩種不同的金屬,鹽水或其他導電溶液作為電解液,它們構成了電流迴路。這是一種比較原始的電池,是由很多銀鋅電池連線而成的電池組。
經過了200多年的更迭,銀鋅蓄電池至今仍然出現在我們的手錶、計算器等低耗電設備中。既然銀鋅蓄電池有那么久遠的歷史,為什麼至今才被當作鋰電池最有希望的接班人推出?其實自問世以來,民用的銀鋅電池就只能提供較低的電壓和電流,電池容量也相當小。普通的鋅銀電池的正極是氧化汞加石墨,或者是氧化銀加石墨,負極材料是金屬鋅,電解質是強鹼氫氧化鉀。普通銀鋅電池性能穩定,不可充電,占據了紐扣電池市場的半壁江山。在上世紀七十年代,人們才開發出了銀鋅蓄電池。銀鋅蓄電池正極採用Ag2O2 + 2H2O + 4e→2Ag + 4OH-,負極採用2Zn + 4OH- →2Zn(OH)2 + 4e,可以擁有極高的電容量和穩定的電池性能。大容量銀鋅蓄電池價格驚人,在當今的太空梭、飛彈、魚雷等尖端領域才能找到大容量銀鋅蓄電池的身影。
對於數碼設備來說,在不考慮成本的情況下,銀鋅蓄電池將會使最佳的選擇。為了實現銀鋅蓄電池低價化的目標,一家叫做Zinc Matrix的公司自1999年開始就在風險投資的助力下開發低成本長壽命的銀鋅充電電池。經過了幾年的努力,在2006年Intel信息技術峰會上,Zinc Martix展出了它們首個民用銀鋅充電電池原型。初次展出的該款電池只有1.6V電壓,但電池容量可以達到10AH。在隨後的兩年間,Zinc Martix改名為ZPower,繼續從事銀鋅電池的改良設計。2008年5月ZPower公司宣布旗下的銀鋅充電電池在同等體積下能獲得超過鋰電池30%~40%的電容量,並且較後者更安全耐用。 最初的銀鋅電池原型
最初的銀鋅電池原型
 最初的銀鋅電池原型
最初的銀鋅電池原型工作原理
銀鋅蓄電池在充好電後,其正極板的活性物質是過氧化銀(Ag2O2),負極板的活性物質是鋅,電解液是以氫氧化鉀為主,並配以鋅酸鹽的飽和水溶液。放完電後,正極板的活性物質變為銀,負極板則變為氫氧化鋅[Zn(OH)2]。
放電時,在負極鋅與電解液中的氫氧根離子化合,生成氫氧化鋅,並放出兩個電子,其化學反應式為:
Zn+2OH-→Zn(OH)2+2e
在正極,化學反應分兩個階段進行。第一階段,過氧化銀獲得電子並與水化合,生成氧化銀(Ag2O)和氫氧根離子,其化學反應式為:
Ag2O2+H2O+2e→Ag2O+OH-
當放電進行到一定程度時,轉入第二階段,氧化銀又獲得電子,並與水化合,生成銀和氫氧根離子,其化學反應式為:
Ag2O+H2O+2e→2Ag+OH-
與此同時,生成的銀還會與過氧化銀進行如下反應:
2Ag+Ag2O2→2Ag2O
綜合以上4個反應式,得到放電時的化學反應式如下:
Ag2O2+ 2Zn + 2H2O→2Ag + 2Zn(OH)2
從上述化學反應過程可知,在放電時負極板上的鋅被氧化,生成氫氧化鋅,同時消耗掉氫氧根離子;正極板上的過氧化銀被還原,先生成氧化銀,繼而生成銀,同時消耗掉水,並產生氫氧根離子;電解液中的氫氧化鉀並無消耗掉,離子鉀和離子氫氧根僅是在兩極間起輸送電能的作用,但水則參與化學反應,不斷被極板吸收,氫氧化鉀的濃度越來越大。
銀鋅蓄電池的化學反應也是可逆的,故充、放電的化學反應式為:
Ag2O2+ 2Zn + 2H2O 2Ag + 2Zn(OH)2
2Ag + 2Zn(OH)2
放電特性
電動勢
銀鋅蓄電池電動勢的變化,主要受正極板的化學反應階段性影響,而與電解液的密度無關。 銀鋅蓄電池正、負極的電極電位φ與氫氧化鉀百分比濃度N的關係如圖1所示。從圖中可以看出氫氧化鉀濃度變化(相當於密度變化)時,正、負極的電極電位都要變化,但它們的差值即電池的電動勢基本保持不變。因此,銀鋅蓄電池的電動勢與電解液的密度無關。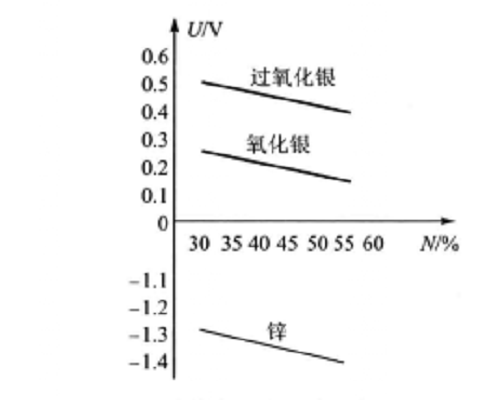 圖1 銀鋅蓄電池電極電位與氫氧化鉀濃度關係
圖1 銀鋅蓄電池電極電位與氫氧化鉀濃度關係
 圖1 銀鋅蓄電池電極電位與氫氧化鉀濃度關係
圖1 銀鋅蓄電池電極電位與氫氧化鉀濃度關係從圖1中可以看出,銀鋅蓄電池的電動勢隨正極活性物質的變化而有所不同。在放電過程中的第一階段,正極的電極電位主要取決於過氧化銀的電極電位。但在放電過程中,部分過氧化銀生成氧化銀,氧化銀的電極電位較低,所以正極電極電位逐漸下降,因此電動勢隨正極電極電位的下降而減小。放電過程的第二階段,正極電極電位變成以氧化銀的電極電位為主,電極電位有所降低,因此電動勢仍將繼續下降,但比第一階段緩慢。
內電阻
與鉛蓄電池一樣,銀鋅蓄電池的內電阻也由極板電阻、電解液電阻和極板與電解液的接觸電阻組成。由於銀鋅蓄電池在充、放電過程中不消耗氫氧化鉀,因此內電阻的變化受電解液的影響較小,主要由極板生成物質的電阻決定。例如在放電過程的第一階段,正極板生成阻值較高的氧化銀,負極板也部分被氫氧化鋅所遮蓋,因此內電阻將逐漸增大。笫二階段由於正極板生成導電性很好的銀,因此內電阻反而有所減小。
放電電壓
放電時電壓的變化情形如圖2所示,銀鋅蓄電池的放電電壓也有明顯的階段性。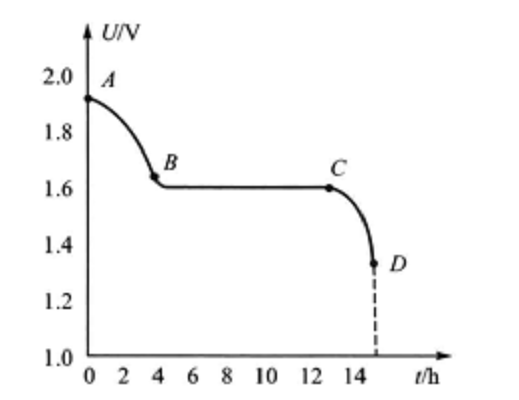 圖2 單體電池的放電電壓特性
圖2 單體電池的放電電壓特性
 圖2 單體電池的放電電壓特性
圖2 單體電池的放電電壓特性由於放電的第二階段有銀與過氧化銀結合,生成氧化銀後參與放電反應,所以這個階段持續的時問一般都大於放電總時間的70%,成為放電的主要階段。
充電
充電電壓
XYG-45型單體電池以4.5A電流充電時,其電壓曲線如圖3所示。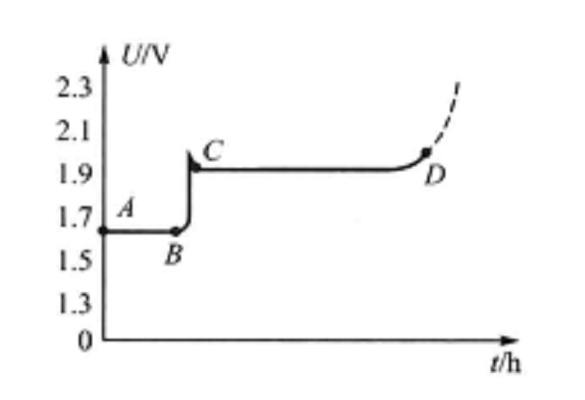 圖3 XYG-45型單體電池電池充電電壓特性
圖3 XYG-45型單體電池電池充電電壓特性
 圖3 XYG-45型單體電池電池充電電壓特性
圖3 XYG-45型單體電池電池充電電壓特性充電電壓特性曲線具有明顯的階段性。這主要是由正極化學反應的階段性決定的。第一個平階對應於曲線AB段,負極板的部分氫氧化鋅還原成鋅,正極板的銀氧化為氧化銀,電壓基本穩定在1.62-1.64V之間。到B點時,正極板表面被氧化銀所覆蓋,電解液擴散困難,極板裡層孔隙中的化學反應處於停滯狀態,電壓躍升到C點,然後轉為第二個平階對應於曲線CD段,負極板的氫氧化鋅繼續還原為鋅,正極板的氧化銀再氧化為過氧化銀。由於過氧化銀的導電性能比氧化銀好,所以電壓升高到生成過氧化銀的C點以後,充電電壓先要稍微下降,而後由於電動勢要緩慢上升,內電阻逐漸減小,因此電壓基本保持在1.92 V左右,直到D點為止。D點以後,極板上的活性物質已基本還原,若繼續充電,電壓將迅速升高,並開始電解水,正、負極板周圍分別冒出氧氣和氫氣,甚至會產生火災等危險。一般充電到2.05V即為終了電壓,應停止充電。如果過量充電,還會造成內部短路等故障。
充電方法
(1)正常充電
蓄電池完全放電後,先用8 A電流充電4 h,然後再用4 A電流充電6 h。壽命後期,因容量減小,一般充不到10 h,應在充電到終了電壓2.05 V時停止。
(2)補充充電
對半放電的蓄電池可用4.5 A的電流進行補充充電,充到終了電壓為止。
(3)緊急充電
在急需的情況下。可用22.5 A電流充電到2 V,然後保持當時的電壓繼續充電3 h。
(4)初次充電
銀鋅蓄電池以乾放電狀態出廠,啟用時要經過灌注電解液、浸泡、化成、檢驗容量和充電檢查等步驟以後方能使用。
(5)化成
進行兩個充、放電循環,使活性物質充分活化,以獲得良好的供電能力。
(6)檢查容量
以45 A電流放電到終了電壓,放電時間不應少於54 min。
(7)充電檢查
初次充電總共需要4-6天,所以在飛機上啟用銀鋅蓄電池需要一定的時間提前量。
注意問題
主要故障
銀鋅蓄電池常見的主要故障是內部短路。單體電池短路時將出現這些現象,即充電電壓很低或開路時電動勢迅速降低,溫度則迅速升高,導致極柱上的焊錫熔化,連線條燒紅,塑膠外殼變形,冒電解液,散發出難聞的氣味。造成內部短路的直接原因有:
(1)極板上端出現海綿狀鋅而短路。
(3)氧化銀溶解後,在隔板上沉積,使隔板強烈氧化,同時氧化銀生成金屬銀微粒,使隔板失去絕緣性而短路。

