基本介紹
- 中文名:表位作圖
- 外文名:Epitope mapping
- 性質:蛋白質化學方法
- 領域:生物學
簡介,用途,類型,
簡介
蛋白質抗原被降解為小片段,經測序後確定抗體結合的位點。雖然其結果在蛋白化學中是非常完美的例子,但是要確定某一抗原的全部表位需要大量的時間。分子克隆技術和肽鏈合成方法的進展極大地促進了表位作圖方法的改進。現已可以通過誘變、蛋白質合成或蛋白競爭結合方法鑑定其表位。此外,表位序列測定的套用對抗體結合表位的分析具有顯著的優越性。表位作圖方法也可用在其他方面的研究,如蛋白質功能活性的定位,以及特殊標誌的結合區分析。通過重組cDNA克隆的Tn5轉座子誘變技術獲得的瘧原蟲表面抗原表位作圖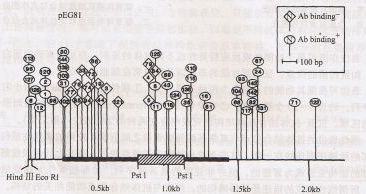 表位作圖
表位作圖
 表位作圖
表位作圖質粒pEG81轉座子(Tn5)表位作圖:該圖顯示了57個獨立的Tn5插入部分的位置,用Hindm消化純化的質粒DNA,確定丁pEG81的HindⅢ酶切位點的插入突變。PEG81::Tn5—121右側的插入能被PvuⅡ和BamHI消化,證明它們在pEG81的插入方向正確。PstI消化證實了Tn5的cDNA插入。用Psti消化pEGSl導致340bp限制性片段的消失,推測系Tn5插入該片段所致。圈中數字表示該插入對攜帶質粒細胞的溶解產物與2G3結合無影響,菱形內數字表示含質粒細胞溶解產物不再與抗體結合。
對單克隆抗體和多克隆抗體識別蛋白質抗原表位的確定為免疫化學分析提供了十分有用的信息。表位作圖方法是檢測免疫反應特異性和鑑定不同抗體的重要方法。它也被用來確定相關物質的特性,如蛋白修飾位點、蛋白片段的來源或該蛋白在細胞膜上的定位。利用結合特異性表位的抗體可以對蛋白質結構域、蛋白質功能和蛋白質間相互作用體可以確定相關蛋白質在細胞內的定位,以及測定相關蛋白質的特異性或修飾其功能。
用途
表位作圖可用於檢測免疫反應特異性或不同抗體的鑑別,亦可用來確定蛋白質的特性,如蛋白質的位點、蛋白質片段的來源以及蛋白質在細胞中的定位。
類型
表位可根據其功能的不同分為兩種不同類型:
①線性表位(1inear):為小的線狀肽鏈序列,約為5~20個胺基酸;
②構象表位(conformational):由蛋白摺疊而形成的較大的區域。抗原—抗體結合晶體結構研究表明存在兩種類型的表位。
線性表位的抗體結合位點與其胺基酸側鏈骨架之間形成了較強的多樣性結構,並與相鄰的肽鏈序列連線在一起,這些表位也被稱為連續性表位。事實上線性表位需要某些局部的結構變形或為緊密的、但並非連續的胺基酸序列,如那些兼性。螺旋結構。因此,所謂線性表位的描述是不夠確切的。所有與抗體結合位點功能相關的結構,均位於一個肽鏈片段之中。而來自於該片段之外的其他序列,對於抗體結合位點的構成並非重要。
構象表位宜對較大的蛋白區表位作圖。這些表位表現出側鏈間的相互作用,雖然在摺疊蛋白質結構中構象表位彼此非常靠近,但其間被較長的線性序列相互隔開。連續性表位或接近連續性的胺基酸序列對蛋白質的降解作用有抵抗能力。而那些非連續性表位結構在蛋白質未能摺疊的情況下將會失去活性,這也是兩種不同表位在功能上不同的關鍵所在。
在免疫印跡反應中,抗體能夠識別耐蛋白降解的表位,它們在蛋白抗原上的結合位點能夠被精確地定位,直到很小的肽鏈片段。
構象表位的精確定位極為困難。競爭性試驗可用來確定2個或2個以上的抗體是否識別相同的蛋白質抗原空間不連續表位或重疊位點。大分子蛋白質常含有50—100個胺基酸組成的不連續摺疊構象。因此,利用重組DNA技術,可以定位那些構象性表位,至少可以確定其肽鏈片段。
