蛋白質是重要的營養素,人和動物攝食蛋白質用以維持細胞、組織的生長、更新和修補;產生酶、激素、抗體和神經遞質等多種重要的生理活性物質,這是糖和脂類不可替代的。每克蛋白質在體內氧氣分解產生4千卡能量。
基本介紹
- 中文名:蛋白質的酶促降解
- 蛋白質:是重要的營養素
- 維持:細胞、組織的生長、更新和修補
- 產生:重要的生理活性物質
詳細解說,酶促降解,
詳細解說
蛋白質的營養價值取決於所含胺基酸的種類、數量及其比例,如果某種食物蛋白中必需胺基酸的種類和比例與人體組織蛋白接近,其營養價值就高。營養價值較低的蛋白質混合食用,可使必需胺基酸相互補充提高其營養價值,這稱為蛋白質的互補作用。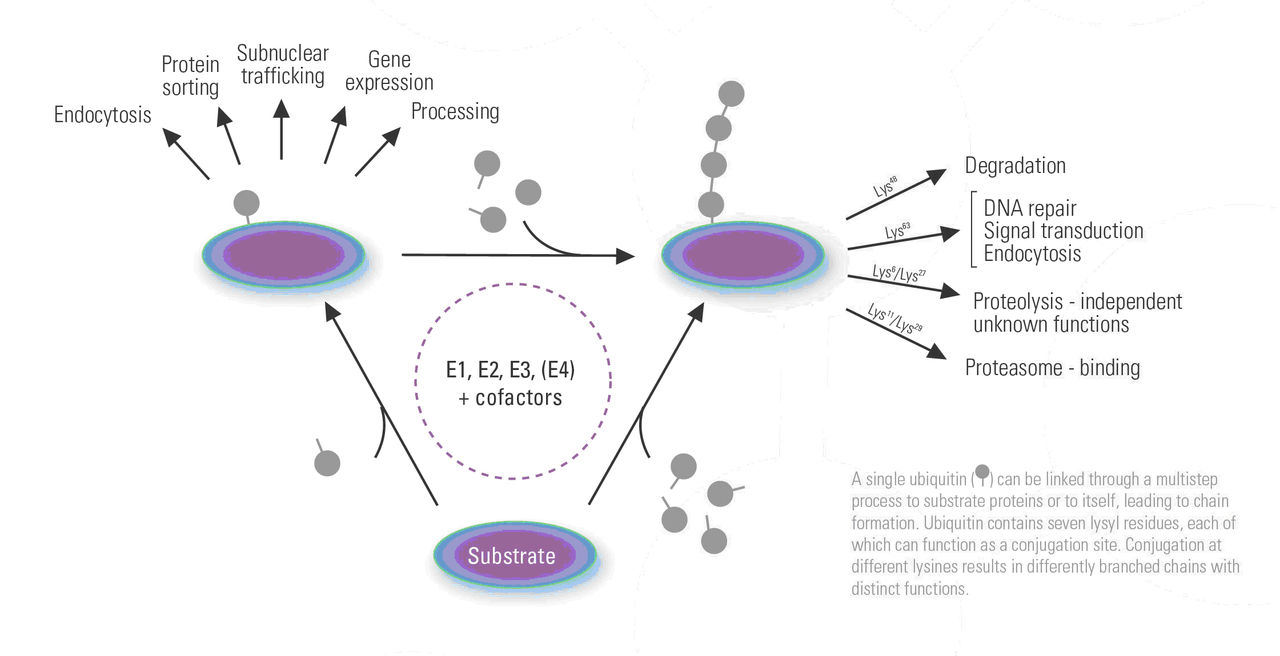

植物和大多數細菌能夠合成全部20種基本胺基酸。然而哺乳類不能全部合成。對於成人來說,纈氨酸、亮氨酸、異亮氨酸、蘇氨酸、甲硫氨酸、賴氨酸、苯丙氨酸和色氨酸必須由食物供應,稱為營養必需胺基酸,對嬰幼兒,組氨酸和精氨酸不能滿足營養需要量。可由生物機體合成的胺基酸稱為非必需胺基酸。
蛋白質的生理需要量根據氮平衡實驗,我國營養學會推薦成人每日需要量為80克。
酶促降解
蛋白質大分子難以通透生物膜吸收,有時有些抗原、毒素可少量通過黏膜細胞吞飲進入體內而引起過敏、毒性反應。食物蛋白必需經過消化,水解成胺基酸才被機體利用。消化自胃中開始,主要在小腸進行。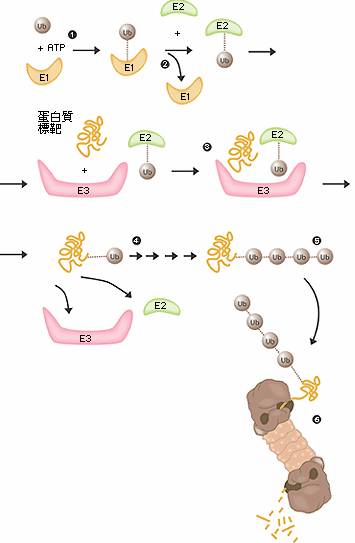

蛋白水解酶又稱肽酶,包括內肽酶、外肽酶、寡肽酶和二肽酶。內肽酶有胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶和彈性蛋白酶,對肽鏈內肽鍵的特異性不同。胃蛋白酶對底物特異性較低,主要水解Phe、Try C端的肽鍵;胰蛋白酶水解Lys、Arg C端;胰凝乳蛋白酶作用Phe、Try C端;彈性蛋白酶作用脂肪族胺基酸C端。羧肽酶、氨肽酶是外肽酶,羧肽酶B要求肽的C末端胺基酸殘基必須是Arg、Lys;羧肽酶A則水解除Arg、Lys,Pro或羥脯氨酸外的C末端胺基酸殘基。
胃黏膜主細胞分泌胃蛋白酶原(pepsinogen),經胃酸激活生成胃蛋白酶。胃蛋白酶有自身激活作用。胰酶的前體也是無活性的酶原,進入十二指腸後,胰蛋白酶原迅速被腸激酶激活;胰蛋白酶自身激活作用不強,加上胰液中存在的胰蛋白酶抑制劑,可保護胰臟免遭自身消化,但胰蛋白酶能迅速激活胰液中其他幾種酶原。
組織蛋白酶不同於消化道中的蛋白酶。動物死後,組織自溶和屍體腐爛與它有關。植物的種子、幼苗、葉和果實都含有蛋白酶,種子萌發時,蛋白酶的活力最強。某些微生物在適當的條件下能產生大量的細胞外蛋白酶,利用工業發酵可生產蛋白酶。
胺基酸的吸收主要在小腸,是一個耗能的主動吸收過程。外源性胺基酸和內源性胺基酸混合,共同組成胺基酸代謝庫,其去路大部分用以合成組織蛋白質。