基本介紹
- 中文名:艾得新
- 外文名:Iguratimod Tablets
- 通用名稱:艾拉莫德片
- 漢語拼音:Ailamode Pian
名稱:艾得辛,成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,
名稱:艾得辛
商品名稱:艾得辛英文名稱: 艾得辛(艾拉莫德片)
艾得辛(艾拉莫德片)
 艾得辛(艾拉莫德片)
艾得辛(艾拉莫德片)成份
本品活性成份為艾拉莫德。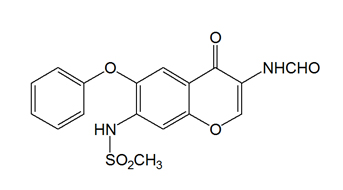 艾得辛(艾拉莫德片)分子結構式
艾得辛(艾拉莫德片)分子結構式
 艾得辛(艾拉莫德片)分子結構式
艾得辛(艾拉莫德片)分子結構式化學名稱:N-[3-(甲醯胺基)-4-氧-6-苯氧基-4H-1-苯並吡喃-7-基]-甲烷磺醯胺
分子式:C17H14N2O6S
分子量:374.37
性狀
本品為白色或類白色片
適應症
適用於活動性類風濕關節炎的症狀治療,適用於男性及治療期間無生育要求的婦女。
規格
25mg。
用法用量
口服。一次25mg (1片),飯後服用,一日2次,早晚各1次。
不良反應
1、在國內的II、III期臨床試驗中,共有518例活動性類風濕關節炎患者使用了本品。
II期臨床試驗有192例活動性類風濕關節炎患者使用了本品。在II期臨床試驗中:
常見藥物不良反應(>1/100,<1/10)主要有上腹部不適、氨基轉移酶升高、噁心、納差、皮疹或皮膚瘙癢、頭痛、頭暈、白細胞下降、耳鳴或聽力下降、乏力、腹脹、下肢浮腫、心悸、血紅蛋白下降、失眠、多汗、嘔吐、胸悶、血小板升高、血小板下降、心電圖異常、畏寒、嗜睡,精神不佳、雙手腫脹、月經失調、牙齦出血、面部浮腫。
III期臨床試驗有326例活動性類風濕關節炎患者使用了本品。在III期臨床試驗中:
很常見藥物不良反應(>1/10)主要有氨基轉移酶升高;
常見藥物不良反應(>1/100,<1/10)主要有白細胞減少、胃部不適、納差、皮疹、上腹部不適、噁心、腹脹、胃痛、血小板減少、反酸、腹痛、胃脹、視物模糊、皮膚瘙癢、十二指腸炎、胃炎、大便潛血、脫髮、失眠、心電圖異常、月經失調、血紅蛋白下降;
少見藥物不良反應(>1/1000,<1/100)主要有腹瀉、消化不良、喛氣、胃潰瘍、反流性食管炎、十二指腸潰瘍、胃竇部出血、嘔吐、發熱、咳嗽、口乾、口腔潰瘍、面部浮腫、皮膚水腫、疲乏、胸悶、胸痛、尿蛋白陽性、總膽紅素升高、流感樣症狀、上呼吸道感染、痘疹樣胃炎。
以上多數不良反應均在停藥後自行緩解或消失。
2、據文獻資料報導,在日本81家醫療機構中開展的一項為期28周、376例類風濕關節炎患者參加的隨機、雙盲、平行對照臨床試驗中,考察艾拉莫德片與安慰劑和柳氮磺胺吡啶治療類風濕關節炎的有效性與安全性(用法用量:艾拉莫德片最初4周為25mg/日,之後為50mg/日;柳氮磺胺吡啶1000 mg/日)。
該試驗中很常見藥物不良反應(>1/10)主要有氨基轉移酶升高;
常見藥物不良反應(>1/100,<1/10)主要有上腹痛、口腔炎、皮膚病;
少見藥物不良反應(>1/1000,<1/100)主要有黑便症、間質性肺炎、發熱、胃潰瘍。
據文獻資料報導,在日本90家醫療機構中開展的一項為期52周的單組、長期用藥的安全性臨床試驗中,共394例類風濕關節炎患者接受艾拉莫德治療,在開始4周時間裡,每天口服艾拉莫德25mg,在隨後的48周每天口服艾拉莫德50mg。其中有57例獲益患者繼續服用本品達100周。
該試驗中很常見藥物不良反應(>1/10)主要有氨基轉移酶升高、γ-谷氨醯轉肽酶和鹼性磷酸酶升高;
常見藥物不良反應(>1/100,<1/10)主要有β-N-乙醯-葡萄糖胺酶升高、膽紅素升高、肝功能檢查異常、膽鹼脂酶降低、大便潛血、血β2-微球蛋白升高、尿β2-微球蛋白升高、血嗜酸性粒細胞升高、紅細胞壓積降低、血紅蛋白降低、淋巴細胞計數降低、紅細胞降低、白細胞升高、尿素氮升高、血尿、蛋白尿、尿白細胞陽性、管型尿、尿沉渣陽性、血鐵離子降低、食慾減退、腹脹、腹痛、上腹痛、腹瀉、稀便、噁心、乾嘔、嘔吐、口腔炎、皮炎、濕疹、脫髮、瘙癢、鼻咽炎、頭暈(除眩暈外)、味覺障礙;
少見藥物不良反應(>1/1000,<1/100)主要有胃潰瘍、膿胸、間質性肺炎、敗血症。
禁忌
對本品任何成份過敏者禁用;
嚴重肝功能損害者禁用;
妊娠期婦女、哺乳期婦女以及治療期間有生育要求的婦女禁用。
服用阿司匹林或其他非甾體類抗炎藥後誘發哮喘、蕁麻疹或過敏反應的患者禁用。
有套用非甾體抗炎藥後發生胃腸道出血或穿孔病史的患者禁用。
有活動性消化道潰瘍/出血,或者既往曾復發潰瘍/出血的患者禁用。
注意事項
(1)肝毒性:臨床試驗發現本品可引起可逆性的肝臟酶升高,大多數氨基轉移酶升高為輕度[≤ 2倍 正常值上限(Upper Limit of Normal,簡稱ULN)],且通常在繼續治療過程中緩解;顯著升高(>3倍 ULN)不常發生,且通過降低劑量或停藥可緩解。大多數患者氨基轉移酶升高發生在用藥3個月內,服藥初始階段應定期檢查血液丙氨酸氨基轉換酶(ALT)和谷氨酸氨基轉換酶(AST),檢查間隔視病人情況而定。
有肝臟損害和明確的B型肝炎或者C型肝炎血清學指標陽性的患者慎用。用藥前及用藥後每月檢查ALT,檢查時間間隔視病人具體情況而定。
如果用藥期間出現ALT升高,調整劑量或中斷治療的原則:①如果ALT升高在正常值上限的2~3倍,在密切監測下可繼續給予艾拉莫德,劑量降低至25mg/日。②ALT升高2~3倍正常值上限,如果劑量降低後ALT仍維持在2~3倍正常值上限及3倍以上,須停藥,並加強護肝治療且密切觀察。
(2)活動性胃腸道疾病:對於有活動性胃腸疾病的患者慎用,需告知患者一旦發生黑便、貧血、異常胃/腹疼痛等症狀,及時通知醫生並儘早去醫院就診,一旦確診為胃潰瘍或十二指腸潰瘍,應立即停藥並進行對症治療。
(3)免疫活疫苗:治療期間接種免疫活疫苗的效果和安全性沒有臨床資料,因此服藥期間不應使用免疫活疫苗。
(4)免疫缺陷、未控制的感染、腎功能不全、骨髓發育不良的患者慎用。
(5)本品未進行系統的致癌性試驗,故累積用藥時間暫限定在24周內(含24周)。
孕婦及哺乳期婦女用藥
無相關臨床試驗資料,基於大鼠動物生殖毒性試驗結果提示,妊娠期婦女、哺乳期婦女以及治療期間有生育要求的婦女禁用。
兒童用藥
尚未在兒童和青少年對本品的有效性和安全性進行足夠的和良好對照的研究,且無可靠參考文獻。兒童和青少年應避免使用本品。
老年用藥
未進行系統的老年患者用藥安全性研究,如使用需在醫生指導下慎用。
藥物相互作用
未系統研究本品與其他藥物的相互作用。
體外試驗表明,艾拉莫德對CYP2D6、CYP1A2、CYP2C9、CYP2C19和CYP3A4基本無抑制作用,表明本品不會因抑制上述P450同工酶而對通過這些酶代謝的藥物產生影響。
藥物過量
對藥物過量患者用藥的安全性尚不明確。如果劑量過大或出現毒性反應時,推薦給予活性炭或血液透析予以消除。
臨床試驗
本品II期、III期多中心臨床試驗(共780例)由上海交通大學醫學院附屬仁濟醫院為組長單位的協作組共同完成。
II期臨床試驗:採用多中心、隨機、雙盲、安慰劑對照設計方法,評價本品的有效性和安全性,在活動性類風濕關節炎患者中比較安慰劑組、25mg組、50mg組的量效關係和安全性的差異。用法用量:25mg組:每日早晨飯後服用25mg(1片),1日1次,共24周;50mg組:每日早晚飯後各服用25mg(1片),1日2次,共24周。在6周、12周、18周和24周進行有效性和安全性評價。有效性依據美國風濕病學會改善標準(ACR20、ACR50、ACR70),共觀察了活動性類風濕關節炎患者288例,可評價病例280例,分別是安慰劑組95例,25mg組92例,50mg組93例。結果見表1。
表1 安慰劑組、25mg組和50mg組療效-時間評價的比較(全分析集)
時間 | 療效 | 安慰劑組 (N=95) | 25mg組 (N=92) | 50mg組 (N=93) | P值 | |||
N | % | N | % | N | % | |||
6周 | ACR20 | 13 | 13.68 | 27 | 29.35 | 32 | 34.41 | 0.0012 |
ACR50 | 1 | 1.05 | 5 | 5.43 | 8 | 8.60 | 0.0188 | |
ACR70 | 0 | 0 | 1 | 1.09 | 2 | 2.15 | 0.1543 | |
12周 | ACR20 | 21 | 22.11 | 33 | 35.87 | 42 | 45.16 | 0.0008 |
ACR50 | 7 | 7.37 | 14 | 15.22 | 17 | 18.28 | 0.0314 | |
ACR70 | 2 | 2.11 | 3 | 3.26 | 6 | 6.45 | 0.1387 | |
18周 | ACR20 | 27 | 28.42 | 35 | 38.04 | 55 | 59.14 | <0.0001 |
ACR50 | 8 | 8.42 | 17 | 18.48 | 23 | 24.73 | 0.0029 | |
ACR70 | 2 | 2.11 | 11 | 11.96 | 10 | 10.75 | 0.0315 | |
24周 | ACR20 | 23 | 24.21 | 36 | 39.13 | 57 | 61.29 | <0.0001 |
ACR50 | 7 | 7.37 | 22 | 23.91 | 29 | 31.18 | <0.0001 | |
ACR70 | 1 | 1.05 | 13 | 14.13 | 13 | 13.98 | 0.0028 | |
註:ACR20的反應定義是:患者疼痛及腫脹關節數(28個)有20%的改善以及下列5項中至少3項的改善:①.受試者評估的疼痛(Visual Analogue Scale/Score,簡稱VAS)評分;②.受試者評估的疾病總體狀況VAS評分;③.研究者評估的疾病總體狀況VAS評分;④.健康狀況問卷(Health Assessment Questionnaire,簡稱HAQ);⑤.急性期反應物(血沉或C反應蛋白)。ACR50、ACR70採用相同的標準分別定義為50%及70%的改善。每項指標的改善百分數=[(治療後值-治療前值)/治療前值*100%]。
試驗結果表明,艾拉莫德治療6周開始起效,安慰劑組、25mg組和50mg組療效差異有統計學意義。25mg組療效優於安慰劑組,50mg組療效優於25mg組。
III期臨床試驗:採用多中心、隨機、雙盲雙模擬、陽性對照試驗設計方法,評價本品的有效性和安全性,比較甲氨蝶呤組、試驗組1、試驗組2的量效關係和安全性的差異。受試者均為活動性類風濕關節炎患者。
用法用量:甲氨蝶呤組:第1-4周,1周1次,1次10mg(4片);第5-24周,1周1次,1次15mg(6片) ;共24周。試驗組1:第1-4周:每日早晨飯後服用25mg(1片),1日1次;第5-24周:每日早晚飯後各服用25mg(1片),1日2次;共24周。試驗組2:第1-24周:每日早晚飯後各服用25mg(1片),1日2次,共24周。在4周、10周、17周和24周進行有效性和安全性評價,有效性評價依據美國風濕病學會改善標準(ACR20、ACR50、ACR70),共觀察了活動性類風濕關節炎患者492例,可評價病例489例,分別是甲氨蝶呤組:163例、試驗組1:163例、試驗組2:163例。試驗結果見表2。
表2 甲氨蝶呤組、試驗組1、試驗組2 療效-時間評價的比較(全分析集)
時間 | 療效 | 甲氨蝶呤組 (N=163) | 試驗組1 (N=163) | 試驗組2 (N=163) | P值 | |||
N | % | N | % | N | % | |||
4周 | ACR20 | 37 | 22.70 | 36 | 22.09 | 43 | 26.38 | 0.8801 |
ACR50 | 10 | 6.13 | 3 | 1.84 | 11 | 6.75 | 0.0659 | |
ACR70 | 1 | 0.61 | 1 | 0.61 | 2 | 1.23 | 1.0000 | |
10周 | ACR20 | 87 | 53.37 | 64 | 39.26 | 77 | 47.24 | 0.0072 |
ACR50 | 27 | 16.56 | 21 | 12.88 | 30 | 18.40 | 0.3460 | |
ACR70 | 11 | 6.75 | 8 | 4.91 | 14 | 8.59 | 0.4912 | |
17周 | ACR20 | 97 | 59.51 | 76 | 46.63 | 91 | 55.83 | 0.0161 |
ACR50 | 52 | 31.90 | 44 | 26.99 | 47 | 28.83 | 0.3032 | |
ACR70 | 22 | 13.50 | 15 | 9.20 | 23 | 14.11 | 0.2110 | |
24周 | ACR20 | 101 | 61.96 | 83 | 50.92 | 104 | 63.80 | 0.0397 |
ACR50 | 70 | 42.94 | 53 | 32.52 | 62 | 38.04 | 0.0457 | |
ACR70 | 34 | 20.86 | 27 | 16.56 | 30 | 18.40 | 0.2779 | |
試驗結果表明:在24周終點時艾拉莫德片ACR20非劣(非劣效界值為10%)於甲氨蝶呤片。
表3顯示II期、III期臨床試驗各單項指標的變化。
表3 ACR反應標準各項指標的改變*
各項指標 | 安慰劑-對照研究 | 甲氨蝶呤-對照研究 | ||||
Ⅱ期臨床試驗(24周) | Ⅲ期臨床試驗(24周) | |||||
25mg組 n=93 | 50mg組 n=94 | 安慰劑組 n=95 | 試驗組1 n=163 | 試驗組2 n=163 | 甲氨蝶呤 n=165 | |
壓痛關節數 | 4.0 | 6.0 | 2.0 | 5.0 | 7.0 | 7.0 |
腫脹關節數 | 4.5 | 6.0 | 2.0 | 4.0 | 4.0 | 5.0 |
患者總體評價 | 18.0 | 30.0 | 5.0 | 30.0 | 28.0 | 30.0 |
醫生總體評價 | 18.5 | 31.0 | 3.0 | 27.0 | 25.0 | 30.0 |
日常生活能力(HAQ) | 0.25 | 0.40 | 0.10 | 0.40 | 0.40 | 0.45 |
疼痛程度 | 15.0 | 30.0 | 5.0 | 26.0 | 25.0 | 30.0 |
紅細胞沉降率 | 3.5 | 12.0 | -4.0 | 6.0 | 8.0 | 8.0 |
C反應蛋白 | 2.09 | 1.81 | 0.00 | 1.04 | 0.86 | 1.97 |
以下為ACR反應指數未包括的指標 | ||||||
晨僵(min) | 60.0 | 60.0 | 30.0 | 60.0 | 60.0 | 60.0 |
IgA | _ | _ | _ | 0.42 | 0.54 | 0.23 |
IgG | _ | _ | _ | 0.76 | 1.30 | 0.55 |
IgM | _ | _ | _ | 0.31 | 0.32 | 0.24 |
*末次觀察值結轉(LOCF):正值表明改善
1基於28個關節數
2直觀類比標尺0=最佳,100=最壞
藥理毒理
藥理作用
艾拉莫德可以抑制膠原性關節炎模型大鼠的足腫脹,緩解大鼠骨和軟骨組織的破壞。艾拉莫德的作用機制尚不完全清楚。文獻報導,在體外艾拉莫德可以抑制核因子-κB(NF-κB)的活性,進而抑制炎性細胞因子(白介素-1、白介素-6、白介素-8、腫瘤壞死因子α)的生成。艾拉莫德還可以在體外與小鼠和人的B細胞直接發生作用,抑制免疫球蛋白的生成。此外有文獻報導,艾拉莫德在體外可抑制純化的環氧酶-2(COX-2)的活性(IC50=7.7μg/ml),但對環氧酶-1(COX-1)的活性無影響。
毒性作用
遺傳毒性:艾拉莫德鼠傷寒沙門氏菌回復突變試驗、中國倉鼠肺細胞染色體畸變試驗和小鼠骨髓微核試驗的結果均為陰性。
生殖毒性:雌性和雄性大鼠在交配前經口服用艾拉莫德,在劑量達到60mg/kg/天時(按體表面積折算計,約相當於人體推薦劑量的10倍),交配率出現下降。在胚胎髮育階段,雌性妊娠大鼠經口服用艾拉莫德60mg/kg/天,胎仔的成活率明顯減少。雌性大鼠在圍產期經口服用艾拉莫德,當劑量等於或大於30mg/kg/天時,仔鼠出現體重增長緩慢,生理和神經發育延緩。
致癌性:尚未進行艾拉莫德系統的致癌性試驗。
藥代動力學
24例健康志願者,每組12例。單次給藥劑量組:分為低25mg、高50mg兩個劑量組。多次給藥劑量組:按低劑量25mg/次,12h給藥一次,連續給藥6日。進食後給藥:選擇單次給藥高劑量組受試者50mg/次口服。
艾拉莫德在體內符合一室模型的藥代動力學特性,在治療劑量範圍內(25mg~50mg),艾拉莫德暴露程度與劑量呈比例,主要藥代動力學參數無性別差異。艾拉莫德的生物利用度不受食物影響。
口服治療劑量的艾拉莫德後,於3.1~4.6小時達血藥濃度峰值。每日2次,多次給藥後3日內達到穩態濃度。平均穩態濃度為Cav為0.76±0.19(μg/ml) ,平均表觀分布容積0.20 L·kg,平均血漿清除率0.0133 L·h·kg 艾拉莫德消除半衰期為10.5小時,觀察到血漿中有一定的藥物蓄積。尿藥排泄試驗表明,口服50mg,空腹組和飲食組分別僅有0.0685±0.056%,0.0608±0.033%以原型藥從腎臟排除。
未在特殊人群,包括老人、兒童和肝腎功能不全的患者中進行藥代動力學試驗。
貯藏
遮光,密閉,不超過25℃保存。
包裝
藥用複合膜包裝。7片/盒;14片/盒;21片/盒;28片/盒;56片/盒。
有效期
24個月
 江蘇先聲藥業有限公司
江蘇先聲藥業有限公司