基本介紹
定義,衣被的作用,相關馬達蛋白,衣被類型,具體介紹,衣被的形成,定向機制,關鍵性蛋白,SNAREs,Rabs,細胞內吞外排,受體介導內吞,外排作用,諾貝爾獎,
定義
膜泡運輸:大分子和顆粒物質被運輸時並不直接穿過細胞膜,都是由膜包圍形成膜泡,通過一系列膜囊泡的形成和融合來完成轉運的過程,故稱為膜泡運輸。
衣被的作用
大多數運輸小泡是在膜的特定區域以出芽的方式產生的。其表面具有一個籠子狀的由蛋白質構成的衣被(coat)。這種衣被在運輸小泡與靶細胞器的膜融合之前解體。衣被具有兩個主要作用:①選擇性的將特定蛋白聚集在一起,形成運輸小泡;②如同模具一樣決定運輸小泡的外部特徵,相同性質的運輸小泡之所以具有相同的形狀和體積,與衣被蛋白的組成有關。
相關馬達蛋白
有3類:一類是動力蛋白(dynein),可向微管負端移動;另一類為驅動蛋白(kinesin),可牽引物質向微管的正端移動;第三類是肌球蛋白(myosin),可向微絲的正極運動。在馬達蛋白的作用下,可將膜泡轉運到特定的區域。
衣被類型
已知三類具有代表性的衣被蛋白,即:籠形蛋白(clathrin)(又稱格線蛋白)、COPI和COPII,各介導不同的運輸途徑。
衣被小泡的類型與功能
GTP酶
組成與銜接蛋白
運輸方向
clathrin
Arf
Clathrin重鏈與輕鏈,AP2
Clathrin重鏈與輕鏈,AP1
高爾基體→內體
Clathrin重鏈與輕鏈,AP3
高爾基體→溶酶體
高爾基體→植物液泡
COP I
Arf
COPαββ’γδεζ
高爾基體→內質網
COP II
Sar 1
Sec23/Sec24複合體,Sec 13/31複合體, Sec 16,Sec 12
內質網→高爾基體
具體介紹
籠形蛋白衣被小泡
籠形蛋白衣被小泡是最早發現的衣被小泡,介導高爾基體到內體、溶酶體、植物液泡的運輸,以及質膜到內膜區隔的膜泡運輸。
籠形蛋白分子由3個重鏈和3個輕鏈組成,形成一個具有3個曲臂的形狀(triskelion)。許多籠形蛋白的曲臂部分交織在一起,形成一個具有5邊形網孔的籠子。
當籠形蛋白衣被小泡形成時,可溶性蛋白動力素(dynamin)聚集成一圈圍繞在芽的頸部,將小泡柄部的膜儘可能地拉近(小於1.5nm),從而導致膜融合,掐斷(pinch off)衣被小泡。動力素是一種GTP酶,調節小泡以出芽形式脫離膜的速率。動力素可以召集其它可溶性蛋白在小泡的頸部聚集,通過改變膜的形狀和膜脂的組成,促使小跑頸部的膜融合,形成衣被小泡。
當衣被小泡從膜上釋放後,衣被很快就解體,屬於hsp70家族的一種分子伴侶(molecular chaperone)充當衣被解體的ATP酶,一種輔蛋白(auxillin)可以激活這種ATP酶。
COP I衣被小泡
負責回收、轉運內質網逃逸蛋白(escaped proteins)返回內質網。起初發現於高爾基體碎片,在含有ATP的溶液中溫育時,能形成非籠形蛋白包被的小泡。進一步的研究發現這種衣被蛋白複合體包含多達7種肽鏈。
內質網向高爾基體輸送運輸小泡時,一部分自身的蛋白質也不可避免的被運送到了高爾基體,如不進行回收則內質網因為磷脂和某些蛋白質的匱乏而停止工作。內質網通過兩種機制維持蛋白質的平衡 :一是轉運泡將應被保留的駐留蛋白排斥在外,例如有些駐留蛋白參與形成大的複合物,因而不能被包裝在出芽形成的轉運泡中,結果被保留下來;二是通過對逃逸蛋白的回收機制,使之返回它們正常駐留的部位。
內質網的正常駐留蛋白,不管在腔中還是在膜上,它們在C端含有一段回收信號序列(retrieval signals),如果它們被意外地逃逸進入轉運泡從內質網運至高爾基體cis面,則cis面的膜結合受體蛋白將識別並結合逃逸蛋白的回收信號,形成COPI衣被小泡將它們返回內質網。內質網腔中的蛋白,如蛋白二硫鍵異構酶和協助摺疊的分子伴侶,均具有典型的回收信號Lys-Asp-Glu-Leu(KDEL)。內質網的膜蛋白(如SRP受體)在C端有一個不同的回收信號,通常是Lys-Lys-X-X(KKXX,X:任意胺基酸),同樣可保證它們的回收。
COP I衣被小泡還可以介導高爾基體不同區域間的蛋白質運輸。
COPⅡ衣被小泡
介導從內質網到高爾基體的物質運輸。最早發現於酵母ER在ATP存在的細胞質液中溫育時,ER膜上能形成類似於COP I的衣被小泡,某些溫度敏感型的酵母,由於COP II衣被蛋白發生變異,在特定溫度下會在內質網中積累蛋白質。
COP II衣被由多種蛋白質構成,其中Sar1GTP酶與Sec23/Sec24複合體結合在一起,形成緊緊包圍著膜的一層衣被,Sec13/Sec31複合體形成覆蓋在外圍的一層衣被,Sec16推測可能是一種骨架蛋白,Sec12是Sar1的鳥苷酸交換因子。真核生物的COP II衣被蛋白亞單位具有一些橫向同源物(Paralog)[1],這些同源物可能介導不同的蛋白質轉運,具有不同的調節機制。在實驗條件下,純化的Sar1、Sec23/Sec24、Sec13/Sec31等5種成分足以在人工脂質體上形成小泡,說明這些成分具有改變膜的形狀和掐斷運輸小泡的功能。
COP II衣被小泡形成與內質網的特殊部位,稱為內質網出口(exit sites),這些部位沒有核糖體,由交織在一起的管道和囊泡組成網路結構。
COP II衣被所識別的分選信號位於跨膜蛋白胞質面的結構域,形式多樣,有些包含雙酸性基序[DE]X[DE](D為Asp,E為Glu,X為任何一種胺基酸),如Asp-X-Glu序列,其他一些具有短的疏水基序,如FF,YYM,FY,LL,IL等等(其中F為Phe,Y為Tyr,M為Met,L為Leu,I為Ile)。
衣被的形成
衣被是在一類叫作衣被召集GTP酶(coat-recruitment GTPase)作用下形成的。衣被召集GTP酶通常為單體GTP酶(monomeric GTPase),也叫G蛋白,起分子開關的作用,結合GDP的形式沒有活性,位於細胞質中,結合GTP而活化,轉位至膜上,能與衣被蛋白結合,促進核化和組裝。
G蛋白具有兩類重要的調節蛋白,即:鳥苷酸交換因子(guanine-nucleotide exchange factor,GEF)和GTP酶激活蛋白(GTPase activating protein, GAP)。GEF的作用是使G蛋白釋放GDP,結合GTP而激活。GAP的作用是激活G蛋白的酶活性,使GTP水解,G蛋白失活,G蛋白本身的GTP酶活性不高。除單體G蛋白以外,三聚體G蛋白也起分子開關的作用,控制衣被小泡的形成。
衣被召集GTP酶包括Arf蛋白和Sar 1蛋白(圖6-9),Arf參與高爾基體上籠形蛋白衣被與COP I衣被的形成,Sar 1參與內質網上COP II衣被的形成,兩者的作用方式大體相似。質膜上籠形蛋白衣被的形成也與GTP酶有關,但其成分尚不明確。
衣被召集GTP酶大量存在於細胞質中,但處於結合GDP的失活狀態。當內質網上要形成COPII衣被小泡時,Sar 1釋放GDP結合GTP而激活,激活的Sar 1暴露出一條脂肪酸的尾巴,插入內質網膜,然後開始召集衣被蛋白,以衣被蛋白為模型形成運輸小泡。活化的衣被召集GTP酶還可以激活磷脂酶D(phospholipase D),將一些磷脂水解,使形成衣被的蛋白質牢固地結合在膜上。
衣被召集GTP酶對衣被的形成起動態調節作用,當多數衣被召集GTP酶處於結合GTP的狀態時,它催化衣被的形成;反之當多數衣被召集GTP酶處於結合GDP的狀態時,它催化衣被的解體。因此衣被的形成過程是邊形成便解體的動態過程,只有在組裝速率大於解體速率時,才能形成衣被小泡。
定向機制
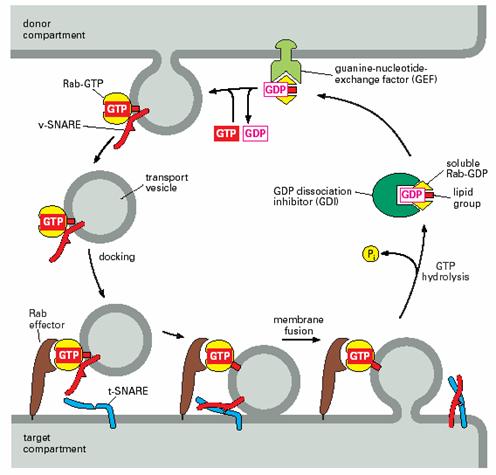
衣被小泡沿著細胞內的微管被運輸到靶細胞器,馬達蛋白水解ATP提供運輸的動力。各類運輸小泡之所以能夠被準確地和靶膜融合,是因為運輸小泡表面的標誌蛋白能被靶膜上的受體識別,其中涉及識別過程的兩類關鍵性的蛋白質是SNAREs(soluble NSF attachment protein receptor)和Rabs(targeting GTPase)。其中SNARE介導運輸小泡特異性停泊和融合,Rab的作用是使運輸小泡靠近靶膜。
關鍵性蛋白
SNAREs
在SNAREs介導新一輪的運輸小泡停泊之前,SNAREs必須以分離的狀態存在,NSF(N-ethylmaleimide-sensitive fusion protein, NSF)催化 SNAREs的分離,NSF是一種類似分子伴侶(分子伴娘)的ATP酶,能夠利用ATP作為能量通過插入幾個適配蛋白(adaptor protein)將SNAREs複合體的螺旋纏繞分開。
精卵的融合、成肌細胞的融合均涉及SNAREs,另外病毒融合蛋白的工作原理與SNAREs相似,介導病毒與宿主質膜的融合。
Rabs
Rab也叫targeting GTPase,屬於單體GTP酶,結構類似於Ras,已知30餘種。不同膜上具有不同的Rab,每一種細胞器至少含有一種以上的Rab。Rabs的作用是促進和調節運輸小泡的停泊和融合。與衣被召集GTP酶相似的是,起分子開關作用,結合GDP失活,位於細胞質中,結合GTP激活,位於細胞膜、內膜和運輸小泡膜上,調節SNAREs複合體的形成。Rabs的調節蛋白與其它G蛋白的相似。Rabs還有許多效應因子(effector),其作用是幫助運輸小泡聚集和靠近靶膜,觸發SNAREs釋放它的抑制因子(圖6-14)。許多運輸小泡只有在包含了特定的Rabs和SNAREs之後才能形成。
細胞內吞外排
受體介導內吞
批量內吞是非特異性地攝入細胞外物質,如培養細胞攝入辣根過氧化物酶。細胞表面的內陷(caveolae)是發生非特異性內吞的部位。
受體介導的內吞作用是一種選擇濃縮機制,既可保證細胞大量地攝入特定的大分子,同時又避免了吸入細胞外大量的液體。低密脂蛋白、運鐵蛋白、生長因子、胰島素等蛋白類激素、糖蛋白等,都是通過受體介導的內吞作用進行的。
衣被小窩(coated pits)是質膜向內凹陷的部位,約占肝細胞和成纖維細胞膜表面積的2%。受體大量集中於此處,凹陷的胞質側具有大量的籠形蛋白和銜接蛋白,類似的結構也存在於高爾基體的TGN區。受體在衣被小窩處的集中與是否結合配體無關。衣被小窩就相當一個分子過濾器(molecular filter),幫助細胞獲取所需要的大分子物質。
運輸小泡的衣被中,除籠形蛋白外,還有銜接蛋白(adaptin)。它介於籠形蛋白與配體受體複合物之間,起連線作用。銜接蛋白存在有不同的種類,可分別結合不同類型的受體。
跨膜受體蛋白的胞質端有一個由4個胺基酸殘基組成的序列(Tyr-X-X-Φ),此序列是發生內吞作用的信號,X表示任何一種胺基酸,Φ為分子較大的疏水胺基酸,如Phe、Leu、Met等,銜接蛋白對此序列有識別能力。
受體同配體結合後啟動內化作用,籠形蛋白開始組裝。在dynamin的作用下掐斷後形成衣被小泡(coated vesicles)。衣被小泡進入胞質後,衣被蛋白隨即脫去,分子返回到質膜下方,重又參與形成新的衣被小泡。其過程和高爾基體的TGN區形成溶酶體小泡的過程相似。
膽固醇主要在肝細胞中合成,隨後與磷脂和蛋白質形成低密度脂蛋白(low-density lipoproteins,LDL),釋放到血液中。LDL顆粒的質量為3X106Da,直徑20~30nm,芯部含有大約1500個膽固醇分子,這些膽固醇分子被酯化成長鏈脂肪酸。芯部周圍由一脂單層包圍,脂單層包含磷脂分子和未酯化的膽固醇以及一個非常大的單鏈糖蛋白質 (apolipoprotein B-100),這個蛋白質分子可以和靶膜上的受體結合。
當細胞進行膜合成需要膽固醇時,細胞即合成LDL跨膜受體蛋白,並將其嵌插到質膜中。受體與LDL顆粒結合後,形成衣被小泡;進入細胞質的衣被小泡隨即脫掉籠形蛋白衣被,成為平滑小泡,同早期內體融合,內體中PH值低,使受體與LDL顆粒分離;再經晚期內體將LDL送入溶酶體。在溶酶體中,LDL顆粒中的膽固醇酯被水解成游離的膽固醇而被利用。細胞對膽固醇的利用具有調節能力,當細胞中的膽固醇積累過多時,細胞即停止合成自身的膽固醇,同時也關閉了LDL受體蛋白的合成途徑,暫停吸收外來的膽固醇。有的人因為LDL受體蛋白編碼的基因有遺傳缺陷,造成血液中膽固醇含量過高,因而會過早地患動脈粥樣硬化症(atherosclerosis),這種人往往因易患冠心病而英年早逝。
在受體介導的內吞作用過程中,不同類型的受體具有不同的胞內體分選途徑:①大部分受體返回它們原來的質膜結構域,如LDL受體又循環到質膜再利用;②有些受體不能再循環而是最後進入溶酶體,在那裡被消化,如與表皮生長因子(epidermal growth factor,EGF)結合的細胞表面受體,大部分在溶酶體被降解,從而導致細胞表面EGF受體濃度降低,稱為受體下行調節(receptor down-regulation);③有些受體被運至質膜不同的結構域,該過程稱作穿胞運輸(transcytosis)。在具有極性的上皮細胞,這是一種將內吞作用與外排作用相結合的物質跨膜轉運方式,即轉運的物質通過內吞作用從上皮細胞的一側被攝人細胞,再通過外排作用從細胞的另一側輸出。如母鼠的抗體從血液通過上皮細胞進入母乳中,乳鼠腸上皮細胞將抗體攝人體內,都是通過跨細胞的轉運完成的。
外排作用
組成型的外排途徑(constitutive exocytosis pathway):所有真核細胞都有從高爾基體TGN區分泌囊泡向質膜運輸的過程,其作用在於更新膜蛋白和膜脂、形成質膜外周蛋白、細胞外基質、或作為營養成分和信號分子。
諾貝爾獎
2013年諾貝爾生理學&醫學獎
2013年10月7日11時30分(台北時間10月7日17時30分),三位科學家因為闡明囊泡運輸的機制而獲13年諾貝爾獎。
2013年諾貝爾生理學或醫學獎獲得者是美國科學家詹姆斯-E・羅斯曼、美國科學家蘭迪-W・謝克曼和德國科學家托馬斯-C・蘇德霍夫。瑞典卡羅琳醫學院7日宣布,將2013年諾貝爾生理學或醫學獎授予2名美國科學家和1名德國科學家,以表彰他們發現細胞內部囊泡運輸調控機制。