脊髓灰質炎滅活疫苗,預防由脊髓灰質炎1型、2型和3型病毒導致的脊髓灰質炎。
基本介紹
- 別名:愛寶維
- 藥品名稱:脊髓灰質炎滅活疫苗
- 藥品類型:處方藥
成份與性狀
本品每0.5 mL單劑量的主要活性成份有 :
脊髓灰質炎病毒 1型(滅活)- 40 DU(D-抗原單位)
脊髓灰質炎病毒 2型(滅活)- 8 DU(D-抗原單位)
脊髓灰質炎病毒 3型(滅活)- 32 DU(D-抗原單位)
非活性物質 :2-苯氧乙醇、乙醇、甲醛、Hanks199培養基(含有胺基酸、礦物鹽、維生素、葡萄糖、聚山梨酯80和注射用水)、用於調節pH值的鹽酸或氫氧化鈉、痕量的抗生素(新黴素、鏈黴素和多粘菌素B)。
適應症
接種對象 :本疫苗可用於嬰幼兒、兒童和成人,主要用於2月齡以上(含2月齡)的嬰幼兒。
規格
免疫程式和劑量
用法 :本品推薦最佳注射途徑是肌肉注射。嬰幼兒肌肉注射的最佳部位是大腿前外側中部,兒童、青少年和成人則為三角肌。注射部位也可參考國家計畫免疫程式的推薦意見。
用量 :根據本品在國內的臨床試驗結果,推薦常規免疫接種程式 :2、3、4月齡進行基礎免疫,每次0.5 mL。18月齡加強免疫(即第1次加強),每次0.5 mL。
國外批准的參考用量 :
基礎免疫 :自出生2月齡起,應連續接種3次(間隔1-2個月),每次0.5 mL。對從未接種過本疫苗的成人,推薦連續接種2次(間隔1-2個月,建議2個月),每次0.5 mL。
加強免疫 :對於1-2歲的兒童,第4次接種(即第1次加強)應在第3次接種後1年進行。
對於成人,第3次接種(即第1次加強)應在第2次接種後8-12個月進行。
對於兒童和青少年,每5年應加強接種1次 ;對於成人,每10年應加強接種1次。
國外臨床研究提示,本品第4次接種後其免疫力可持續至少5年。本品在國內尚未進行免疫持久性的研究。
不良反應
國外臨床不良反應(包括上市後)
常見的不良反應 :注射部位局部反應 - 疼痛、紅斑(皮膚發紅)、硬結 ;中度、一過性的發熱。
非常罕見的不良反應 :注射部位局部反應 - 腫脹(接種後可能48小時內出現,持續1-2天 ;淋巴結腫大 ;疫苗任一組份引起的過敏反應(風疹、血管性水腫、過敏性休克) ; 可能出現中度、一過性關節痛和肌痛 ;可能出現驚厥(伴或不伴發熱)。接種後2周內可能出現頭痛、中度和一過性的感覺異常(主要位於下肢) ;接種後最初幾小時或幾天可能出現興奮、嗜睡和易激惹,但很快會自然消失 ;廣泛分布的皮疹。
國內臨床不良反應 :在我國註冊臨床試驗中總計有340名嬰幼兒接種了本品,接種程式為2、3、4月齡時進行3劑基礎免疫,18月齡時進行1劑加強免疫。在隨機對照試驗中納入300例嬰兒接種本品的安全性信息概括如下 :
IPV組在3劑基礎免疫的任一劑接種後,未出現嚴重不良反應。按接種人次統計分析,最常見的全身不良反應依次為異常哭鬧(46.1%)、嘔吐(43.7%)、易激惹(32.2%)、嗜睡(31.9%)、食慾下降(30.2%)和發熱(25.9%),偶見體溫]39°C的發熱1例(0.3%) ;最常見的局部注射部位不良反應依次為觸痛(36.7%)、紅斑(14.8%)和腫脹(4.7%),偶見直徑]3 cm的紅斑1例(0.3%)。
按接種劑次分析,最常見的全身不良反應依次為異常哭鬧(24.3%)、嘔吐(23.8%)、易激惹(16.7%)、食慾下降(15.7%)嗜睡(14.6%)和發熱(10.6%);最常見的局部注射部位不良反應依次為觸痛(20.8%)、紅斑(7.6%)和腫脹(2.0%)。
上述不良反應多為輕度、持續時間不超過3天、可自行緩解 ;不良反應的發生率在第1劑接種後最高,第2劑和第3劑接種後均有不同程度的下降。
口服OPV對照組(297名嬰兒)在3劑基礎免疫的任一劑接種後,未出現嚴重不良反應。按人次分析,最常見的全身不良反應依次為嘔吐(39.7%)、異常哭鬧(29.1%)、發熱(25.0%)、食慾下降(21.9%)、嗜睡(19.5%)和易激惹(18.8%),偶見體溫]39°C的發熱2例(0.6%) ;按劑次分析,最常見的全身不良反應依次為嘔吐(19.8%)、異常哭鬧(14.2%)、食慾下降(11.0%)發熱(10.3%)、易激惹(9.1%)和嗜睡(8.5%)。
上述不良反應多為輕度、持續時間不超過3天、可自行緩解 ;除發熱和食慾下降外,其它全身不良反應的發生率隨著接種次數的遞增而降低。
以本品進行1劑加強免疫接種後(按照國家現行免疫程式,OPV對照組在18月齡時未進行加強免疫),未出現嚴重不良反應,最常見的全身不良反應依次為發熱(14.7%)、異常哭鬧(10.2%)、易激惹(9.8%)、食慾下降(8.6%)、嗜睡(6.4%)和嘔吐(3.4%),體溫]39°C的發熱有4例(1.5%),經藥物治療後緩解 ;最常見的注射部位不良反應依次為觸痛(20.0%)、紅斑(7.9%)和腫脹(2.3%),未出現直徑]3 cm的紅斑和腫脹。
上述不良反應多為輕度、持續時間不超過3天、可自行緩解。
國內註冊臨床試驗未發現國外說明書中未列出的不良反應,常見不良反應與國外說明書中的安全性信息基本一致。
禁忌
發熱或急性疾病期患者,應推遲接種本品。
注意事項
下列情況應慎重使用本疫苗 :患有血小板減少症或者出血性疾病者,肌肉注射本品後可能會引起出血 ;正在接受免疫抑制劑治療或免疫功能缺陷的患者,接種本疫苗後產生的免疫反應可能減弱。接種應推遲到治療結束後或確保其得到了很好的保護。對慢性免疫功能缺陷的患者,例如HIV感染者,即使基礎疾病可能會導致有限的免疫反應,也推薦接種本品。
同任何疫苗一樣,預防接種本品有可能不能保護100%的個體。
一旦本疫苗出現霧狀,請不要使用。對於多劑量包裝,打開後請立即使用。
孕婦及哺乳期婦女用藥
尚不明確本疫苗是否通過乳汁分泌。因為多種藥物可通過乳汁分泌,哺乳婦女接種本疫苗時應該格外謹慎。
藥物相互作用
臨床試驗
本品在國內的註冊臨床試驗採用開放、隨機、對照試驗設計,採用血清保護率(即免疫原性主要終點)評價600名健康嬰兒受試者在2、3、4月齡時分別進行3劑基礎免疫,隨後在18月齡時進行1劑加強免疫的免疫原性,同時觀察安全性。對照疫苗為口服脊灰減毒活疫苗(OPV)糖丸。接種部位採用嬰兒大腿前外側肌肉注射。
本試驗對免疫原性主要終點以符合方案人群(PP)進行非劣效性假設檢驗,並以意向性治療人群(ITT)分析進行確認。隨機入組的全分析集與安全性數據集相同,IPV組300名,OPV組297名,完成基礎免疫IPV組277名,OPV組282名。進入免疫原性分析集的ITT人群IPV組為209名,OPV組為207名 ;PP人群IPV組186名,OPV組193名。主要結果概括如下 :
免疫原性主要終點 :血清保護率,系免疫接種第3劑後1個月時抗3個型別脊灰病毒的中和抗體滴度≥8(1/稀釋倍數,1/dil)的受試者百分比。中和抗體測定根據WHO/EPI/GEN93.9標準程式用細胞培養微量中和法(細胞病變抑制法)確定,結果詳見下表。
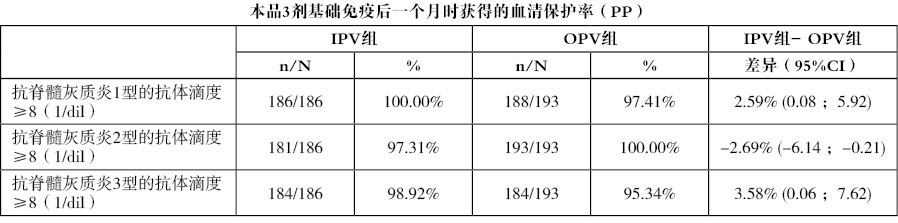
免疫原性次要終點 :2組在第3劑接種後1個月時抗各型脊灰病毒的抗體滴度及個體抗體滴度比率(免疫後滴度/免疫前滴度,GMTR),結果詳見下表。

考慮到免前母傳抗體的影響,經校正後,在基礎免疫階段本品IPV組和OPV組各型抗體滴度達到4倍以上增高的受試者百分比為93.9-100.0%。兩組根據受試者基線時的不同抗體滴度水平(≥8(1/dil)和<8(1/dil))分別比較了血清保護性抗體陽轉和抗體滴度結果,免前抗體滴度<8(1/dil)或≥8(1/dil)的受試者的抗脊灰1、2和3型的GMTs和血清保護率均與所有受試者的總體水平一致。IPV組經校正後,每個亞組受試者的各型抗體滴度達到4倍以上增高的百分比均超過了87%。
3劑基礎免疫完成後,本品IPV組抗脊灰1、2、3型抗體滴度較接種前達到至少4倍增長的受試者比例分別為98.3%、93.9%、99.4%。基礎免疫接種後14-16個月(加強免疫前),抗脊髓灰質炎1、2、3型病毒的抗體滴度有所下降,IPV組血清保護率分別為88.3%、83.2%和82.7% ;OPV組分別為96.9%、99.5%和91.1%。
以本品進行基礎免疫的受試者在18月齡進行1劑加強免疫接種後,抗脊髓灰質炎1、2、3型病毒的血清保護率均達到了100% ;抗體滴度顯著高於加強免疫前及基礎免疫後的水平,抗脊髓灰質炎1、2、3型抗體加免前幾何平均滴度(GMT)為44.5(1/dil)、47.8(1/dil)、45.7(1/dil),加免後分別達到2011.8(1/dil)、1480.6(1/dil)和4393.4(1/dil),加免後/加免前的GMTR分別為45.2、30.9、96.2,高於初免後/初免前的GMTR16.6、10.3、40.7。
本品在國內的註冊臨床試驗獲得的免疫原性和安全性結果與國外的臨床研究結果基本一致。在此試驗中獲得的安全性數據參見【不良反應】項。
國外臨床研究提示本品第4次接種(在3劑基礎免疫後進行1劑加強免疫)後其免疫力可持續至少5年。但本品在國內尚未進行免疫持久性的研究;也尚未開展IPV/OPV序貫接種免疫程式的臨床試驗。
貯藏
對於多劑量包裝,打開後請立即使用。
