介紹
發明者
侯德榜(1890年8月9日~1974年8月26日),名啟榮,字致本,生於福建閩侯,著名科學家,傑出化學家,侯氏制鹼法的創始人,中國重化學工業的開拓者。近代化學工業的奠基人之一。

20世紀20年代,突破氨鹼法制鹼技術的奧秘,主持建成亞洲第一座純鹼廠;30年代,領導建成了中國第一座兼產合成氨、硝酸、硫酸和硫酸銨的聯合企業;40~50年代,又發明了連續生產純鹼與氯化銨的聯合制鹼新工藝,以及碳化法合成氨流程制碳酸氫銨化肥新工藝;並使之在60年代實現了工業化和大面積推廣。
1926年中國“紅三角”牌純鹼入萬國博覽會,獲金質獎章。
他還積極傳播交流科學技術,培育了很多科技人才,為發展科學技術和化學工業做出了貢獻。
發明原理
氨氣與水和二氧化碳反應生成一分子的
碳酸氫銨,這是第一步。第二步是:碳酸氫銨與氯化鈉反應生成一分子的
氯化銨和
碳酸氫鈉沉澱。 根據 NH
4Cl 在常溫時的溶解度比 NaCl 大,而在低溫下卻比 NaCl 溶解度小的原理,在 278K ~ 283K(5 ℃~ 10 ℃ ) 時,向
母液中加入食鹽細粉,而使 NH
4Cl 單獨結晶析出供做氮肥。
化學原理
總反應方程式:
NaCl + CO
2+NH
3+H
2O=NaHCO
3↓+NH
4Cl(可作
氮肥)
2NaHCO3=Na2CO3+H2O+CO2↑(CO2循環使用)(以加熱作為反應條件)
(在反應中NaHCO3沉澱,所以這裡有沉澱符號,這也正是這個方法的便捷之處)
即:①NaCl(飽和溶液)+NH3(先加)+H2O(溶液中)+CO2(後加)=NH4Cl+NaHCO3↓ (NaHCO3能溶於水,但是侯氏制鹼法向飽和氯化鈉溶液中通入氨氣,由於氯化鈉溶液飽和,生成的碳酸氫鈉溶解度小於氯化鈉,所以碳酸氫鈉以沉澱析出)
(先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食鹽水顯鹼性(用無色酚酞溶液檢驗),能夠吸收大量CO2氣體,產生高濃度的HCO3-,才能析出NaHCO3晶體。)
2NaHCO3(加熱)=Na2CO3+H2O+CO2↑
發明特點
針對索爾維法生產純鹼時食鹽利用率低,制鹼成本高,廢液、廢渣污染環境和難以處理等不足,侯德榜先生經過上千次試驗,在1943年研究成功了聯合制鹼法。這個新工藝是把氨廠和鹼廠建在一起,聯合生產。由氨廠提供鹼廠需要的
氨和
二氧化碳。
母液里的
氯化銨用加入食鹽的辦法使它結晶出來,作為化工產品或化肥。食鹽溶液又可以循環使用。為了實現這一設計,在1941一1943年
抗日戰爭的艱苦環境中,在
侯德榜的嚴格指導下,經過了500多次循環試驗,分析了2000多個樣品後,才把具體工藝流程定下來,這個新工藝使食鹽利用率從70%一下子提高到96%,也使原來無用的
氯化鈣轉化成化肥氯化銨,解決了
氯化鈣占地毀田、污染環境的難題。這方法把世界制鹼技術水平推向了一個新高度,贏得了國際化工界的極高評價。1943年,中國化學工程師學會一致同意將這一新的聯合制鹼法命名為“侯氏聯合制鹼法”。所謂“聯合制鹼法”中的“聯合”,指該法將
合成氨工業與制鹼工業組合在一起,利用了生產氨時的副產品CO
2,革除了用
石灰石分解來生產,簡化了生產設備。此外,聯合制鹼法同時也避免了生產氨鹼法中用處不大的
副產物氯化鈣,而用可作化肥的
氯化銨來回收,提高了食鹽利用率,縮短了生產流程,減少了對環境的污染,降低了純鹼的成本。聯合制鹼法很快為世界所採用。
 侯德榜博士郵票
侯德榜博士郵票優缺點
優點:
保留了氨鹼法的優點,消除了它的缺點,使食鹽的利用率提高到 96 %; NH4Cl 可做氮肥(氮肥不可與鹼性物質混用,但可用草木灰檢驗其純度);可與合成氨廠聯合,使合成氨的原料氣 CO 轉化成 CO2,革除了CaCO3制 CO2這一工序,減少可能造成的環境污染。
兩個循環:
一:2NaHCO3=Na2CO3+H2O+CO2↑(CO2循環使用)(以加熱作為反應條件)
二:向
母液中加入食鹽細粉,從而使 NH
4Cl 單獨結晶析出供做氮肥。
第二個循環的具體操作:
①通入氨氣,冷卻後,加入NaCl,使得NH4Cl沉澱。過濾後,得到較純淨的NH4Cl晶體(產物),濾液為 飽和食鹽水(含有氨氣分子),經處理後方可回到第一步循環利用;
②不通氨氣,冷卻後,加入NaCl,使得NH4Cl沉澱。過濾後,得到NH4Cl晶體(產物),濾液為飽和食鹽 水,可直接回到第一步循環利用。
原理:低溫時,氯化銨的溶解度低於氯化鈉的溶解度,而由於之前加入氯化鈉(氨氣)使得氯離子(銨根 離子)濃度提高,所以再根據勒夏特列原理,氯化銨將最先析出。
不足之處:
侯氏聯合制鹼法也存在不足。較
氨鹼法而言,它的用氨量較大,在有些情況下不適用。
發明歷史
什麼是純鹼
純鹼(碳酸鈉)化學式為Na
2CO
3,俗名純鹼,又稱蘇打、鹼灰,是一種重要的化工基本原料,純鹼的用途很廣,一般都是利用它的鹼性。它可用於製造
玻璃,如
平板玻璃、瓶玻璃、
光學玻璃和高級器皿;還可利用脂肪酸與純鹼的反應制肥皂;在硬水的軟化、石油和油類的精製、冶金工業中脫除硫和磷、選礦、以及
銅、
鉛、線、
錫、
鈾、紹等金屬的製備、化學工業中製取
鈉鹽、金屬
碳酸鹽、
漂白劑、填料、洗漆劑、
催化劑及
染料等均要用到它,在陶瓷工業中製取
耐火材料和
釉也要用到純鹼。純鹼是重要的化工原料之一,用於制
化學品、
清洗劑、洗漆劑、也用於照相術和制醫藥品。絕大部分用於工業,一小部分為民用。在工業用純鹼中,主要是輕工、建材、化學工業,約占三分之二;其次是
冶金、
紡織、
石油、
國防、
醫藥及其它工業。
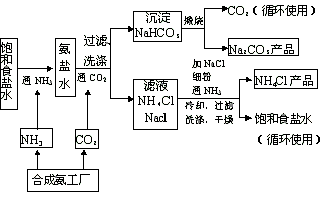 侯氏制鹼法流程圖
侯氏制鹼法流程圖純鹼生產歷史
純鹼是人類最早製取和使用的化學物質之一。7000多年以前,天然的
碳酸鈉首先是從
幼發拉底河邊生長的花的灰燼中提取的。大約5500年以前埃及人也開始用一種從湖水蒸發中提取的天然純鹼,生產裝飾
玻璃和作為鉛酸矽砂聚和肥皂的一種成份。當人們從海藻類植物的灰中提取豐富的鈉鹼時,也從木材灰中得到了豐富的鉀鹼。用天然植物生產鉀鹼的方法一直延續到1870年,德國JP始采含鉀鹽礦才結束。
1790年獲得專利權的
路布蘭制鹼法是人類歷史上第一個大規模化學制鹼法。用此方法建成的鹼廠曾遍布整個
歐洲。路布蘭制鹼法一直延續到1930年,後來完全被
索爾維制鹼法所取代。
1861年,E.索爾維在煤氣廠從事
稀氨水的濃縮工作時,在用
鹽水吸收
氨和
二氧化碳的試驗中得到
碳酸氫鈉。同年,他獲得了用食鹽、氨和二氧化碳製取碳酸鈉的工業生產方法的專利。此種生產方法被稱為索爾維法,又稱氨鹼法。
日本旭稍子公司於1950年在牧山化工廠建立日產30噸的聯合制鹼廠,1959年3月在千葉化工廠開始建立了新的聯合制鹼廠,日產300噸純鹼和
氯化銨,命名為A.C.法。19世紀70年代日本氯化銨的生產供過於求,除恢復部分氨鹼法生產外,旭稍子創建了新旭法,又稱N.A.法。
發展歷史
第一次世界大戰後,中國從
歐洲進口純鹼的道路被阻斷,而當時壟斷中國純鹼市場的英國卜內門洋鹼公司卻囤積居奇,鹼價暴漲。看到這種情況,
范旭東先生於1917年在實驗室成功制出了鹼。1920年成立“永利制鹼公司”,1922年請來侯德榜先生作為技術指導,他全身心的投入制鹼工藝和設備的改進上,終於摸索出了索爾維法的各項生產技術。1924年8月,塘沽鹼廠正式投產。1926年,中國生產的“
紅三角”牌純鹼在美國
費城的
萬國博覽會上獲得金質獎章。產品不但暢銷國內,而且遠銷
日本和
東南亞。
 侯德榜
侯德榜 1937年日本帝國主義發動了侵華戰爭,把工廠遷到
四川,新建了永利川西化工廠。
制鹼的主要原料是食鹽,也就是
氯化鈉,而四川的鹽都是井鹽,要用竹筒從很深很深的井底一桶桶吊出來。由於濃度稀,還要經過濃縮才能成為原料,這樣食鹽成本就高了。另外,索爾維制鹼法的致命缺點是食鹽利用率不高,也就是說有30%的食鹽要白白地浪費掉,這樣成本就更高了,所以侯德榜決定不用索爾維制鹼法,而另闢新路。
他首先分析了索爾維制鹼法的缺點,發現主要在於原料中各有一半的比分沒有利用上,只用了食鹽中的鈉和石灰中碳酸根,二者結合才生成了純鹼。食鹽中另一半的氯和石灰中的鈣結合生成了
氯化鈣,這個產物都沒有利用上。那么怎祥才能使另一半成分變廢為寶呢?他想呀想,設計了好多方案,但是—一都被推翻了。後來他終於想到,能否把索爾維制鹼法和
合成氨法結合起來,也就是說,制鹼用的氨和二氧化碳直接由氨廠提供,濾液中的
氯化銨加入
食鹽水,讓它沉澱出來。這氯化銨既可作為化工原料,又可以作為化肥,這樣可以大大地提高食鹽的利用率,還可以省去許多設備,例如石灰窯、化灰桶、蒸氨塔等。構想有了,能否成功還要靠實踐。於是他又帶領技術人員,做起了實驗。一直進行了500多次試驗,還分析了2000多個樣品,才把試驗搞成功,使構想成為了現實。
這個制鹼新方法被命名為“聯合制鹼法”,它使鹽的利用率從原來的70%一下子提高到96%。此外,污染環境的廢物
氯化鈣成為對農作物有用的化肥——氯化銨,還可以減少1/3設備,所以它的優越性大大超過了索爾維制鹼法,從而開創了世界制鹼工業的新紀元。

 侯德榜博士郵票
侯德榜博士郵票 侯氏制鹼法流程圖
侯氏制鹼法流程圖 侯德榜
侯德榜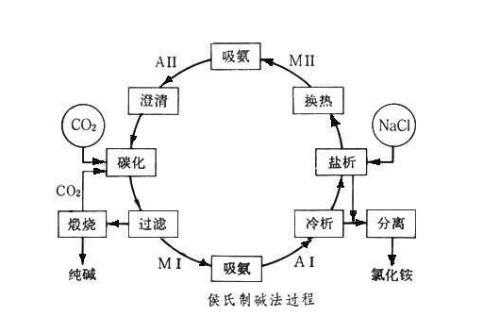

 侯德榜博士郵票
侯德榜博士郵票 侯氏制鹼法流程圖
侯氏制鹼法流程圖 侯德榜
侯德榜