從食螺芋螺織錦芋螺體內提取的毒液,毒素涵蓋了多種芋螺毒素家族,其中O超家族居多,分屬於α,μ,δ,ω等類型。毒素肽合成多採用氧化法。
基本介紹
- 中文名:織錦芋螺毒素
- 外文名:Conus textile conotoxin
- 來源:織錦芋螺
- 產生器官:毒液管和毒腺(有爭議)
- 一級學科:海洋科技
來源,芋螺毒素分類,生化性質,分類與命名,分離與純化,合成,一對二硫鍵,多對二硫鍵,毒理學,分子生物學特徵,O-超家族,鈉通道探針,L型Ca2+通道,酶蛋白,
來源
芋螺屬腹足綱軟體動物,全世界約有500種,中國約有100餘種,主要分布在西沙群島、海南島及台灣海域。芋螺喜食海水中的蠕蟲及其他軟體動物和魚類,根據其食性可分為食魚、食蟲、食螺3種。芋螺毒素由芋螺毒液管和毒囊內壁的毒腺分泌,每種芋螺的毒液中含50~200個活性多肽,理論上估計有5萬種,確定結構與性能的約0.2%,研究與開發潛力巨大。
織錦芋螺(Conus textile)屬食螺芋螺,分布廣泛,中國主要分布地域為廣東、廣西、海南、台灣等沿海島嶼以及西沙群島。世界主要分布區域為非洲沿岸、澳大利亞、紐西蘭、菲律賓、日本等地,是數量較多、毒性較高的幾種芋螺之一,歷史上曾有漁民因織錦芋螺咬傷而溺水致命的記載。
芋螺毒素分類
芋螺毒素多數由12~40個胺基酸組成,富含二硫鍵,包括了已知最小的神經毒素,能特異性作用於乙醯膽鹼受體(α-芋螺毒素)、鈣離子通道受體(ω-芋螺毒素)和鈉通道受體(δ-,μ-芋螺毒素)等,與其他天然肽類毒素相比,芋螺毒素具有分子量小、結構穩定、高活性、高選擇性及易於合成等突出優點。不僅可以直接作為藥物,還可以作為新藥設計的模板,已成為神經生物學、生物化學、藥理學、藥物化學家甚至軍事部門的研究熱點。
按照芋螺毒素的二硫鍵框架及高度保守的信號肽序列,芋螺毒素可分為若干個超家族,如A,M,O,P,I,S,T等,根據同一超家族中作用靶位的不同進一步分為各個家族,如α、ω、μ、μ/ο、δ、κ、ψ芋螺毒素等類型。α-芋螺毒素為突觸後N-受體競爭性抑制劑,ω-芋螺毒素為電壓敏感性鈣通道抑制劑,μ-芋螺毒素為鈉通道抑制劑,δ-芋螺毒素為鈉通道激活劑,κ-芋螺毒素為鉀通道抑制劑,ψ-芋螺毒素為N-受體抑制劑,μ/ο-芋螺毒素的性質介於μ-及ω-芋螺毒素之間。
已得到織錦芋螺毒素序列約50個,其中絕大部分是通過cDNA克隆獲得的,通過毒素分離獲得的為15個。這些織錦芋螺毒素分屬於α,μ,δ,ω等類型。1989年發現了第一個織錦芋螺毒素(TxⅥA)。
生化性質
分類與命名
芋螺毒素可以按成員的高度保守的前導膚序列和二硫鍵骨架,將芋螺毒素分為若干個超家族,每種超家族的不同芋螺毒素再根據其藥理活性分為若干家族。完整的芋螺毒素命名包括:代表藥理活性的希臘字母、連字號、芋螺種屬簡寫、代表二硫鍵骨架和配對方式的羅馬數字及代表一個特異膚的變異體的大寫字母,如。ω-conotoxin GVIA中。指出藥理學活性,G代表芋螺種屬,VI代表二硫鍵骨架類型,A代表膚的特殊變異體.未知某種毒素具體功能時,命名中沒有指出藥理學活性的希臘字母,而代表芋螺種屬的字母是英文小寫,代表二硫鍵骨架類型的是阿拉伯數字,再加一個小寫字母代表特殊變異體類型,如tx5a,功能闡明後,就將採用前一種命名方法獲得正式名稱。而某些活性多膚由於數量少且分布的芋螺種屬相對狹窄,其命名只在名稱後加一兩個代表芋螺種屬的字母即可,如conopressin-S,contryphan-R,contu-lakin-G等。
織錦芋螺分布廣泛,毒性強,cDNA文庫構建較早,因而相比研究得也比較深入。1989年首次在織錦芋螺毒液中分離純化出King-Kong肽,一種能特異性地作用於軟體動物神經系統的毒素,發現較早的幾種毒素TxVIA、TxVIB、TxVIIA、TxVII的藥理、電生理活性的研究比較完整,但命名尚未正規化。已經發現的織錦芋螺毒素涵蓋了多種芋螺毒素家族,其中O超家族居多,並由tx9a定義了一種新的芋螺毒素超家族—P超家族。
分離與純化
織錦芋螺毒素的分離鑑定有兩種方法,即分離毒液和毒肽基因。毒液分離一般包括以下幾個過程:凝膠分離→活性初篩→HPLC分離→活性測定→質譜測定→序列測定→組成及二硫鍵配對方式分析。毒肽基因分離的一般過程是:提取毒液管組織的mRNA,構建cDNA文庫,根據芋螺毒素前體肽的信號肽序列保守性高的特點,設計某一探針或混合探針,從較完整的或特定的cDNA文庫中釣取目標基因,測序後再反推胺基酸序列。
織錦芋螺毒素分離純化圖冊參考資料。
合成
一對二硫鍵
新芋螺毒素的作用靶位的確定及結構與性能的研究均需合成大量肽,大部分芋螺毒素含有2~4對二硫鍵,二硫鍵的正確摺疊是合成目標產物的關鍵。一對二硫鍵形成的方法有空氣氧化法、鐵氰化鉀氧化法、碘氧化法、三氟乙酸鉈氧化法、二甲基亞碸氧化法等。溫和的氧化劑,如空氣、二甲亞碸、N-碘代琥珀醯亞胺和氰化碘等氧化得到熱力學控制的產物。採用較強的氧化劑,如碘、碘氰化鉀和三氟乙酸鉈等氧化得到動力學控制的產物。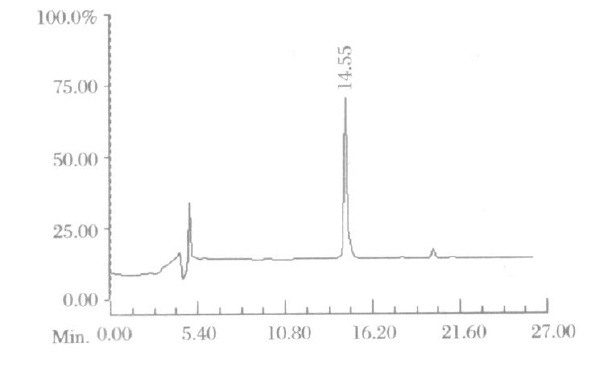 織錦芋螺毒素HPLC分析
織錦芋螺毒素HPLC分析
 織錦芋螺毒素HPLC分析
織錦芋螺毒素HPLC分析空氣氧化法形成二硫鍵是多肽合成最經典的方法。一般在近中性或弱鹼性條件下(pH值為6.5~10)進行,反應時間一般需要24小時以上。合成鏈內一對二硫鍵的多肽需在較稀的肽濃度下進行,以減少分子間聚合。合成鏈間一對二硫鍵的多肽需儘量採用高濃度的肽溶液,以加快反應速度。鐵氰化鉀氧化法速度較快,一般用氨水調pH值至7~8,滴加鐵氰化鉀水溶液(2~4 mol/L),室溫反應60分鐘左右,再滴加乙酸調pH值至弱酸性以終止氧化反應。一些含兩對二硫鍵的α-芋螺毒素就是用該方法得到的。
碘氧化法多在水中或含有甲醇或乙醇的水溶液中進行,碘溶液濃度為10~15mol/L,反應15~40 min。由於Tyr、Trp、Met和His對碘很敏感,在氧化過程中應注意控制條件。氧化完畢後,應立即加入維生素C或硫代硫酸鈉除去過量的碘。碘可以直接將含有Cys(Acm)和Cys(Trt)的肽氧化成二硫鍵,但是對於含Cys(tBu)、Cys(4-MeBzl)和Cys(4-Mob)的肽則不能直接氧化。此方法用於分步法合成含三對二硫鍵的芋螺毒素的最後一步關環。
二甲亞碸是一種溫和的氧化劑,此氧化法的副產物為易揮發的CH3SCH3和水,因此純化方便,產率較高。氧化反應可以在三氟乙酸和水中進行。DMSO氧化體系適合很寬的pH值,同傳統的空氣氧化相比有許多優越性。首先是DMSO能同水混溶,可以用高濃度的DMSO以加快氧化反應進程,特別適合於疏水肽的氧化,如一些conantokins突變體的合成。
多對二硫鍵
可採用一步或多步氧化來實現。一步氧化法即選擇合適的氧化條件,可一步氧化形成兩對或多對二硫鍵的正確配對結構,該結構往往就是具有熱力學穩定性天然構象,大部分的芋螺毒素採用該方法。含三對二硫鍵的芋螺毒素也可採用二步法,先用Acm基保護其中一對二硫鍵,讓四個未保護的Cys氧化形成兩個二硫鍵,最後用碘或三氟乙酸鉈脫除Acm基形成第三對二硫鍵。
毒理學
研究織錦芋螺粗毒的電生理活性顯示,織錦芋螺粗毒能可逆地阻斷美洲飛鐮屬嶂螂神經系統膽鹼能遞質的釋放,部分阻斷大鼠海馬回CAI錐體神經Na+通道,並能加強褐雲瑪瑙螺巨神經元的興奮性和自發活動。
每種芋螺在其很長的毒液管中合成並分泌50-200種不同的毒素,這些毒素包含各種翻譯後加工。然而,人們對芋螺毒素如何生物合成仍然知之不多。2002年有人提出芋螺毒液管靠近毒囊的前端部分主要負責毒素的運輸而不是分泌。2005年,對芋螺毒素基因在織錦芋螺毒液管不同部位的表達進行分析後,將織錦芋螺毒液管分為4個部分,使用LC / MS檢測各個部位的毒素成分。結果表明,屬於不同超家族或家族的芋螺毒素的生物合成和分泌分別發生在毒液管的不同部位。由此可以假設,分布於芋螺毒液管不同部位的分泌細胞簇選擇性地表達、加工和分泌屬於某一超家族/家族的某一類毒素。並在毒液管前端部分發現了3種M超家族的芋螺毒素,證明了芋螺毒液管的前端也參與芋螺毒素的表達和分泌,這與以前的研究結果不同。從實用角度考慮,如果mRNA由適合的部分而不是全長的毒液管制備,特定超家族芋螺毒素基因以及其翻譯後加工中涉及到的酶)的克隆將會大為改進。許多芋螺毒素包含豐富的翻譯後加工,可以構想負責這些毒素翻譯後加工的酶也共表達於合成這種芋螺毒素的細胞簇里。
分子生物學特徵
O-超家族
該類型含有5種織錦芋螺毒素,包括TxⅥA,TxⅥB,TxⅦA,TxⅦ,Gla(1)-TxⅥ,它們具有相同的Cys框架(C-C-CC-C-C,二硫鍵連線方式為全交叉)。TxⅥA,TxⅥB,TxⅦA(原名分別為TxⅠA,TxⅠB,TxⅡA)屬δ-芋螺毒素,都含有27個胺基酸,均未修飾,C端和N端皆游離,其共同的結構特點是含有大量的疏水性胺基酸並帶有較多的負電荷。TxⅥA,TxⅥB第3位的Lys和第6位的Gly與ω-芋螺毒素相同,而在ω-芋螺毒素中,Cys,Lys,Gly也是唯一保守的。此外,這3種毒素都不包含Pro,而Pro是食魚芋螺毒素的一種常見胺基酸。TxⅦ也是O-超家族的成員,但與ω-芋螺毒素相比,前者第5個胺基酸是Asp,而後者在該位置有一個保守Gly。在ω-GⅥA和ω-MⅦC的NMR溶液中,可觀察到Gly參與Ⅱ型β轉角。儘管TxⅦ是Ca通道阻滯劑,但它的疏水性、短的C端環、負電荷卻與δ-芋螺毒素更為相似。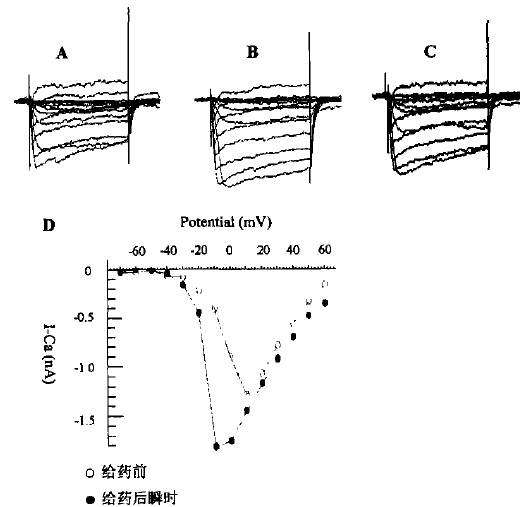 織錦芋螺毒素對海馬神經元鈣電流影響
織錦芋螺毒素對海馬神經元鈣電流影響
 織錦芋螺毒素對海馬神經元鈣電流影響
織錦芋螺毒素對海馬神經元鈣電流影響Gla(1)-TxⅥ有31個胺基酸,相對分子質量較大(3632.78)。據MS/MS證實,Gla(1)-TxⅥ有自由的C端,第3位和第31位(C端)有溴化Trp,這是第一個包含兩個溴化Trp的芋螺毒素。
鈉通道探針
TxⅥA是第一個分類定名的δ-芋螺毒素,曾形象地稱為“國王肽”(King kong peptide),因為將純化TxⅥA小鼠腦室給藥,沒有觀察到明顯的異常現象,遂將其注射到一種大海蝦中,平時這種大海蝦遊走時,頭朝下,尾翹起,而此時游起來高昂著頭,尾部彎曲得像蠍子,似一個高傲的國王,故名“國王肽”。3種δ-織錦芋螺毒素TxⅥA,TxⅥB,TxⅦA對軟體動物帽貝有強毒性,在9~80 pmol(25~240 mg/100 mg動物體重)劑量下,即可導致帽貝麻痹,但在20倍的上述劑量下,這3種毒素對昆蟲類、甲殼類、魚類無明顯活性,採用15~20 nmol高劑量給藥大鼠,也未觀察到明顯活性,上述結果與ω-芋螺毒素GⅥA及其他食魚芋螺毒素相反,ω-GⅥA在約1.5 pmol/100mg動物體重劑量時,可引起魚麻痹,但在20倍上述劑量時,ω-GⅥA對帽貝無效應。小鼠顱內注射ε-TxⅨ後,觀察到震顫和麻痹,但即使在高濃度時,也未出現癲癇發作和死亡。
痙攣肽的生物活性更值得研究,將該肽注射入小鼠中樞神經系統時,可使正常小鼠轉變為兩種有名的突變系———痙攣小鼠和強直小鼠,這些小鼠的突出症狀是對於感覺刺激有極高的敏感性,能引起自主運動喪失和癲癇樣症狀。
1990年,在織錦芋螺的cDNA文庫中得到了另外2種相似的毒素序列,它們與KK相比具有100%保守的二硫鍵骨架,因而分別命名為KK-1,KK-2。而位於其二硫鍵環內的胺基酸則是多變的,除了保守的Cy、框架以外的19個殘基中有17個是不同的.KK-1,KK-2的序列只是通過基因克隆獲得,未曾從織錦芋螺的毒液中分離得到。
1991年,分離鑑定了TxVIB和TxVIIA,並進行了TxVIA,TxVIB和TxVIIA的電生理學研究。TxVIIA的序列1996年被修正實驗證明,3種毒素對人類和脊椎動物都沒有麻痹作用,而對軟體動物神經的麻痹作用很強,檢測它們對海兔(aplysia)神經細胞的作用發現,3種毒素均能導致海兔神經細胞的膜去極化和自發的連續放電,而TxVI包括TxVIA和TxVIB)還能明顯導致細胞作用電壓持續時間的延長.進一步的實驗顯示,TxVIA和TxVIB均選擇性地作用於軟體動物神經系統,延遲Na+通道失活。TxVI通過兩種方式改變Na+流速:一種是減緩Na+失活率,一種是用更慢的激活和失活速率來復原靜閉的Na+通道。TxVI毒素對軟體動物神經系統的特異性作用,代表了一類新型的動物種屬選擇性的芋螺毒素,可以作為研究軟體動物神經系統離子通道的專一性探針。
L型Ca2+通道
1996年從織錦芋螺的毒液中分離鑑定了O超家族的26肽TxVII,其二硫鍵骨架結構表明它是一種ω-芋螺毒素,但並不具有其他ω-芋螺毒素中第5位保守的Gly,而是被Asp所取代。TxVII的強疏水性、負電荷始)、短的G端疏水LOOP等特點則更相似於δ-芋螺毒素。儘管δ-TxVII的胺基酸序列與別的的TxVIA具有58%的同源性,但是兩者卻分別作用於Ca2+和Na+離子通道,功能上不具有相似性。
TxⅨ也屬於ε-芋螺毒素,含13個胺基酸,是迄今為止序列最短的織錦芋螺毒素之一,有新的二硫鍵結構(CC-CC-,二硫鍵連線方式為Cys2-Cys8,Cys3-Cys9),存在多種較少見的翻譯後修飾,其第7位胺基酸為溴化Trp,第1位和第4位為Gla(γ-羧基谷氨酸),第10位為糖化Thr,其上連線一個N-乙醯氨基己糖和一個半乳糖胺,第13位為羥基Pro。與大多數芋螺肽不同的是,ε-TxⅨC端的羧基未醯胺化,編碼ε-TxⅨ的cDNA序列顯示,這是蛋白水解丟掉C端3個殘基所致。
酶蛋白
由於芋螺毒素的結構特點,與毒素相關的一些酶蛋白也引起了研究者的廣泛興趣。芋螺是唯一具有維他命K依賴性梭化酶的無脊椎動物。織錦芋螺梭化酶的cDNA有一個開放閱讀框,翻譯為811個胺基酸的蛋白質,這段序列與脊椎動物的具有41%的相同和大約60%的相似性。2002年,將這段cDNA在COS細胞和昆蟲細胞里表達,產物具有維他命K依賴性的梭化酶活性和維他命K依賴性的環氧酶活性。在沒有內源底物存在時,這種重組芋螺梭化酶可以被脊椎動物蛋白前體膚激活至5倍以上,而芋螺毒素前體膚沒有這樣的效果。這個結果說明,梭化酶可能具有兩個前體膚的結合位點,其中一個可以結合芋螺或脊椎動物的前體膚,用於底物的結合;另一個只能結合脊椎動物前體膚,用於酶的激活。

