芋螺毒素多為基因編碼的多肽,這類活性多肽對不同的離子通道及通道亞型具有高度選擇性作用,按其作用靶位可分為α、ω、μ、δ、κ、及μ/ν等類型。ω-芋螺毒素有專一阻斷電壓敏感型鈣離子通道的作用,作為神經生物學探針在鎮痛、神經保護、抗驚厥、鎮咳等方面具有巨大的套用潛力。已從地紋芋螺、魔術家芋螺、線紋芋螺及織錦芋螺中分離14種ω-芋螺毒素。
ω-芋螺毒素是芋螺毒素的研究熱點,是由24~31個胺基酸殘基、3對全交叉二硫鍵(二硫鍵連線模式為Cys1-Cys4,Cys2-Cys5,Cys3-Cys6)構成的剛性小肽,絕大部分ω-芋螺毒素的N端為Cys,C端醯胺化,由前體肽(約35個胺基酸的信號肽)加工而來,一些ω-芋螺毒素的功能基團已部分確定。
基本介紹
- 中文名:ω-芋螺毒素
- 外文名:ω-conotoxin或ω-CTX
- 來源:海洋腹足綱軟體動物芋螺
- 產生器官:毒液管和毒囊內壁的毒腺
- 一級學科:海洋科技
分類,生化性質,結構,基因序列,製備,人工採集,基因工程方法,人工合成,毒理學,GVIA,作用靶位,殘基對活性影響,套用,藥物,殺蟲劑,
分類
芋螺毒素(Conotoxins)是自海洋腹足綱軟體動物芋螺(Conus)中得到的一類具有生物活性的肽類毒素。能選擇性地作用於離子通道等蛋白受體,進而影響神經傳導,產生不同的生理作用。根據芋螺毒素基因及其前體蛋白信號肽的保守性,可將其分為A、O、T、M、P、I等多個超家族,在每個超家族中,再依據其對生物體作用靶位以及藥理活性的不同又可將其分為α、ω、μ、δ等不同的亞型。α、αA、κA屬於A-超家族,ω、δ、κ、μO屬於O-超家族,μ、φ、κM屬於M-超家族。O-超家族芋螺毒素主要作用於電壓門控離子通道(又稱電壓敏感性通道),包括Ca通道、Na+通道和K+通道等。作用於Ca通道的只有O-超家族的ω-芋螺毒素。
生化性質
結構
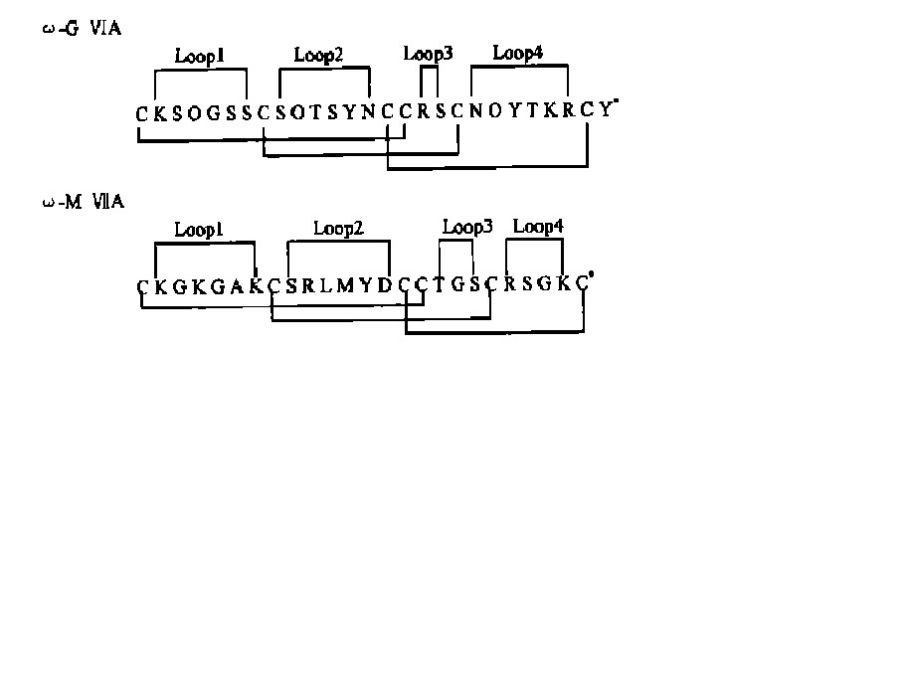
已發現的ω-CTX均來自食魚類芋螺,大小約24~29個胺基酸,含相同的二硫鍵骨架,即含6個Cys殘基,成四環框架,含三對二硫鍵。C端絕大部分醯胺化,N端大多為Cys。除TxⅦ、PnⅥA及PnⅥB外,絕大部分ω-CTX為親水肽,呈鹼性,分子帶4~6個正電荷。TxⅦ、PnⅥA及PnⅥB疏水性強,帶2~3個負電荷。大部分ω-CTX的第5位是Gly(MⅦD、TxⅦ、PnⅥA及PnⅥB除外),第2位是帶正電荷的Arg或Lys,C端Cys的左邊大部分為鹼性胺基酸。同種芋螺的不同ω-CTX序列同源性很高,不同芋螺間序列相差很大,如ω-CTX GⅥA與MⅦA(圖1),不足1/3的非Cys殘基是相同的,Cys間的環內序列差異很大。另一方面,同種芋螺如MⅦA與MⅦC雖然序列同源性高,但靶位不同。此外,κ、δ、μO家族及新發現的TⅦA的二硫鍵骨架均與ω-CTX相同,但功能顯著不同,提示Cys分布或二硫鍵結構方式與毒素作用靶位並無對應關係。
GⅥA、MⅦA、MⅦC和TxⅦ經二維NMR測定,顯示了相似的溶液結構,整體構象均由三股反平行β-摺疊(β1、β2、β3)構成,三對二硫鍵對結構起主要作用,次極鍵(氫鍵、疏水鍵、離子鍵)的作用很小。Loop 2和loop 4對MⅦA,MⅦC選擇性起決定作用,loop 1和loop 3的影響很小。MⅦA loop 2區約35μs經歷一次構象改變,對毒素-靶位特異性結合具重要意義。研究發現,前兩對二硫鍵的形成對ω-CTX的正確摺疊即其高級結構的形成起關鍵作用,第三對二硫鍵的影響較小。
MⅦA與GⅥA的構象差別主要是β-摺疊的長度及β-轉角的類型。β1摺疊相同,MⅦA的β2和β3摺疊比GⅥA相應摺疊短1個及2個殘基。兩者前3個β-轉角的構象相同,第4個GⅥA為Ⅰβ-型,MⅦA為Ⅰ’-型,顯著不同。MⅦC的結構與MⅦA、GⅥA的差別亦在β-摺疊及β-轉角。CD譜顯示MⅦC與GⅥA差別很大,提示CD譜與三維結構無明顯聯繫。TxⅦ與MⅦA、GⅥA不同之處是在分子表面一定區域暴露許多疏水殘基,而後兩者以同樣方式暴露鹼性殘基。現認為集中的疏水殘基與L-型VSCCα1亞基的疏水群相互作用導致TxⅦ的靶位不同於MⅦA和GⅥA。
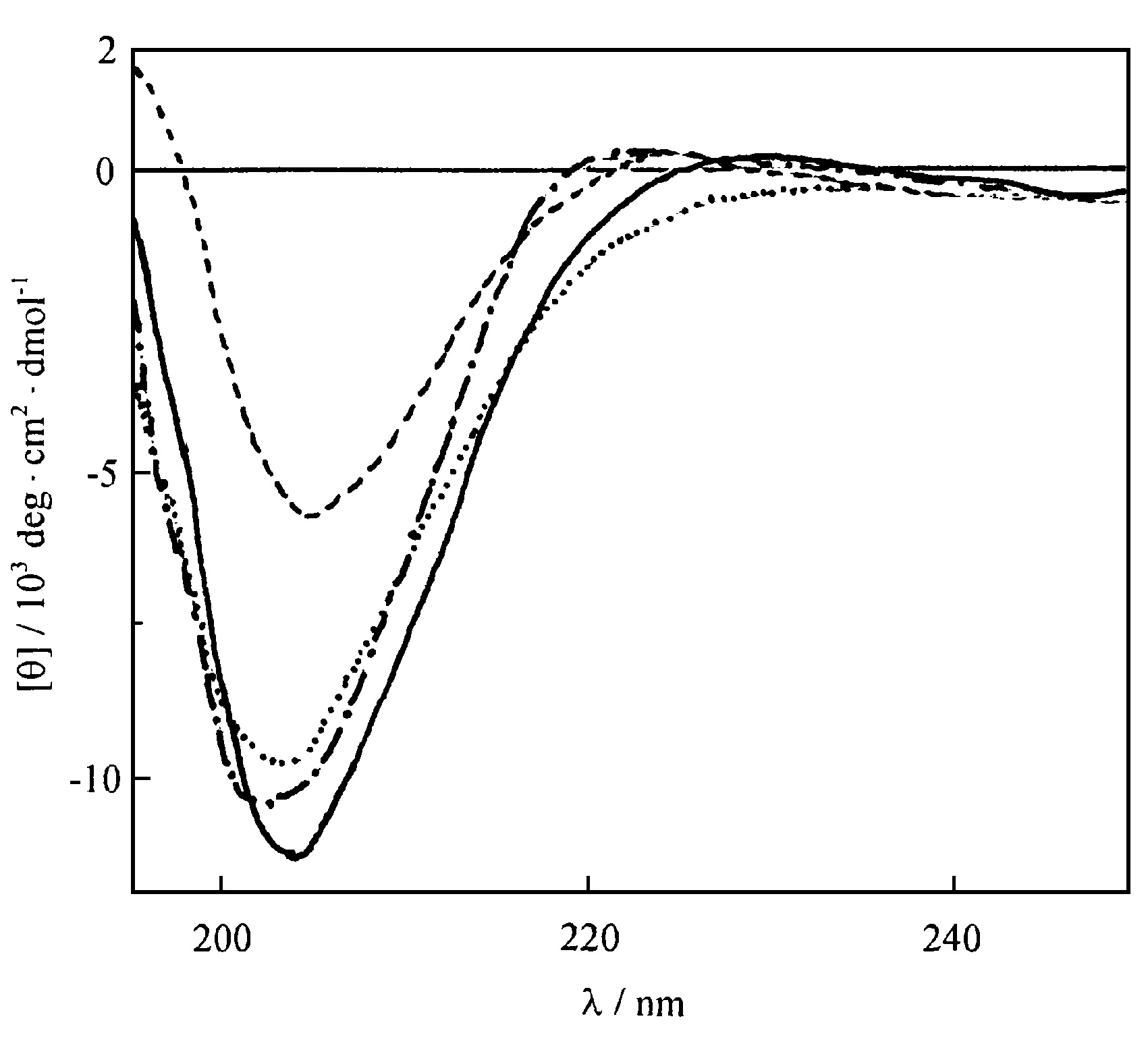 芋螺毒素與衍生物CD譜
芋螺毒素與衍生物CD譜kω-芋螺毒素,可抑制N、P、Q型鈣通道,由26個胺基酸組成,且絕大部分胺基酸為親水胺基酸,與絕大部分ω-芋螺毒素組成相似,NMR結構顯示N端Cys暴露在分子表面。研究發現,CTX在1~2和14~16位殘基間構成一個β-橋,Lys 2和Asp 14(MⅦA、MⅦC、CⅥD)間的鹽橋穩定了β-橋。β-摺疊和β-橋形成網路穩固相關的重要側鏈(sidechains)。插入區由β-轉角組成。至今發現的所有ω-CTX在loop 1(3~6位)有一個β-轉角,loop 2~3有若干個β-轉角,loop 4有一個β-髮夾的β-轉角形成部分。CⅥD結構上有獨特之處,loop 4含新序列,且向loop 2彎曲,使表面更似球形。Loop 4的Gly 22和loop 2的Lys 10間形成氫鍵,對彎曲有重要作用。GⅥA、MⅦA、MⅦC均未發現loop 2與loop 4間的氫鍵,提示loop2與loop 4的連結對CⅥD較GⅥA、MⅦA更具N-型VSCC親合力有重要意義。
電荷分布對ω-CTX的活性也是一個重要因素,尤其對P/Q型VSCC的結合。研究表明,MⅦC的loop 2和loop 4的正電荷殘基即Arg 9、Lys 10、Arg 22、Arg 23對結合P/Q型VSCC意義重大。對MⅦA,用Gln、Leu或Ala取代Arg 10,均致活性下降,提示Arg 10的作用為電荷依賴;用中性胺基酸取代Lys 24或Lys 4,活性無改變,而Lys 2、Arg10、Lys 7或N-末端的中性化則引起活性顯著下降,亦支持電荷分布與活性的密切聯繫。對GⅥA、Lys 24的作用電荷依賴,Arg 17、Arg25則是側鏈長度而非電荷為主要因素。
基因序列
已經3種芋螺(C. livi-dus、C.abbreviatus和C.ebraeus)中,測出了284個四環芋螺毒素前體蛋白基因序列;其他研究人員從5種芋螺(C. arena-tus,C. pennaceus,C. tessulatus,C. ven-tricosus和C. textile)中獲得了170個芋螺毒素的cDNA序列。從中國海南淺紋芋螺(C.striatus)和織錦芋螺(C. textile)中分別發現了6種新O-超家族毒素的cDNA序列和2種α-CTX。從地紋芋螺(C.geographus)基因組DNA中用PCR法克隆到新型α-CTX GIC。但獲得的這些絕大多數芋螺毒素前體基因的功能尚未深入研究。
製備
人工採集
從芋螺的毒管中可提取少量天然的ω-芋螺毒素,大多從野生芋螺的死體毒管中提取。或者引誘活體芋螺刺捕獵物,用乳膠套收集噴射的毒液。但人工養殖還不能辨別活芋螺的性別,也未觀察到芋螺的交配行為。天然來源的ω-芋螺毒素十分有限,這制約了芋螺毒素研究的深入。但獲得的少量天然毒液可用高效液相色譜儀進行分離和分析,通過質譜儀和序列分析,可得到單個毒素肽的胺基酸序列。再根據所得序列人工合成這些肽,可進一步用於活性測試和結構分析。
基因工程方法
通過基因工程方法獲得ω-芋螺毒素由於芋螺毒素是基因直接表達的產物,現代基因工程技術促進了芋螺毒素的研究與開發。對芋螺毒素的研究已深入到了分子生物學領域,儘管起步較晚,但在研究芋螺毒素基因的結構和生物合成過程、尋找新芋螺毒素基因,研究其分子遺傳學機制,蛋白質摺疊機制方面頗具吸引力,且已取得了較快的進展。芋螺毒素在體內先合成較大的無活性多肽前體,它們由50~80個胺基酸殘基組成,含有典型的信號肽序列區和可變區,在近成熟肽區位置,有標準的蛋白質水解信號,這些信號肽序列在所有超家族成員中具有保守性。同一超家族的芋螺毒素成員具有高度保守的信號肽序列和高度保守的二硫鍵連線方式。構建芋螺毒素cDNA文庫,從中篩選新ω-芋螺毒素基因已成為研究新ω-芋螺毒素及其分子特徵的重要途徑之一。如MVIIC,MVIID,SⅥA,SⅥB和SO3是根據已知ω-毒素毒素肽胺基酸保守序列,合成特定的探針,從中篩選出來的。國外已構建了織錦芋螺(C.textile),幻芋螺(C.magus),地紋芋螺(C.geographus),金翎芋螺(C.penaceus)等幾種芋螺的cDNA文庫。同時根據信號肽及3’端非翻譯序列,設計芋螺毒素各個超家族基因的特異PCR引物,從cDNA和基因組DNA中克隆新型毒素基因成為可能,且是分離芋螺毒素基因的主要方法。設計O-超家族PCR引物,可克隆到ω-芋螺毒素。 ω-芋螺毒素與衍生物HPLC
ω-芋螺毒素與衍生物HPLC
 ω-芋螺毒素與衍生物HPLC
ω-芋螺毒素與衍生物HPLC研究人員已從菖蒲芋螺基因組中克隆到2個新芋螺毒素基因(Gen-Bank登記號AY316159,AY316160);同時還從海南產的大理石芋螺(ConusmarmoreusLinnaeus)、幻芋螺(Conus magusLinnae-us)、信號芋螺(Conus litteratusLinnaeus)、勇士芋螺(Conus milesLinnaeus)、獨特芋螺(ConuscaracteristicusFischer)、織錦芋螺(Conus textileLinnaeus)、桶形芋螺(ConusbetulinusLinnaeus)、疣縞芋螺(Conus livi-dusHwass)等共12個種中分別發現了具有藥用功能的35種O-超家族芋螺毒素肽及其基因,正在進行基因具體功能的鑑定。根據毒素基因推測出相應的毒素胺基酸序列,通過人工合成或基因體外重組表達出這些芋螺毒素,進一步研究其活性,這些毒素即是新藥開發的候選藥物和先導藥物。但部分ω-芋螺毒素的N端為Cys,C端醯胺化,加之原核表達系統無法加工去除N-端信號肽序列,無法解決C-端醯胺化問題,且ω-芋螺毒素分子小,鹼性胺基酸較多,難於形成特定活性構象。尚未見到用基因體外重組生產芋螺毒素的報導。正在嘗試體外表達芋螺毒素基因的研究工作。但隨著基因工程技術的日新月異,用芋螺毒素成熟肽基因,加接原核或真核生物的信號肽,或同時轉入醯胺化酶基因,可望在不久的將來生產出大量廉價的重組芋螺毒素,這對芋螺毒素藥物研究和產業化將起到至關重要的作用。 ω-芋螺毒素在醋酸銨緩衝液中摺疊後HPLC
ω-芋螺毒素在醋酸銨緩衝液中摺疊後HPLC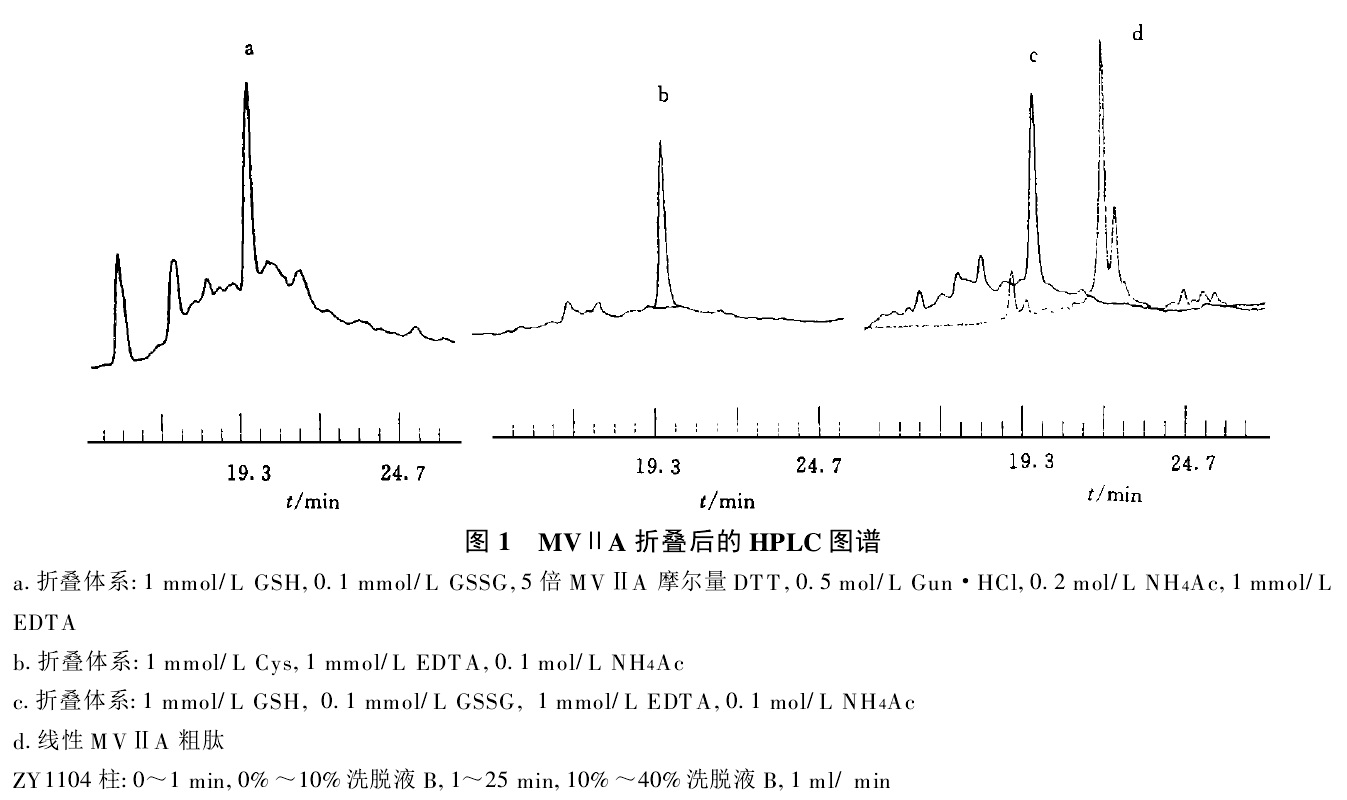 ω-芋螺毒素及衍生物摺疊後HPLC
ω-芋螺毒素及衍生物摺疊後HPLC
 ω-芋螺毒素在醋酸銨緩衝液中摺疊後HPLC
ω-芋螺毒素在醋酸銨緩衝液中摺疊後HPLC ω-芋螺毒素及衍生物摺疊後HPLC
ω-芋螺毒素及衍生物摺疊後HPLC人工合成
由於天然芋螺毒素來源有限,基因工程法生產芋螺毒素還不成熟。有關芋螺毒素的研究大部分轉向化學合成。多為固相合成,根據保護基的不同,有採用Fmoc法和Boc法。合成後將肽鏈從樹脂上裂解下來,脫去側鏈保護基,復性,純化,即可得到與天然毒素活性相同的肽,也可以合成其同系物進行結構和功能的研究,如為了ω-芋螺毒素及衍生物的結構與生物活性的關係,採用Fmoc胺基酸HBTU HOBtRink樹脂固相合成策略合成了ω-芋螺毒素及其衍生物;為了研究ω-芋螺毒素MVIIC N及C端修飾對摺疊及活性的影響,合成了MVIIC N及C端的3種修飾肽等。由於獲得高產率ω-芋螺毒素,關鍵的一步是獲得高產率的線性肽,有人對線性肽的合成方法進行了探討,並著重考察了裂解條件對產率的影響。肽復性的方法有多種,如空氣氧化法、鐵氰化鉀氧化法、碘氧化法和三氟乙酸鉈氧化法等。其中空氣氧化法形成二硫鍵是多肽合成研究中套用最廣泛的經典方法。該方法純化方便,但所需復性時間比較長,如在1995年對SNX 111的氧化復性時採用空氣氧化法需3d以上。一般需要24h以上。但由於ω-芋螺毒素胺基酸殘基較多,一般都在25個以上,其人工合成的產率較小、純度也低、合成的肽還需氧化摺疊才能形成正確的構象。因此,人工合成芋螺毒素的成本很高,還不能完全滿足作為藥物商業化生產的要求。但由於芋螺毒素藥物的用量小、效果好,價值高,人工合成可部分滿足市場需求。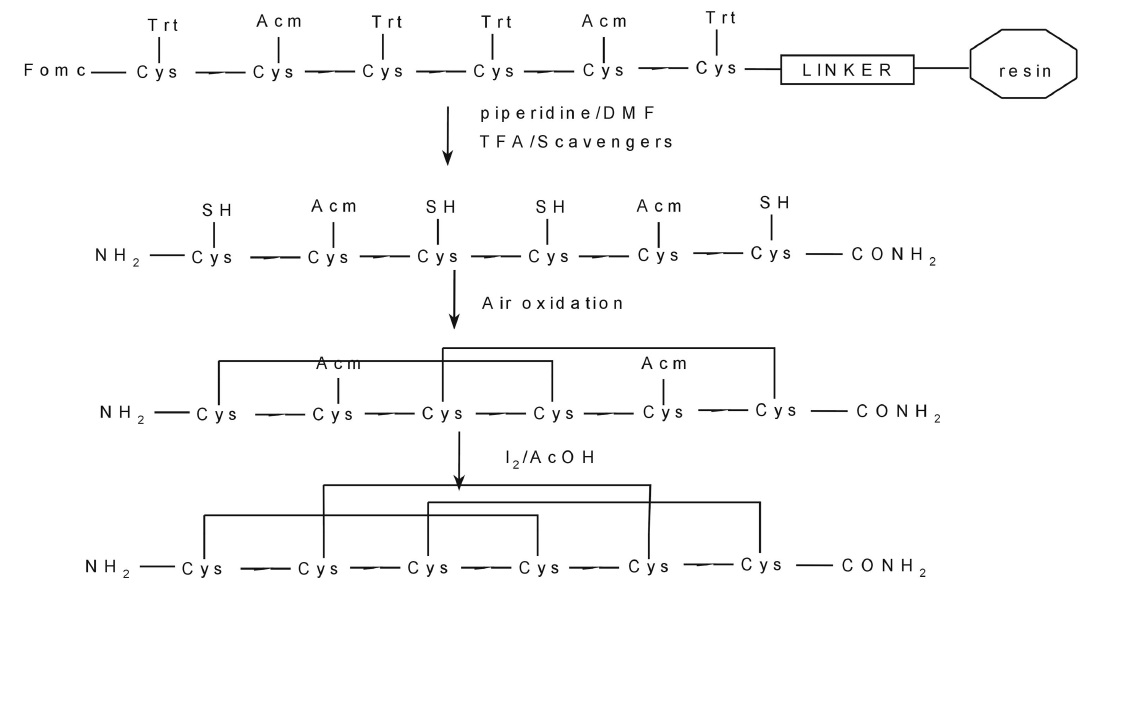 ω-芋螺毒素MVIID的化學合成示意圖
ω-芋螺毒素MVIID的化學合成示意圖
 ω-芋螺毒素MVIID的化學合成示意圖
ω-芋螺毒素MVIID的化學合成示意圖毒理學
GVIA
ω-芋螺毒素(ω-CTX)可選擇性地抑制突觸前末端Ca2+通道的不同亞型,在神經科學研究中的套用是最廣泛的。已從食魚芋螺中鑑定出多種ω-CTX,食蟲與食螺芋螺種類中同樣蘊涵豐富的ω-CTX。已有好幾個套用廣泛的ω-CTX的結構和功能被鑑定清楚得到的是ω-芋螺毒素GVIA,來自地紋芋螺(C. geographus)。在神經科學研究中,ω-芋螺毒素GVIA可能是使用最廣的芋螺毒素肽,2000多篇文獻中採用GVIA作為藥理學工具。來自幻芋螺(C.magus)的MVIIC是毒性最強的ω-芋螺毒素。當小鼠腦室注射ω-芋螺毒素後會引起全身肌肉顫動,所以早期稱此類毒素為“顫動肽”(shaker peptides),後來經證實是ω-芋螺毒素GVIA和MVⅡA。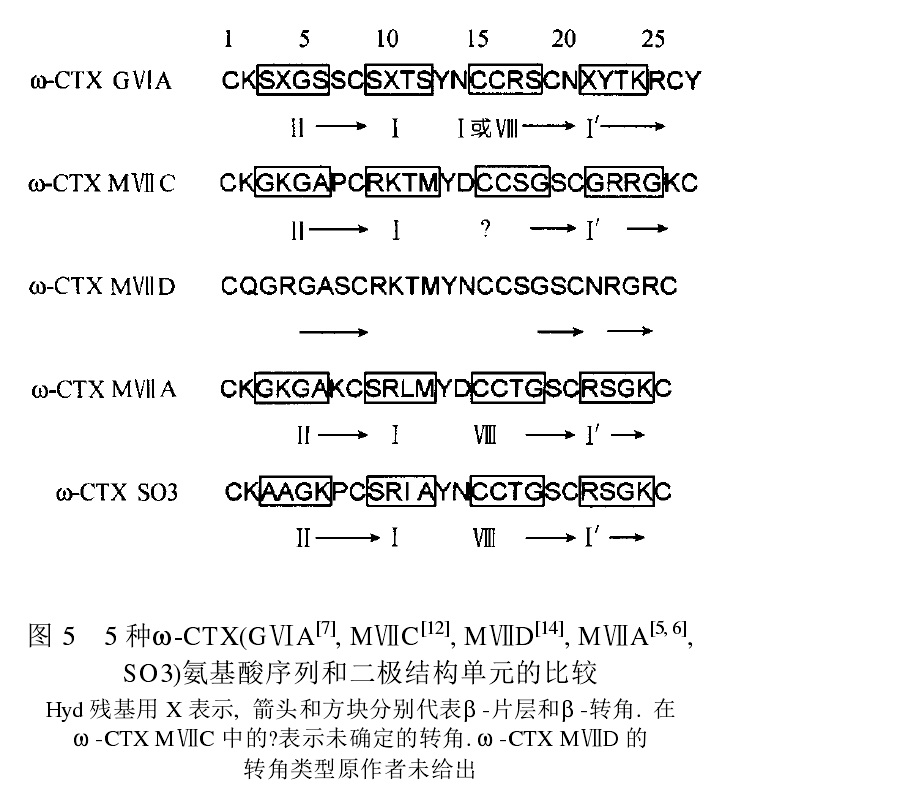 五種ω-CTX胺基酸序列和二極結構單元的比較
五種ω-CTX胺基酸序列和二極結構單元的比較
 五種ω-CTX胺基酸序列和二極結構單元的比較
五種ω-CTX胺基酸序列和二極結構單元的比較作用靶位
ω-CTX特異作用於VSCC,並對各型鈣通道(N、L、P、Q)具選擇性。GⅥA特異作用於N-型VSCC,不可逆。MⅦA也作用於N-型VSCC,但結合可逆。MⅦC主要作用於P/Q型VSCC,只當毒素濃度高於某一閾值時才與N-型結合,該閾值與實驗條件(如離子強度等)有關。SⅥB作用於P/Q型VSCC,SⅥA對哺乳動物大部分鈣通道無活性。TxⅦ是第一個被報導的阻斷L-型VSCC的CTX,但在少數細胞(如PC12)無該作用,提示有亞基識別特異性。CⅥA作用於N-型VSCC,CⅥB或CⅥC對N-和P/Q型VSCC無良好選擇性,CⅥD是至今發現的所有ω-CTX中對N-型VSCC親和力最高的。而CNⅦA對N-型VSCC的選擇性顯著高於P/Q型VSCC。
ω-CTX對VSCC的特異選擇性與通道的亞基組成有關。如N-型VSCC中β3亞基的存在將降低MⅦA和CⅥD的活性,而其α1B亞基的Glu 1332、Gly 1326尤其後者,對GⅥA、MⅦA與靶位的結合及穩定具重要意義。CTX與靶位有非常寬的結合面。有人提出了“宏位點和微位點”假設。某一CTX只須與宏位點上的部分微位點結合即可產生活性效應,多個微位點的結合起協同效應。N-型VSCC分布於神經組織(包括中樞及外周)。鈣通道在神經遞質釋放中起重要作用,尤其是交感神經去甲腎上腺素的釋放。實驗證明GⅥA、MⅦA能抑制中樞及外周交感神經去甲腎上腺素釋放。ω-CTX對乙醯膽鹼釋放的影響較小,但也有發現,如α3β4型nAchR對MⅦC敏感。
殘基對活性影響
用胺基酸(如Ala)取代方法研究某些殘基對GⅥA、MⅦA毒素活性的影響,以半數抑制濃度的變化(△pIC50)為指標,結果表明:Tyr 13是對活性最重要的殘基,△pIC50為2.6~3.9;其次,引起△pIC50>1的MⅦA為Lys 2、Arg 10、Leu 11和Arg 21,GⅥA為Lys 2、Arg 17、Tyr 22和Lys 24;再次,引起△pIC50<1的MⅦA為Lys 4和Lys7,GⅥA為Hyp 10、Thr 11、Asn 20、Arg 25、Tyr 27和Hyp 21;此外,將兩者的N端乙醯化導致活性顯著下降,將C端去醯胺化亦降低活性。用Phe或D-Tyr代替Tyr 13,GⅥA活性顯著下降,表明羥基及其空間取向對結合是關鍵的。用胺基酸替代研究,發現Tyr 13的苯環參與部分而非全部相互作用,其羥基及Tyr 22的羥基對活性則是必需的。用Pro代替GⅥA的3個Hyp殘基,活性無顯著變化,表明Hyp的羥基對結合是非必需的;但合成時用Pro代替Hyp,則產率很低,提示Hyp的羥基對線性肽的摺疊有重要作用。MⅦA結構剛性的保持為活性所必需。將Tyr 13和Asp 14斷裂,活性下降99%;Met 12與Tyr 13斷裂,活性幾乎全部喪失。MⅦC用Ala替代方法研究發現,Thr11、Tyr 13、Lys 2對其與N型或P/Q型VSCC結合均有重要作用,而Lys 4、Arg 22則對P/Q型結合有意義。用各種不同胺基酸替代Thr 11,結果提示具長側鏈的脂溶性胺基酸(aliphatic amino acids with longerside chains)有助於毒素阻斷N型VSCC。 ω-CTX 各胺基酸殘基的 NOE 結構參數
ω-CTX 各胺基酸殘基的 NOE 結構參數
 ω-CTX 各胺基酸殘基的 NOE 結構參數
ω-CTX 各胺基酸殘基的 NOE 結構參數套用
藥物
某些芋螺毒素是最有希望的無成癮性鎮疼藥物,Elan藥物公司研製的新藥Ziconotide已得到美國FDA批准作為治療慢性疼痛的藥物試用,此藥物是ω-芋螺毒素MVIIA的合成化合物,其作用是阻斷疼痛通路的N-型Ca2離子通道,是惟一已知的N-型Ca2離子通道高選擇性阻斷劑,L-、T-型Ca2離子通道阻斷劑不產生鎮疼作用,而T-型Ca2離子通道阻斷則具有致死效應。Ziconotide的優點是無耐藥性與成癮性,但報導說此藥有致幻、視覺模糊、眼球震顫、安靜等副作用。Ziconotide的進一步研究與其衍生物及擬肽化合物的工作尚在進行中。另一個衍生於ω-芋螺毒素CVID的化合物AM336的作用類同於Ziconotide,對N-型Ca2離子通道的選擇性更高,已經批准作為對嚴重抗嗎啡作用的慢性疼痛的治療藥物進入Ⅰ/Ⅱ期臨床試驗。
由於ω-芋螺毒素能作用於多種類型的鈣離子通道,並具有嚴格的生物活性特異性而受到神經生物學家的重視,同時在特異診斷試劑和新藥研製開發方面具有巨大的套用前景,一些ω-芋螺毒素可作為探針檢測不同受體亞型或作為疾病的診斷試劑,如ω-GVIA已開發用於肌無力綜合徵(LEMS)的特異診斷試劑。由Oliver等從幻芋螺中分離的ω-芋螺毒素MVIIA(SNX-111)對減輕和惡性疾病相關的疼痛和作為一種非惡性神經性疼痛兩方面的治療套用已經成功進入了Ⅲ期臨床階段。它由25個胺基酸組成的線性肽,含有3個二硫鍵。顯著的止痛活性由於它是鈣通道阻斷劑,而突觸前神經遞質的釋放需要Ca2+的進入,從而阻止脊髓索神經元傳遞疼痛信號到腦部。