簡介 1997年發現的SOCS(Suppressor of cytokine signaling)系統正好解釋了JAK/STAT信號系統的負調節機理。SOCS由至少8種成分組成,即SOCS1-7和CIS。例如SOCS-1可
抑制細胞 對LIF、OM、IFNγ、
TPO 、
生長激素 和IL-6的信號傳遞,提示SOCS系統是細胞對外界刺激的一種共性的分子調控機制。
SOCSpathway
結構 1 SOCS系統的結構
SOCS系統的蛋白結構近似,均由N區、SH2區和C端的SOCS盒區組成。SOCS盒由近40個胺基酸組成,同源性極強,其功能不詳。不同種系的同一種SOCS的同源性極為相似,表現為高度保守,但不同種類的SOCS的差別極大。SOCS-1於1997年從IL-6誘導小鼠單核白血病細胞MI系的分泌體系中發現。以後又陸續發現了其它SOCS蛋白,SOCS家族概括列於表1。
表1 SOCS家族概況
命名 別名 胺基酸長度 誘生因素 靶分子
SOCS-1 JAB 211 Yes,STAT1,3 JAKs
SOCS-2 CIS-2 197 Yes, ?
SOCS-3 CIS-3 225 Yes.STAT1,3 JAKs
SOCS-4 CIS-7 7521 ? ?
SOCS-5 CIS-6 536 Yes ?
SOCS-6 CIS-4 535 Yes ?
SOCS-7 CIS-5 7485 ? ?
CIS CIS-1 257 Yes,STAT5 Receptors
合成與降解 2 SOCS系統的合成與降解
SOCS系統的
基因表達 通常為陰性,但受到刺激後其合成速度極快。每種SOCS系統受到刺激後基因表達的速度有所不同。例如小鼠肝臟中SOCS-1和SOCS-3受IL-6刺激後可一過性表達,20 min即有表達,4 h後降至基線。與之相對應,SOCS-2和CIS則在IL-6刺激後24 h才有表達。SOCS-5則在IL-6刺激後8~12 h可以表達。大多數細胞因子誘導的SOCS表達是以STAT作為中間調整環節。例如CIS基因表達受STAT5調節,SOCS基因表達則受STAT3調節。將STAT3基因表達封閉後IL-6無法誘導SOCS-1的表達。
生物意義 3 SOCS系統的生物意義
SOCS怎樣
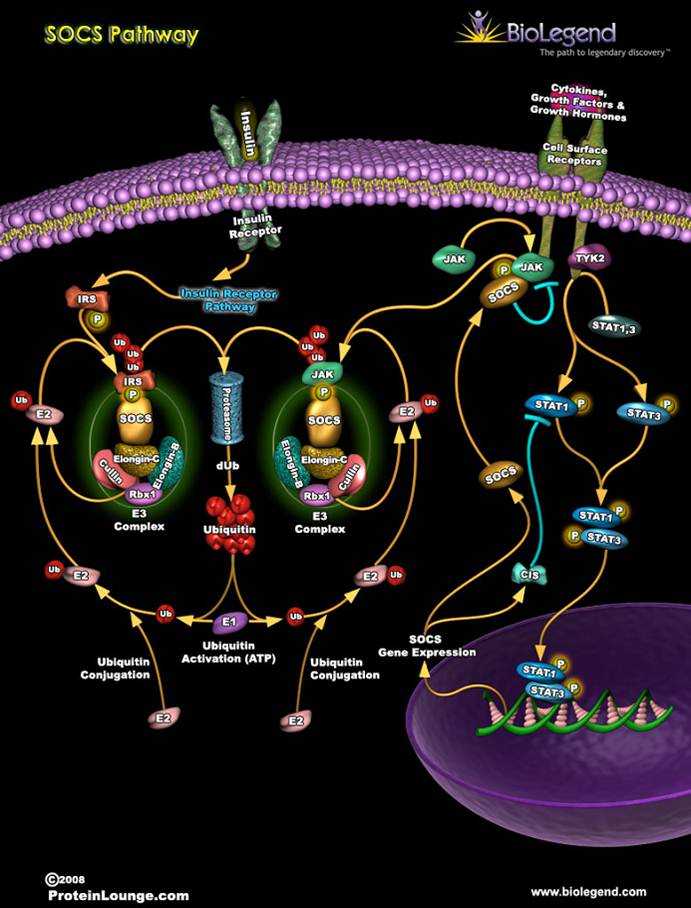
抑制細胞 因子信號傳導通路?JAK/STAT系統的活化是針對細胞因子的刺激,因此一般認為SOCS系統很可能直接作用JAK/STAT通路。JAK和STAT的磷酸化在SOCS-1高表達的細胞內受到下調,其作用的位點有可能是JAK蛋白。在
293細胞 系中隨SOCS-1蛋白的表達,出現了JAK磷酸化的受阻。在CIS高表達的細胞內受阻的靶點是STAT5的磷酸化。二者的作用機理可以用圖1顯示[3]。
圖1 SOCS系統負調節JAK/STAT系統信號傳導的模式圖 4 SOCS系統在疾病中的可能作用
大多數有關SOCS的研究均使用了SOCS超高表達系統,可能並無法完全解釋SOCS的體內意義。利用SOCS蛋白缺陷的
基因敲除小鼠 有可能解釋SOCS的體內意義。例如SOCS-1缺陷小鼠各種造血系統細胞出現超增殖和全身性
自身免疫病 ,其原因可能是細胞因子信號傳導通路失去調控而持續表達。相反,SOCS系統的超高表達則可能出現細胞因子功能的無法實現(信號阻斷)而出現造血
免疫功能低下 。
STAT分子的過高表達往往出現在惡性增殖性疾病中,此時SOCS系統極有可能處於低反應狀態。首先有人發現STAT-3可以被病毒致癌蛋白(V-Src)所激活,以後又發現大量的病毒致癌蛋白(如V-Abl,V-Fps,V-Sis,V-Ros,V-Erk)可以激活STAT家族。在各種各樣的腫瘤細胞系和腫瘤手術標本中發現STAT系統被激活(表2)。在STAT家族中腫瘤組織STAT-3和STAT-5持續性處於高活性狀態(STAT-1亦有較大程度活化)。腫瘤細胞系和新鮮組織中STAT-3活化的同時,Src和
EGF受體 的激活性被持續激活。造血系統腫瘤(白血病和
淋巴細胞 )中STAT家族被活化的種類最多,白血病同時伴有BCR-Ab1轉位和STA-5及STAT-1的活化。我們預試驗曾觀察到腫瘤細胞的STAT活躍程度遠高於其SOCS,與正常細胞形成明顯對比(未發表資料),其意義在探討中。
SoCs (system on chips) - 系統單晶片
隨著製程技術快速發展,相同面積晶片可置入更多之電晶體,因此以往需要多個晶片方能達成的系統與功能,現已能被整合在單一晶片中
所謂系統單晶片(System-on-a-Chips,簡稱SoCs)就是藉由單一晶片來完成整個系統的功能。系統單晶片所強調的就是晶片的整合,將各種不同晶片整合為一,來支持整個系統運作所需。