示蹤用鹽酸米托蒽醌注射液主要成份為鹽酸米托蒽醌,適應症為用於甲狀腺手術區域引流淋巴結的示蹤。
基本介紹
- 藥品名稱:示蹤用鹽酸米托蒽醌注射液
- 外文名: Mitoxantrone Hydrochloride Injection for Tracing
- 劑型:注射劑
- 批准文號:國藥準字H20210025
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥理作用,毒理研究,藥代動力學,貯藏,包裝,有效期,執行標準,批准文號,生產企業,上市許可持有人,
成份
化學名稱: 1, 4-二羥基-5, 8-雙[[2-[(2-羥乙基)氨基]乙基]氨基]-9, 10-蒽醌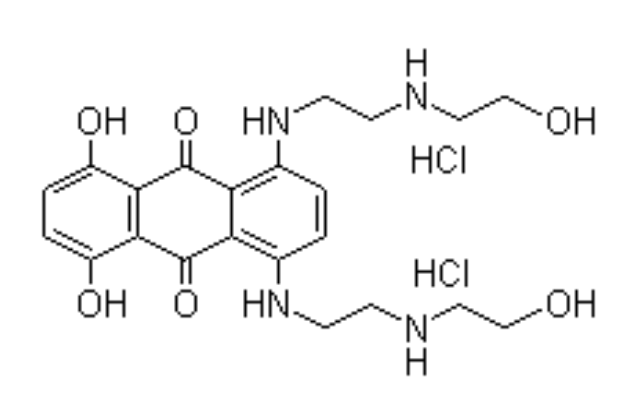

化學結構式
二鹽酸鹽
化學結構式:
分子式: C22H28N4O6·2HCl
分子量: 517.41
輔料:醋酸、醋酸鈉、焦亞硫酸鈉、氯化鈉、硫酸鈉、注射用水
性狀
本品為深藍色的澄明液體。
適應症
用於甲狀腺手術區域引流淋巴結的示蹤。
用於乳腺癌前哨淋巴結的示蹤
規格
1ml∶5mg
2ml:10mg
用法用量
手術中使用,充分暴露甲狀腺後,取本品在甲狀腺腺體內單點或多點注射, 注射時須避開血管及腫瘤組織。 每個注射點間隔 1cm 左右,每個點位注射約 0.1ml,注射總劑量一般不超過 0.6ml,實際注射劑量根據甲狀腺大小決定。注射完畢後用紗布稍加按壓後進行手術。
不良反應
本品用於淋巴示蹤的安全性數據來自一項甲狀腺癌患者的III 期、 多中心、隨機、空白對照臨床試驗。其中試驗組234 例患者接受了 0.1~0.6ml 本品在術中進行淋巴示蹤,中位劑量為0.5ml,平均劑量為 0.5ml,患者平均注射點位為 5 個,空白對照組233 例患者不注射任何示蹤劑進行手術。
臨床試驗結果表明,試驗組和對照組的主要不良事件是圍術期症狀。試驗組25例患者(10.7%) 發生了 3 級及以上不良事件,空白對照組 20 例患者(8.6%)發生了3 級及以上不良事件。試驗組有 6 例患者(2.6%) 發生了 6 例次嚴重不良事件,包括淋巴溢液、 傷口感染、 插管部位分泌物、 甲狀腺疾病和妊娠, 空白對照組有6 例患者(2.6%)發生了 8 例次嚴重不良事件, 包括切口出血、吻合口瘺、休克、 多器官功能不全綜合徵、低鈣血症、氣道高反應和上呼吸道感染。兩組手術後圍術期甲狀旁腺素降低的比例相似,試驗組和空白對照組分別為 34.2%和 32.6%,與手術操作和局部血運變化等因素相關,試驗未收集術後遠期甲狀旁腺素情況,但誤切患者和未誤切患者分別有 39.0%和 21.1%的受試者長期補充鈣劑。
試驗組患者術後無死亡,空白對照組發生了 1 例氣管切開術後吻合口瘺併發症(器官功能障礙綜合徵和感染性休克)導致的死亡。
試驗組的不良事件經研究者判斷與本品無關。
禁忌
對本品任何成分過敏者禁用。
注意事項
1、 不得注入血管。
2、注射量不宜過多過快,每個點位注射約 0.1ml,總量一般不超過 0.6ml。
3、 本品採用普通醫用注射器,不得與其他藥物在同一注液器中混合使用。
4、本品遇低溫可能析出晶體,可將西林瓶置熱水(70~80℃) 中加溫,晶體溶解後使用。
5、藥液僅供單次使用。
6、臨床試驗尚未報告米托蒽醌導致過敏的情形,如發生急性過敏,應立即給予支持對症和抗過敏處理。
孕婦及哺乳期婦女用藥
米托蒽醌有潛在的生殖毒性,可從乳汁分泌,孕婦及哺乳期婦女禁用。
兒童用藥
目前尚無本品用於18 歲以下兒童或青少年患者的臨床數據,本品在兒童或青少年患者中的安全性和有效性尚不明確。
老年用藥
在一項甲狀腺癌患者的III 期、多中心、隨機、空白對照臨床試驗中共入組 496例受試者, 59 名年齡≥60 歲受試者接受本品在術中進行淋巴示蹤,經統計,此部分人群的安全有效性特徵與總體人群一致。
藥物相互作用
本品為擬切除部位的局部用藥,隨手術中藍染的甲狀腺組織和淋巴組織的切除而清除,極微量進入血液循環,未觀察到對其他藥物的吸收和代謝產生影響。
藥物過量
尚不明確。
藥理毒理
藥理作用
示蹤用鹽酸米托蒽醌注射液局部注射具有淋巴系統靶向性,注射到腫瘤周緣組織中,進入淋巴管迅速,聚集且長時間滯留於淋巴結,使淋巴管和淋巴結藍染,而起到示蹤的作用。本品在甲狀腺手術區域引流淋巴結的示蹤中,對甲狀旁腺特異性不染色,利於肉眼辨認需保護的甲狀旁腺和擬清除的區域引流淋巴結。
鹽酸米托蒽醌可通過氫鍵嵌入脫氧核苷酸(DNA), 導致 DNA 鏈的斷裂;可干擾核苷酸(RNA), 為拓撲異構酶 II 的潛在抑制劑。 米托蒽醌對體外培養的增殖性和非增殖性人源細胞均有細胞毒性,這提示其缺乏細胞周期特異性。此外, 米托蒽醌可抑制 B 細胞、 T 細胞以及巨噬細胞的增殖, 影響抗原提呈, 同時對干擾素 γ、 TNFα 和IL-2 的分泌也有抑制作用。
毒理研究
示蹤用鹽酸米托蒽醌注射液為局部用藥,隨手術中藍染組織的切除而清除,按體表面積換算,給藥劑量遠低於鹽酸米托蒽醌靜脈給藥推薦人體劑量。
以下為鹽酸米托蒽醌靜脈給藥作為化療藥物的毒理研究數據:
遺傳毒性
鹽酸米托蒽醌 Ames 試驗、大鼠骨髓微核試驗、 大鼠原代肝細胞和中國倉鼠卵巢細胞的染色體畸變試驗結果均為陽性。動物試驗中未見致畸性。
生殖毒性
文獻資料顯示,妊娠大鼠器官形成期靜脈注射給予米托蒽醌, 給藥劑量>0.1mg/kg/天時可見胚胎髮育遲緩。 妊娠兔器官形成期靜脈注射給予米托蒽醌, 給藥劑量>0.1mg/kg/天時, 可見早產風險增加。米托蒽醌可通過乳汁分泌。
致癌性
文獻資料顯示,大鼠和小鼠每 21 天給藥一次,連續 24 個月靜脈注射米托蒽醌。大鼠劑量為 0.03mg/kg 時,可見纖維瘤和外耳道瘤發生率增加;小鼠劑量為 0.1mg/kg時,可見雄性肝細胞瘤發生率增加。大鼠每21 天給藥一次,連續 12 個月靜脈注射米托蒽醌 0.3mg/kg 時,可見大鼠外耳道瘤發生率增加。
藥代動力學
本品注射到甲狀腺腺體後,迅速到達區域引流淋巴結,隨注射部位和淋巴組織的切除而清除,極微量進入血液循環,當注射劑量為0.6ml 時,進入人體循環的含量為0.00129mg/kg,在 10~20min 達到最大值,在 30min 內基本清除。主要通過膽汁由糞便排出,排出物主要為原型藥,亦有代謝產物。
貯藏
遮光,不超過 25℃保存。
包裝
中硼矽玻璃管制注射劑瓶,注射液用覆乙烯-四氟乙烯共聚物膜氯化丁基橡膠塞,抗生素瓶用鋁塑組合蓋。1 支/盒。
有效期
24 個月。
執行標準
YBH08392021
批准文號
國藥準字 H20210025
生產企業
上海創諾製藥有限公司
上市許可持有人
深圳華潤九創醫藥有限公司