專利背景 布尼亞病毒 是球形、有包膜和分節段負鏈RNA病毒。因首先從烏干達西部的布尼亞韋拉分離到該科的代表種-布尼亞韋拉病毒而得名。布尼亞韋拉病毒直徑90~100納米,從包膜伸出許多糖蛋白突起,內有3個螺旋對稱的核殼,分別含大(L)、中(M)、小(S)3個RNA節段,其中L和M為負鏈RNA,分別編碼病毒的多聚酶(RNA依賴的RNA多聚酶,RdRP)、糖蛋白(Gn和Gc);S片段為雙義RNA,編碼核蛋白(NP)和非結構蛋白(NSs)。根據血清學和生物化學分析,已確定有5個屬,即布尼亞病毒屬、白蛉病毒屬、漢坦病毒屬、內羅病毒屬和烏庫病毒屬,分別包含145、30、6、27和7個血清型。另有22個病毒被認為是本科的可能成員。
布尼亞病毒的自然感染見於許多脊椎動物和節肢動物(蚊、蜱、白蛉等),可感染小鼠,並能在一些哺乳類、鳥類和蚊細胞培養中生長;對人可引起類似流感或登革熱的疾病、出血熱(立夫特谷熱和克里米亞-剛果出血熱等)及腦炎(加利福尼亞腦炎)。有蚊媒、蜱媒、白蛉媒三種傳播類型。有些病毒在其節肢動物媒介中,可經卵、交配或胚胎期傳播。
截至2010年11月23日,在中國
河南 、湖北、山東、
江蘇 、遼寧等地陸續發現了發熱伴血小板減少為主要臨床表現的感染性病例,少數重症患者因多臟器損害,救治無效死亡。這類患者病因尚不明確。該類病例臨床表現為急性發熱起病,多數患者伴有乏力、納差、噁心、嘔吐、腹痛、腹瀉等症狀,部分患者出現黑便、牙齦出血、皮膚瘀點或瘀斑、眼結膜充血等出血症狀。絕大部分患者臨床檢查的結果為白細胞降低,血小板減少,部分患者谷丙/穀草轉氨酶升高,尿蛋白呈陽性。為進一步明確該病的臨床及流行病學特徵,探索病因和防治手段,在湖北、山東、河南、江蘇、遼寧等省部分地區開展監測工作。在對病原一無所知的情況下,通過非序列依賴的核酸擴增、病毒分離、核酸檢測包括螢光定量PCR(Real-timePCR)和套式PCR、血清學檢測等方法對上述地區的感染性病例進行病毒篩檢和分離,同時進行病毒基因組學研究,對了解病毒來源、進化過程及分子流行病學有重要意義,同時也為疾病鑑別診斷以及疫苗的研製奠定了基礎,具有巨大的經濟和社會效益。
發明內容 專利目的 《發熱伴血小板減少綜合徵病毒的全基因序列及套用》的目的是提供一種新的發熱伴血小板減少綜合徵病毒,以及以湖北分離株HB29為代表的全基因序列及其胺基酸序列。
《發熱伴血小板減少綜合徵病毒的全基因序列及套用》的另一目的是提供該發熱伴血小板減少綜合徵病毒的全基因序列及其編碼的蛋白在製備預防或治療由發熱伴血小板減少綜合徵病毒所致傳染病的藥物、疫苗或診斷試劑中的套用。
技術方案 為了實現《發熱伴血小板減少綜合徵病毒的全基因序列及套用》目的,《發熱伴血小板減少綜合徵病毒的全基因序列及套用》的發熱伴血小板減少綜合徵病毒,該病毒基因組編碼:
I)a、SEQIDNo.4所示胺基酸序列組成的蛋白,或b、SEQIDNo.4所示胺基酸序列經替換、缺失或添加一個或幾個胺基酸形成的由a所述蛋白衍生的具有同等功能的蛋白;例如在非活性區段,將第479位的V替換為I,不會影響蛋白的功能。
II)c、SEQIDNo.5所示胺基酸序列組成的蛋白,或d、SEQIDNo.5所示胺基酸序列經替換、缺失或添加一個或幾個胺基酸形成的由c所述蛋白衍生的具有同等功能的蛋白;例如在非活性區段,將第13位的L替換為F,不會影響蛋白的功能。III)e、SEQIDNo.6所示胺基酸序列組成的蛋白,或f、SEQIDNo.6所示胺基酸序列經替換、缺失或添加一個或幾個胺基酸形成的由e所述蛋白衍生的具有同等功能的蛋白;例如在非活性區段,將第156位的A替換為T,不會影響蛋白的功能。
IV)g、SEQIDNo.7所示胺基酸序列組成的蛋白,或h、SEQIDNo.7所示胺基酸序列經替換、缺失或添加一個或幾個胺基酸形成的由g所述蛋白衍生的具有同等功能的蛋白;例如在非活性區段,將第144位的R替換為Q,不會影響蛋白的功能。
前述的病毒,該病毒基因組包括SEQIDNO.1、SEQIDNO.2和SEQIDNO.3所示的核苷酸序列,或與SEQIDNO.1、SEQIDNO.2和SEQIDNO.3所示的核苷酸序列同源性在95%以上的核苷酸序列。
《發熱伴血小板減少綜合徵病毒的全基因序列及套用》還提供前述發熱伴血小板減少綜合徵病毒產生的多聚酶(RdRP)、糖蛋白(Gn和Gc)、核蛋白(NP)或非結構蛋白(NSs)。
《發熱伴血小板減少綜合徵病毒的全基因序列及套用》還提供編碼前述多聚酶、糖蛋白、核蛋白或非結構蛋白的基因。
《發熱伴血小板減少綜合徵病毒的全基因序列及套用》還提供含有前述多聚酶、糖蛋白、核蛋白或非結構蛋白編碼基因的載體。
《發熱伴血小板減少綜合徵病毒的全基因序列及套用》還提供含有上述載體的宿主細胞。
《發熱伴血小板減少綜合徵病毒的全基因序列及套用》進一步提供前述發熱伴血小板減少綜合徵病毒,該病毒基因組編碼的多聚酶、糖蛋白、核蛋白或非結構蛋白,編碼多聚酶、糖蛋白、核蛋白或非結構蛋白的基因,含有多聚酶、糖蛋白、核蛋白或非結構蛋白編碼基因的載體或含有所述載體的宿主細胞在製備預防或治療由發熱伴血小板減少綜合徵病毒所致傳染病的藥物或疫苗中的套用。
另外,《發熱伴血小板減少綜合徵病毒的全基因序列及套用》提供用於檢測發熱伴血小板減少綜合徵病毒的特異性引物和/或探針。根據所述病毒的基因組序列設計用於檢測該病毒的特異性引物,經RT-PCR後檢測擴增產物,可以通過凝膠電泳、測序等方式進行檢測,引物序列一般為18~36個鹼基的寡核苷酸鏈,該領域技術人員可以通過相關生物軟體和線上工具進行設計。根據所述病毒的基因組序列,還可以設計相關特異性探針,針對RNA或DNA進行檢測,並可結合基因晶片技術進行檢測,探針一般為20~50個核苷酸。一種較佳的方式是通過螢光定量RT-PCR進行檢測,包括特異性引物及相應的螢光探針。
優選地,所述引物和探針包括:
I)L-F-3:5’-AGTCTAGGTCATCTGATCCGTTC/TAG-3’;
L-R-3:5’-TGTAAGTTCGCCCTTTGTCCAT-3’;
L-探針-3:5’-CAATGACAGACGCCTTCCATGGTAATAGGG-3’;和/或
II)M-F-3:5’-AAGAAGTGGCTGTTCATCATTATTG-3’;
M-R-3:5’-GCCTTAAGGACATTGGTGAGTA-3’;
M-探針-3:5’-TCATCCTCCTTGGATATGCAGGCCTCA-3’;和/或
III)S-F-3:5’-GGGTCCCTGAAGGAGTTGTAAA-3’;
S-R-3:5’-TGCCTTCACCAAGACTATCAATGT-3’;
S-探針-3:5’-TTCTGTCTTGCTGGCTCCGCGC-3’。
《發熱伴血小板減少綜合徵病毒的全基因序列及套用》還提供含有上述引物和/或探針的檢測試劑盒。
《發熱伴血小板減少綜合徵病毒的全基因序列及套用》從湖北、山東、河南、江蘇、遼寧等地以發熱伴血小板減少為主要臨床表現的感染性病例中分離獲得病毒(結合該病毒感染所導致的臨床症狀故命名為新的發熱伴血小板減少綜合徵病毒),並進一步獲得該病毒的基因全系列。具體地說,《發熱伴血小板減少綜合徵病毒的全基因序列及套用》的技術方案是通過病毒分離培養,核酸檢測包括螢光定量PCR(Real-time PCR)和套式PCR,血清學檢測對上述感染性病例進行了病毒篩查檢測、分離和鑑定,同時利用SISPA(核酸序列非依賴單引物擴增法)對湖北、山東、河南、江蘇、遼寧等省份病例標本進行擴增;根據最初由序列非依賴單引物擴增(SISPA)得到的序列設計引物,進行目的基因的PCR擴增,進行PCR產物純化並測序,最終獲得以湖北病毒株HB29為代表共11株發熱伴血小板減少綜合徵病毒的全部基因組序列。通過序列分析發現,該病毒屬於布尼亞病毒科,包括三個基因片段L、M和S,分別表達病毒的多聚酶、糖蛋白(Gn和Gc)和核蛋白(NP)及非結構蛋白(NSs),並且三個片段均在白蛉病毒屬這一分支上,但與該屬的其他病毒距離較遠,因此屬於全新的布尼亞病毒科白蛉病毒屬;此外,這11株病毒的序列高度同源:L片段的同源性在95.9-99.8%,M片段的同源性在95.3-99.6%,S片段的同源性在95.2-99.7%。
改善效果 藉由上述技術方案,《發熱伴血小板減少綜合徵病毒的全基因序列及套用》至少具有下列優點及有益效果:
(1)《發熱伴血小板減少綜合徵病毒的全基因序列及套用》首次闡明了以發熱伴血小板減少為主要臨床表現的一種新的布尼亞病毒科白蛉病毒屬的全基因組序列,以及各結構基因、調控基因和各自編碼的蛋白。
(2)由發熱伴血小板減少綜合徵病毒各主要基因及其編碼的蛋白研製的核酸診斷和血清學診斷試劑可分別用於該類新的發熱伴血小板減少綜合徵病毒感染的鑑別診斷以及基因及工程疫苗的研製,具有巨大的經濟和社會效益。
(3)《發熱伴血小板減少綜合徵病毒的全基因序列及套用》基於對湖北分離株HB29全基因序列的測定,有助於進一步了解與該病毒增殖及重要調控功能有關的基因結構和功能,研究其分子生理機制以及侵染宿主的關鍵點,尋找病毒致死基因或細胞受體,通過基因或基因轉化製成核酸或蛋白類生物製劑,形成治療該類病毒性傳染病的有效手段。
(4)《發熱伴血小板減少綜合徵病毒的全基因序列及套用》涉及的發熱伴血小板減少綜合徵病毒(湖北分離株HB29)的三個片段均在白蛉病毒屬這一分支上,但與該屬的其他病毒距離較遠。L片段編碼的胺基酸與其他的白蛉病毒的同源性為32-33%,M片段編碼的糖蛋白的同源性在20-36%,S片段編碼的NSs的同源性較低,在11.2-16.0%,因此《發熱伴血小板減少綜合徵病毒的全基因序列及套用》涉及的發熱伴血小板減少綜合徵病毒為全新的布尼亞病毒科白蛉病毒屬。
(5)《發熱伴血小板減少綜合徵病毒的全基因序列及套用》還涉及用於該類新的發熱伴血小板減少綜合徵病毒檢測的特異性引物和探針。根據已測定的11株病毒全基因序列,分別比對11株病毒的L、M、S序列,界定其保守區,利用Primer express軟體設計分別針對三個片段的引物和Taq man探針,通過多重Real-time PCR或套式PCR對感染性病例進行擴增,結果針對L、M、S片段的引物和探針均顯示出較好的特異性。
(6)《發熱伴血小板減少綜合徵病毒的全基因序列及套用》還可用來研製血清學鑑別診斷試劑。根據發熱伴血小板減少綜合徵病毒(HB29)全基因序列分析結果,三個基因片段L、M和S分別表達病毒的多聚酶、糖蛋白(Gn和Gc)和核蛋白及非結構蛋白(NSs)。可以分別構建表達核蛋白基因的原核表達系統和真核表達系統。
表達核蛋白基因的原核表達系統以原核表達質粒pET30a系列質粒為載體,設計酶切位點,將目的基因通過常規的PCR方法擴增後,克隆到pET30a系列質粒中,以大腸桿菌BL21為宿主菌,0.1-1.0米MIPTG作為誘導劑誘導表達重組蛋白,可得到分子量為約27KD的目的蛋白。表達產物經離子交換層析、親和層析和分子篩等方法純化後可用於製備血清學診斷試劑或基因工程亞單位疫苗。
另一方面,還可以分別構建表達核蛋白基因和糖蛋白基因的真核表達系統,以真核表達載體pcDNA3系列質粒或昆蟲-桿狀病毒表達載體pACUW51質粒為載體,設計好酶切位點,將目的基因通過常規的PCR方法擴增後,克隆到表達載體中,轉染相應細胞株如293T,sf9細胞,使其在細胞中成功表達後,將表達陽性的細胞製備成抗原片,通過間接免疫螢光(IFA)對病人血清進行檢測。
此外,《發熱伴血小板減少綜合徵病毒的全基因序列及套用》的發熱伴血小板減少綜合徵病毒(HB29)全基因序列可用於構建該種新病毒感染性分子克隆。可對陽性的感染性分子克隆進行基因改造,用刪除或人工誘變方法使毒力基因失活,從而得到非致病的感染性分子克隆,從而獲得毒力減弱的毒株,用於減毒疫苗株或顆粒疫苗的研製。
附圖說明 圖1為《發熱伴血小板減少綜合徵病毒的全基因序列及套用》較佳實施例新型發熱伴血小板減少綜合徵病毒的分離鑑定結果,A代表免疫螢光檢測顯示病毒感染細胞與病人血清反應呈陽性;B代表電鏡下觀察到的病毒形態。
圖2為《發熱伴血小板減少綜合徵病毒的全基因序列及套用》較佳實施例新型發熱伴血小板減少綜合徵病毒L基因片段進化樹。
圖3為《發熱伴血小板減少綜合徵病毒的全基因序列及套用》較佳實施例新型發熱伴血小板減少綜合徵病毒M基因片段進化樹。
圖4為《發熱伴血小板減少綜合徵病毒的全基因序列及套用》較佳實施例新型發熱伴血小板減少綜合徵病毒S基因片段進化樹。
圖5為《發熱伴血小板減少綜合徵病毒的全基因序列及套用》較佳實施例多重Real-timePCR檢測病人血清擴增結果示意圖。
圖6為《發熱伴血小板減少綜合徵病毒的全基因序列及套用》表達HB29株的核蛋白(NP),全長糖蛋白(G),糖蛋白(Gc)的重組桿狀病毒感染Sf9昆蟲細胞製成的抗原片與病人血清反應的結果示意圖。
技術領域 《發熱伴血小板減少綜合徵病毒的全基因序列及套用》涉及病毒學、分子生物技術領域,具體地說,涉及一種新的發熱伴血小板減少綜合徵病毒的全基因序列及套用。
權利要求 1.發熱伴血小板減少綜合徵病毒,該病毒基因組經反轉錄後得到的核苷酸序列如SEQIDNO.1、SEQIDNO.2和SEQIDNO.3所示。
2.如權利要求1所述的發熱伴血小板減少綜合徵病毒,該病毒基因組編碼:
I)SEQIDNo.4所示胺基酸序列組成的蛋白;
II)SEQIDNo.5所示胺基酸序列組成的蛋白;
III)SEQIDNo.6所示胺基酸序列組成的蛋白;
IV)SEQIDNo.7所示胺基酸序列組成的蛋白。
3.權利要求1或2所述病毒的基因組。
4.權利要求1或2所述發熱伴血小板減少綜合徵病毒產生的聚合酶、糖蛋白或核蛋白。
5.權利要求1或2所述發熱伴血小板減少綜合徵病毒產生的非結構蛋白。
6.編碼權利要求4所述聚合酶、糖蛋白或核蛋白的基因。
7.編碼權利要求5所述非結構蛋白的基因。
8.含有權利要求6或7所述基因的載體。
9.含有權利要求8所述載體的宿主細胞。
10.權利要求1或2所述病毒在製備預防或治療由發熱伴血小板減少綜合徵病毒所致傳染病的藥物中的套用。
11.權利要求4所述糖蛋白或核蛋白在製備由發熱伴血小板減少綜合徵病毒所致傳染病的診斷試劑中的套用。
12.權利要求6或7所述的基因在製備由發熱伴血小板減少綜合徵病毒所致傳染病的診斷試劑中的套用。
13.用於檢測權利要求1或2所述病毒的引物和探針,包括:
I)L-F-3:5’-AGTCTAGGTCATCTGATCCGTTC/TAG-3’;L-R-3:5’-TGTAAGTTCGCCCTTTGTCCAT-3’;L-探針-3:5’-HEX-CAATGACAGACGCCTTCCATGGTAATAGGG-BHQ1-3’;
II)M-F-3:5’-AAGAAGTGGCTGTTCATCATTATTG-3’;M-R-3:5’-GCCTTAAGGACATTGGTGAGTA-3’;M-探針-3:5’-FAM-TCATCCTCCTTGGATATGCAGGCCTCA-BHQ-2-3’;
III)S-F-3:5’-GGGTCCCTGAAGGAGTTGTAAA-3’;S-R-3:5’-TGCCTTCACCAAGACTATCAATGT-3’;S-探針-3:5’-TexasRed-TTCTGTCTTGCTGGCTCCGCGC-BHQ-2-3’。
14.含有權利要求13所述引物和探針的檢測試劑盒。
實施方式 以下實施例用於說明《發熱伴血小板減少綜合徵病毒的全基因序列及套用》,但不用來限制《發熱伴血小板減少綜合徵病毒的全基因序列及套用》的範圍。
若未特別指明,實施例中所用的技術手段均為該領域技術人員所熟知的常規手段。
自2004年以來,浙江、江蘇、安徽、山東、河南和湖北等省相繼發現並報告發熱伴血小板減少為主要表現的感染性疾病病例,其中少數嚴重患者發展為多臟器損害,甚至死亡,2010年5月以來國家CDC病毒病所自
山東 、
湖北 、河南、江蘇、
安徽 和遼寧等6個省份採集197份具有類似症狀患者血清標本。
採用常規組織培養法,對來源於上述6個省份的197份標本分別進行病毒分離檢測。將100微升的病人血清用DMEM1∶10稀釋至1毫升,接種至25平方厘米培養瓶vero細胞(Greiner Bio-One)中,37℃吸附1小時,補加4毫升DMEM維持液(含2%胎牛血清及1000單位/mL青黴素和鏈黴素),將培養瓶置於37℃,5%CO2 培養箱中培養,每天觀察是否出現細胞病變(CPE),培養7-10天后,將培養上清凍存於-80℃,取1毫升傳代,以表4所列引物探針進行多重RT-PCR檢測細胞上清病毒核酸的方法監控病毒的複製情況,未接種病毒的正常細胞培養上清也同時進行收集和PCR檢測,另外,將不同病毒感染時間的細胞固定制作抗原片,使用恢復期的病人血清進行免疫螢光試驗來監控病毒的複製情況。
結果表明,《發熱伴血小板減少綜合徵病毒的全基因序列及套用》從6個省份的197份病人血清中分離獲得包括HB29在內的共11株病毒,病毒分離過程中將病人血清接種於vero細胞培養7-10天后細胞病變不明顯。如圖1所示,以HB29分離株為代表,免疫螢光檢測顯示病毒感染細胞與病人血清反應呈陽性(A);經電鏡檢查,新分離的布尼亞病毒顆粒呈粗糙圓球形,平均直徑80-100納米,有緻密的包膜及細的表面突起(B)。
血清中病毒核酸的擴增是根據Allander等(2001)的方法並進行了一些改動。首先對2010年獲得的第一份患者急性期血清標本HB29進行處理:140微升的血清用PBS(pH7.4)進行兩倍稀釋,10,000克離心10分鐘去除細胞碎片,並以孔徑為0.2微米的濾膜去除細胞團塊或細菌,然後在血清中加入14UDNA酶(Ambion),20Ubenzonase核酸酶(Novagen)和20URNA酶(Promega),緩衝液使用1×DNA酶緩衝液(Ambion),37℃消化2小時去除非病毒(無病毒顆粒保護)的核酸。採用病毒RNA分離試劑盒(Qiagen),根據說明書從280微升稀釋後的血清中提取RNA以40微升無RNase的水洗脫。第一鏈cDNA的合成:向13微升純化RNA中加入2微升10微米隨機引物(Promega)得到15微升的混合物,70℃加熱10分鐘,4℃放置5分鐘以解開RNA的二級結構,然後加入30UAMV逆轉錄酶(Promega),加水至終體積為25微升,於37℃反應1小時。第二鏈cDNA的合成:取20微升的第一鏈產物,加入2.5X第二鏈cDNA反應緩衝液40微升,牛血清白蛋白(1毫克/毫升)5微升,E.coliDNA聚合酶I23u(Promega),RNaseH1u(Promega),加水至終體積為100微升,14℃孵育2小時後,於70℃加熱10分鐘滅活DNA聚合酶I,再加入2UT4DNA聚合酶(Promega),於37℃反應10分鐘,加入10微升200mMEDTA終止反應,使用QIAquickPCR純化試劑盒(Qiagen)對其進行純化,純化後的產物加入磷酸化的平端接頭E19(5’-AGCAATTCCGTTGCTGTCG-3’)和E12(5’-pCGACAGCAACGG-3’),16℃連線4小時,以連線產物為模板,寡核苷酸E19為引物進行擴增,反應條件為94℃,3分鐘;94℃,30s,55℃,1分鐘,72℃,2分鐘,40個循環,72℃,10分鐘。PCR產物經凝膠電泳後呈彌散條帶,2-500bp,500-1000bp及大於1000bp的彌散帶分別用Qiagen試劑盒回收並克隆至pGEMT-easy載體(Promega),人工挑選576個克隆並測序。
得到的序列通過blast進行同源性分析,每個序列通過搜尋標準非冗餘資料庫以及資料庫的高通量基因組序列,胺基酸序列通過blastp進行同源性分析。
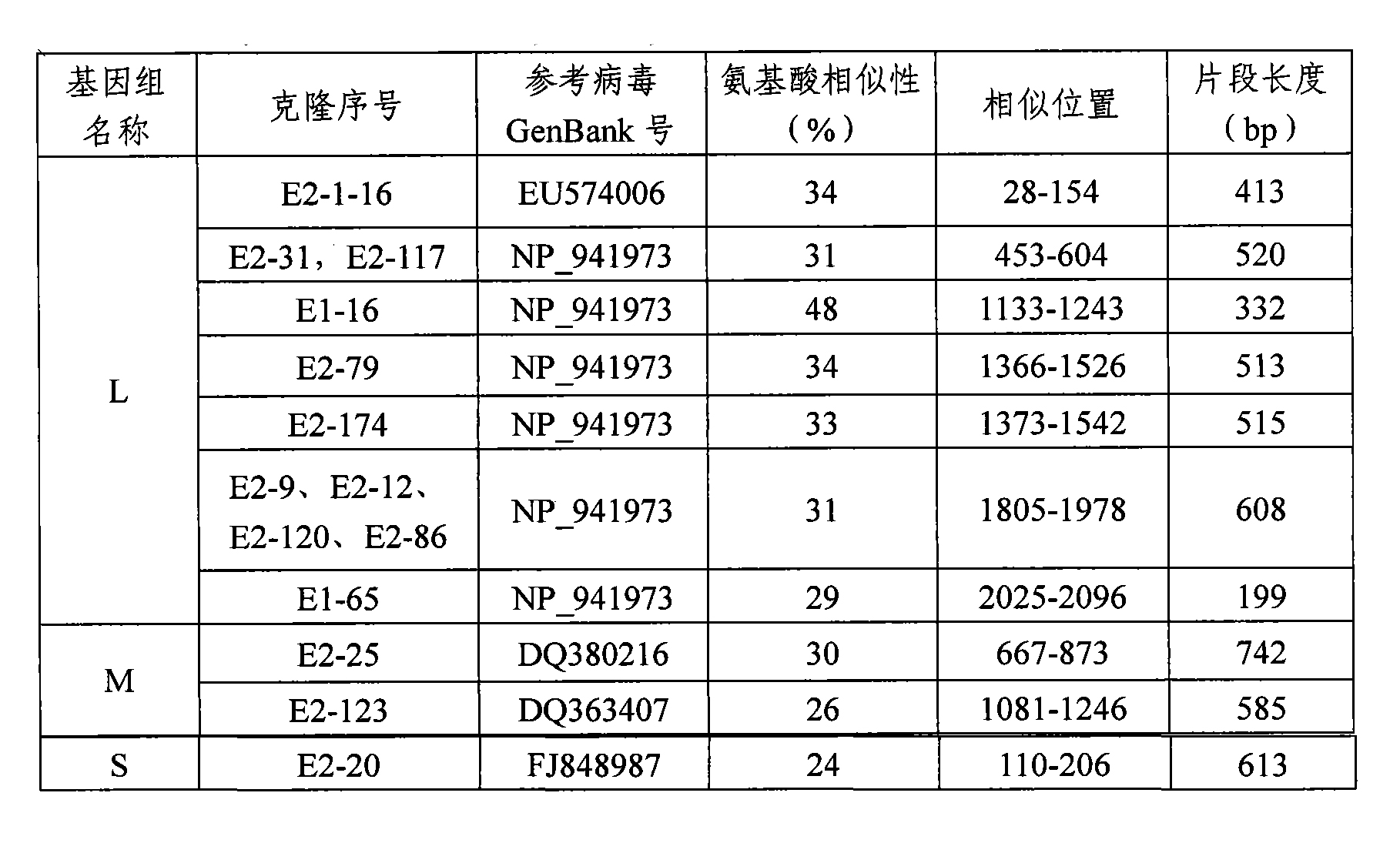
結果表明:對576個克隆的測序結果進行分析,先去掉兩端引物序列,對得到的核苷酸序列進行blast分析,分析結果顯示90%的克隆為人類基因組序列,還有一小部分為非培養細菌,少數為比對不出任何信息的未知序列;對這部分未知序列進一步進行胺基酸的比對分析,在推斷其胺基酸序列時,用六種可能的讀碼框來推斷其胺基酸序列,對得到的所有胺基酸序列在Genbank的資料庫中進行蛋白比對。15個克隆得到有用的信息,其中11個克隆的胺基酸序列與白蛉病毒的L蛋白有一定的相似性,克隆E2-31、E2-117編碼相同的胺基酸,其編碼的胺基酸位點在Uukuniemi病毒(NP_941973.1)L蛋白的453-604區間,E2-91的位點在其1357-1526區間,E2-79在其(1366-1526)區間,E2-174在其(1373-1542)區間,E2-9、E2-12、E2-120、E2-86編碼相同的胺基酸,位點在其1805-1978之間,E1-65在其(2025-2096)區間,E1-16與Toscana病毒(ACM92008.1)1127-1237區間相似;15個克隆中有2個克隆與白蛉病毒糖蛋白(GP)的部分胺基酸序列相似:E2-25與RiftValley熱病毒gb|ABD38829.1|的667-873區間相似,E2-123與PuntaToro病毒(gb|ABD92923.1|)的1081-1246區間相似;另外有兩個克隆與白蛉病毒的S片段編碼的胺基酸有相似性:E2-20與Punique病毒(gb|ACZ43796.1|)編碼的NSs蛋白110-206區間有相似性(表1)。
這些數據均表明該病毒與白蛉病毒較接近,但相似度較低(BLAST的E值範圍在1.4~4×10之間),表明該病毒可能為白蛉病毒屬的一個新亞型。
表1SISPA方法發現的類白嶺病屬基因組序列及其定位
表1
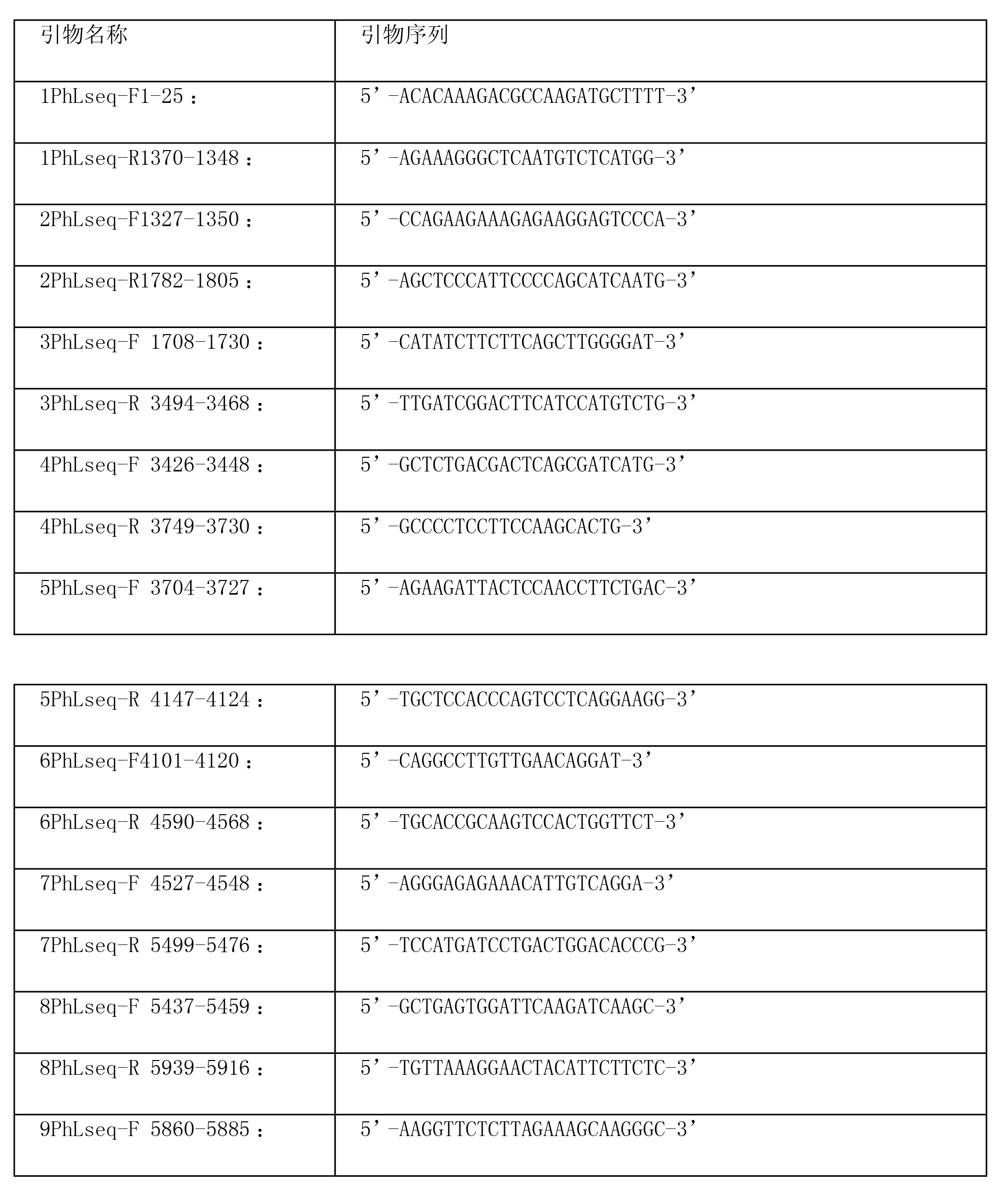
根據最初由SISPA得到的序列設計引物,從相鄰的兩個片段設計RT-PCR的正向和反向引物(表2),以獲得兩個相鄰片段間的序列。病人血清的RNA的提取採用病毒RNA分離試劑盒(Qiagen),逆轉錄使用cDNA合成試劑盒(Invitrogen,Carlsbad,CA,USA),擴增Platinum®使用DNA聚合酶(Invitrogen),經1.2%瓊脂糖凝膠電泳,使用DNA凝膠回收試劑盒(Qiagen)回收擴增產物,不經克隆用PCR引物直接測序,測出的序列由DNAStar軟體進行拼接。
為了確定病毒基因組3’和5’末端的序列,又進行了cDNA末端快速擴增(RACE),操作依據試劑盒說明書進行,在進行5’RACE時,每個片段RNA的擴增使用3個基因特異引物5’GSP1、5’GSP2和5’GSP3(表2),以及試劑盒提供的5’RACE接頭引物(abridged anchor primer)和通用擴增引物(AUAP);在進行3’RACE時,首先要加入腺苷酸多聚酶和ATP(New England Biolabs),37℃孵育1小時,使RNA的3’末端加上poly(A)尾,逆轉錄則使用含oligo(dT)的接頭引物AP(Invitrogen),隨後使用基因特異引物3’GSP1和3’GSP2(表2)以及試劑盒提供的通用擴增引物AUAP進行套式PCR,退火溫度為55℃,延伸時間為2分鐘,得到的擴增產物隨後進行純化、克隆、測序。
表2病毒基因組末端序列測定引物
將RACE擴增序列與SISPA獲得的序列進行拼接得到L、M、S片段基因組全長序列。經比對,發現5’末端和3’末端的序列高度保守且與白蛉病毒屬的末端序列相同,進一步表明該病毒為白蛉病毒。
為了避免克隆過程中的鹼基突變,又根據已得到的L、M、S片段的序列設計全長測序引物重新擴增,使每一個擴增子的大小在500bp左右,將擴增產物直接回收,不經克隆測序進行拼接,最終獲得HB29的全基因序列。結果為:L片段全長6368bp,編碼聚合酶為2084aa;M片段長3378bp,編碼為1073aa的糖蛋白;S片段長1744bp,有兩個方向相反的讀碼框,分別編碼核蛋白(246aa)和非結構蛋白NSs(294aa)。
利用上述測序引物,對隨後分離到的病毒進行全長測序,累計獲得包括HB29株在內的共11株病毒的基因全序列(Genbank號見表3)。這11株病毒的序列高度同源,L片段的同源性在95.9-99.8%,M片段的同源性在95.3-99.6%,S片段的同源性在95.2-99.7%。其中,HB29與SD24分離株L片段核苷酸序列(6368bp)在151(T-A),1456(A-G),1819(A-G),2911(T-C),4960(G-A),5677(A-G)等12個位點有突變,同源性為99.8%;而所對應的編碼蛋白聚合酶胺基酸序列(2084aa)在719(N-S),1750(I-V)2個位點有突變,同源性高達99.9%。M片段核苷酸序列(3378bp)在354(T-C),1171(T-A),1938(C-T),2496(C-T),2828(A-G),3341(T-C)等14個位點有突變,同源性為99.6%;而其編碼的糖蛋白胺基酸序列(1073aa)在227(V-I),385(S-T),937(N-S)3個位點有突變,同源性高達99.7%。S片段核苷酸序列(1744bp)在448(T-A),490(A-G),517(G-A),933(T-A),1154(T-C),1228(A-T)等6個位點有突變,同源性為99.6%;而其編碼的核蛋白胺基酸序列(246aa)在159(S-T)有1個突變,同源性高達99.6%;而非結構蛋白NSs(294aa)同源性為100%。
表3分離病毒全基因組序列GenBank號
表3
將病毒樣序列與包含了布尼亞病毒科的五個屬(布尼亞病毒屬、漢坦病毒屬、內羅病毒屬、白蛉病毒屬、Tospovirus病毒屬)完整基因組的資料庫相比對,該資料庫還包括了來自非人靈長類動物,如黑猩猩、獼猴的完整基因組。使用Mega4軟體的ClustalW做序列比對,繪製系統進化樹,並作bootstrap檢驗。
結果表明,以同源性高低判定病毒亞型歸屬,可以看出新病毒的三個片段均在白蛉病毒屬這一分支上,但與該屬的其他病毒距離較遠。按同樣的方法分析新病毒的胺基酸序列,也得出相同的結果。L片段編碼的胺基酸與其他的白蛉病毒的同源性為32-33%(圖2),M片段編碼的糖蛋白的同源性在20-36%(圖3),S片段編碼的NSs的同源性較低,在11.2-16.0%(圖4)。
分別比對11株病毒的L、M、S序列,界定其保守區,利用Primerexpress軟體設計分別針對三個片段的引物和Taqman探針,為防止多重PCR的各個引物之間相互干擾和各個探針之間相互干擾,兩兩分別選中所設計的多重引物或兩兩分別選中所設計的多重探針,用DNAstar軟體的Primerselect程式對其進行評價,最後選出最優組合。其中L片段的探針5’端用HEX標記,M片段的探針5’端用FAM標記,S片段的探針5’端用TexasRed標記,具體的序列及位點見表4。
表4多重Real-timePCR檢測引物探針
表4
試劑盒採用invitrogen公司的一步法定量RT-PCR檢測試劑盒,儀器使用Bio-Rad公司的CFX96實時定量PCR儀,反應體系如下:2X反應緩衝液12.5微升,將三重探針和引物放入一個反應體系,同時針對一個樣本檢測L、M、S三個基因片段,具體為:濃度為10微米的上、下游引物各1微升,各型特異性探針0.5微升,逆轉錄和鉑金Taq聚合酶0.5微升,加水至總體積25微升。反應條件為:50℃15分鐘;95℃2分鐘;95℃15s,60℃1分鐘,共40個循環。
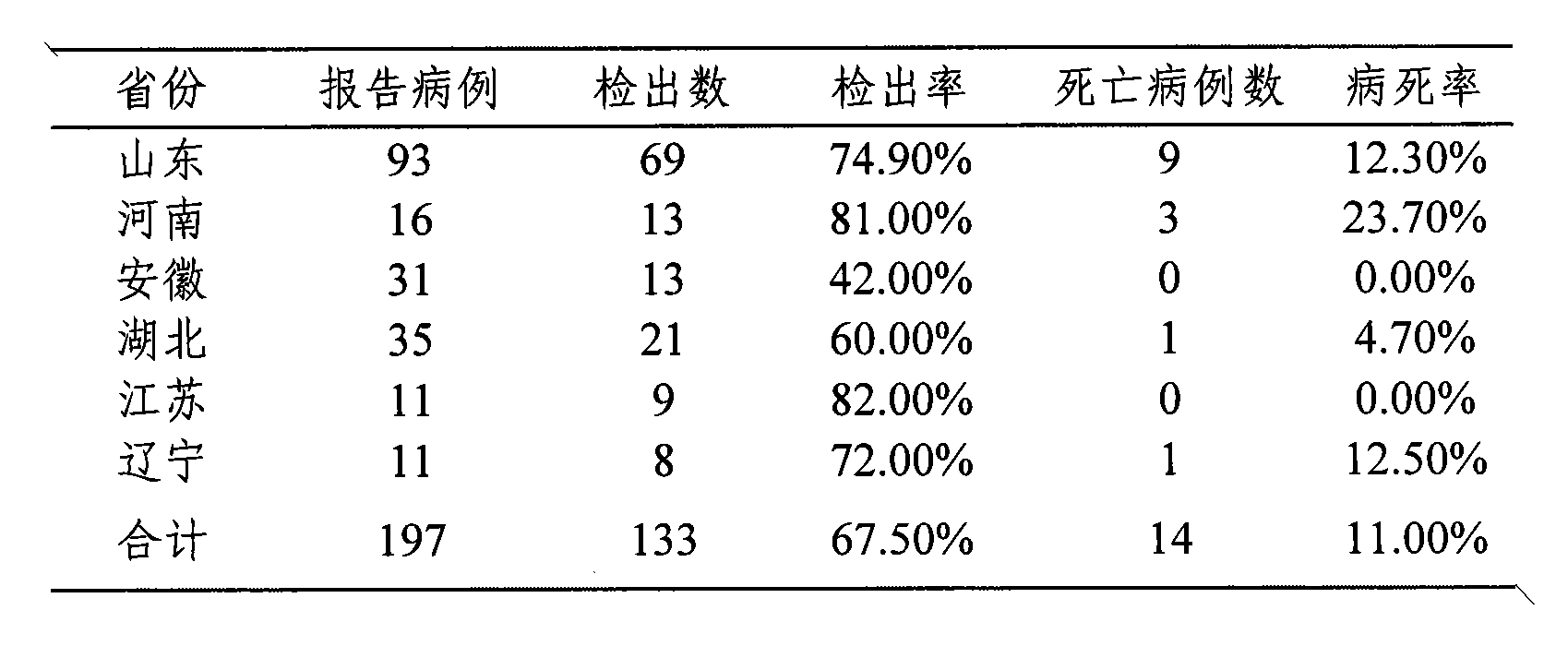
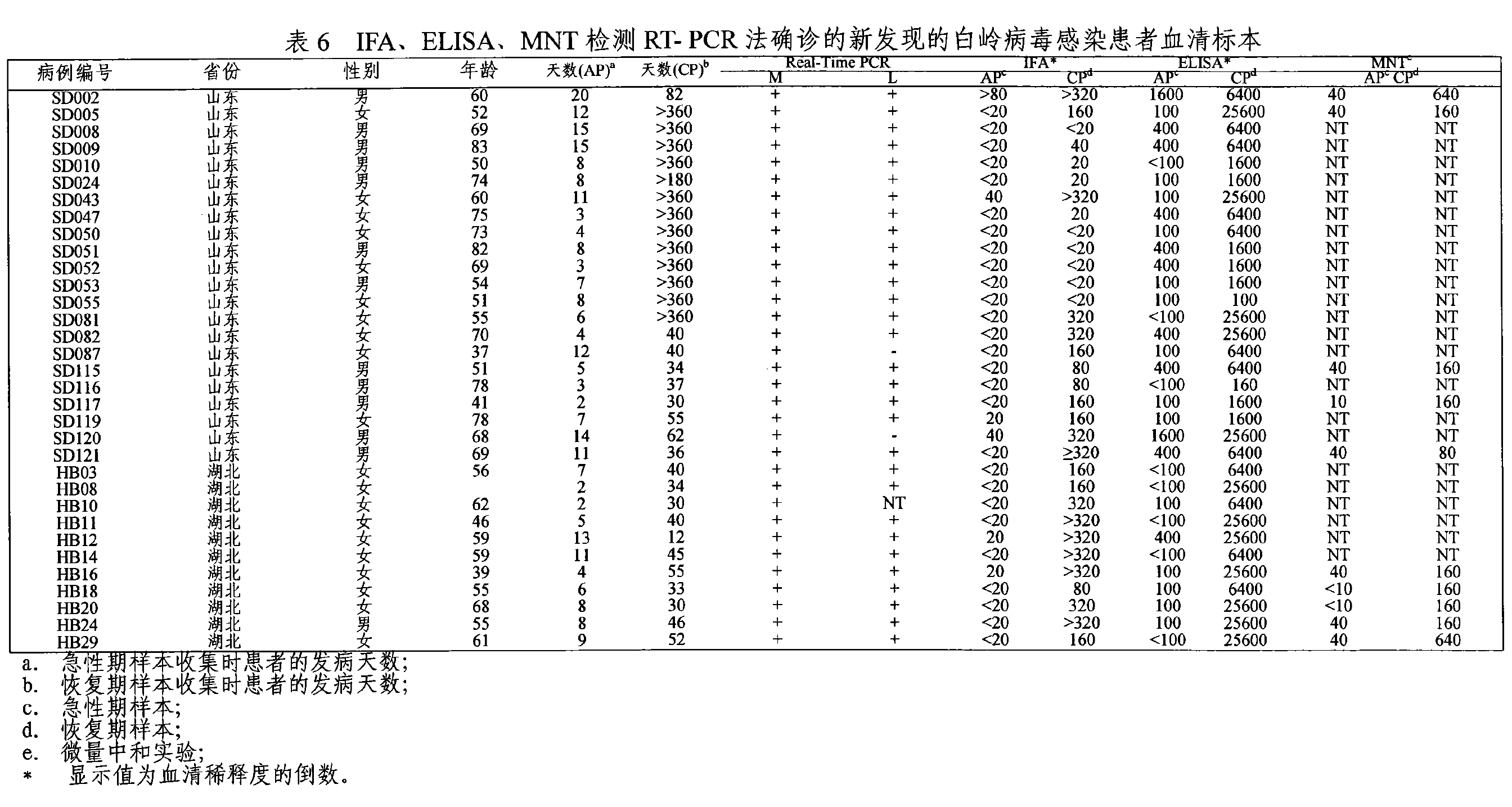
結果表明(圖5),山東、河南、安徽、河北、江蘇、遼寧六省地區的總病例數為197例,其中RT-PCR檢測陽性的為133例,陽性檢出率為67.5%(表5);通過免疫螢光IFA,酶聯免疫吸附試驗ELISA,中和試驗MNT進行病人雙份血清抗體4倍增高驗證,從而對RT-PCR法檢測陽性病例進行覆核確認(表6)。從表6所列數據表明RT-PCR法檢出的陽性病例為33份,IFA檢測病人雙份血清4倍增高的陽性病例為23份,ELISA檢測病人雙份血清4倍增高的陽性病例為31份,覆核率分別為69.7%和93.94%。
表5發熱伴血小板減少綜合症病例
PCR擴增HB29核蛋白(NP)基因即HB29-NP,所用上游引物為NP-F:5’-CGCCATATGTCGGAGTGGTCCAGGATT-3’;下游引物為NP-R:5’-ATAGTTTAGCGGCCGCCAGGTTTCTGTAAG-3’,引物兩端引入NdeI/NotI酶切位點。經NdeI及NotI雙酶切,克隆入pET30a載體,轉化大腸桿菌BL21(DE3)為宿主菌,37℃培養至OD600 值為0.7左右時按1∶1000的稀釋度加入1M/L的IPTG,30℃,180rpm過夜誘導表達,可得到分子量為約27KD的核蛋白。通過Ni柱親和層析並經過透析、復性,得到純化後的HB29-NP。ELISA檢測套用:用0.1M NaHCO3 (pH9.6)的溶液包被純化HB29-NP,包被量為5ng/微升,在96孔板中每孔加入100微升,4℃過夜;4%脫脂奶封閉,37℃1h,加入待測樣本血清,37℃1h;加入酶標抗人IgG二抗(美國Sigma,1∶2000稀釋使用),37℃1h;顯色液顯色,2MH2SO4終止反應,酶標儀檢測吸光度A值。利用核蛋白ELISA法共檢測33份病人急性期和恢復期雙份血清樣本,結果如表6所列數據表明:總樣本數33份,ELISA檢測病人雙份血清4倍增高的陽性病例為31份,急性期血清樣本可檢測到的最高稀釋度為1;25600。
分別PCR擴增HB29核蛋白基因(HB29-NP),糖蛋白基因(HB29-G),糖蛋白基因(HB29-Gc)。設計引物時,全長糖蛋白(G)和糖蛋白(Gc)的擴增引物分別為GP-F:
5’-CTAGCTAGCCACCATGATGAAAGTCATCTGGTTC-3’;GP-R:
5’-GGGGTACCCTAAGCCAGCTTCGTCCTCGATC-3’;以及G2-F:
5’-CTAGCTAGCATGGATGAGATGGTCCATGCTGATT-3’;G2-R:
5’-CCGCTCGAGCTAAGCCAGCTTCGTCCTCGAT-3’,兩端均引入NheI/KpnI酶切位點。核蛋白基因(NP)擴增引物為NP-F:
5’-CGGGGTACCCACCATGTCGGAGTGGTCCAGG-3’;NP-R:
5’-CGAGCTCCTAATGGTGATGGTGATGGTGAGAACCGCGTGGCACCAGCAGGTTTCTGTAAGC-3’,引入KpnI/SacI酶切位點。純化的擴增產物經雙酶切,將酶切後的片段回收,直接克隆到同樣經雙酶切的桿狀病毒表達載體pAcUW51中,使目的基因在多角體啟動子的控制下,獲得重組質粒。通過將重組質粒轉染昆蟲細胞製備重組桿狀病毒進行蛋白表達,表達採用美國Pharmogen公司的BaculoGold共轉染試劑盒。操作方法略述如下:將5微克的重組質粒DNA與0.5微克的BaculoGold線性DNA混合混合後,利用試劑盒中的轉染試劑轉染生長密度為50%的Sf9細胞,27℃培養4天后,收集上清作為重組病毒的毒種進行滴定和擴增,具體操作見《Baculovirusex pression vector system》。獲得的表達HB29株的核蛋白(NP),全長糖蛋白(G),糖蛋白(Gc)的重組桿狀病毒感染Sf9昆蟲細胞,4~5天后收穫感染細胞製成抗原片。利用間接免疫螢光檢測病人血清:加入待測血清,37℃溫育30分鐘,沖洗,加入FITC標記的抗人IgG抗體(美國Sigma),37℃溫育30分鐘,沖洗,晾乾,螢光顯微鏡下觀察。結果如圖6所示,HB29株的核蛋白(NP),全長糖蛋白(G),糖蛋白(Gc)重組表達的Sf9昆蟲細胞抗原片與病人血清反應均為陽性。
雖然,上文中已經用一般性說明及具體實施方案對《發熱伴血小板減少綜合徵病毒的全基因序列及套用》作了詳盡的描述,但在《發熱伴血小板減少綜合徵病毒的全基因序列及套用》基礎上,可以對之作一些修改或改進,這對該領域技術人員而言是顯而易見的。因此,在不偏離《發熱伴血小板減少綜合徵病毒的全基因序列及套用》精神的基礎上所做的這些修改或改進,均屬於《發熱伴血小板減少綜合徵病毒的全基因序列及套用》要求保護的範圍。
榮譽表彰 2018年12月20日,《發熱伴血小板減少綜合徵病毒的全基因序列及套用》獲得第二十屆中國專利獎優秀獎。