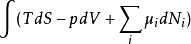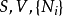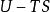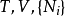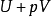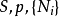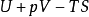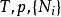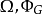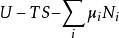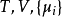熱動力勢能(英語:Thermodynamic potential)是一個來表示系統之熱動力態的標量函式。熱動力勢能的概念是皮埃爾·迪昂於1886年提出。約西亞·吉布斯在他的論文中使用了基礎函式一詞。熱動力勢能其中一種主要的物理解釋是內能U。它是守恆力系統之位形的能量(這就是為什麼它是一個勢能),只有在一套被定義出來的參考系中才具有意義。所有的熱動力勢能表示式可從U的表示式經勒讓德變換導出。在熱動力學中,某些力,如重力通常在勢能的表示式中被忽略。例如:在所有的蒸汽引擎中,工作流體在山上的重力勢能比在平地上的重力勢能更高,重力勢能項在內能的方程中通常會被省略,因為引擎的運作過程中,重力勢能的改變數是可以忽略的。
基本介紹
- 中文名:熱動力位能
- 外文名:Thermodynamic potential
描述與解釋
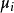
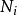
- 當一個封閉系統的熵與“外部參數”(如:體積)保持定值,在平衡時內能(U)會降低並達到最小值。這根據熱動力學第一與第二定律,也叫作最小能量原理,以下三行也是從此原理導出。
- 當一個封閉系統的溫度與外部參數保持定值,在平衡時荷姆霍茲自由能(F)會降低並達到最小值。
- 當一個封閉系統的壓力與外部參數保持定值,在平衡時焓(H)會降低並達到最小值。
- 當一個封閉系統的溫度、壓力與外部參數保持定值,在平衡時吉布斯能(G)會降低並達到最小值。
自然變數
化學反應
| 定數V | 定數p | |
|---|---|---|
| 定數S | ΔU | ΔH |
| 定數T | ΔF | ΔG |