1. 溶液的酸鹼性:溶液呈酸性、鹼性或中性,通常用指示劑來測定。 2. 溶液的酸鹼度:指溶液酸鹼性的強弱程度,即酸鹼度是定量表示溶液酸鹼性強弱的一種方法.溶液的酸鹼度通常用pH表示。
基本介紹
- 中文名:溶液的酸鹼性與pH值
- 英文名:溶液的酸鹼性與pH值
- 別稱:溶液的酸鹼性與pH值
- 3. pH的範圍:0—14
溶液酸鹼度和pH值的關係
溶液的pH值 | 溶液的酸鹼度 |
<7 | 酸性溶液(pH越小,酸性越強) |
=7 | 中性溶液 |
>7 | 鹼性溶液(pH越大,鹼性越大) |
- (1)呈酸性的溶液不一定是酸溶液,如NaHSO4溶液呈酸性,但屬於鹽溶液;呈鹼性的溶液不一定是鹼溶液,如Na2CO3溶液呈鹼性,但它也是鹽溶液。
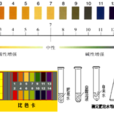
(2)粗略測定溶液的酸鹼度常用pH試紙。 - pH的測定方法:
測定溶液pH通常用pH試紙和pH計。其中用pH試紙測定溶液pH的具體操作為:測定時,將pH試紙放在表面皿上,用乾淨的玻璃棒蘸取被測溶液並滴在pH試紙上,半分鐘後把試紙顯示的顏色與標準比色卡對照,讀出溶液的pH,簡記為:“一放、二蘸、三滴、四比”。
改變溶液pH的方法:
溶液的pH實質是溶液中H濃度或OH濃度大小的外在表現。改變溶液中H濃度或OH濃度,溶液的pH就會發生改變。
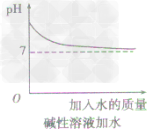
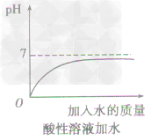
方法一加水:只能改變溶液的酸鹼度,不能改變溶液的酸鹼性,即溶液的pH只能無限地接近於7。
①向酸性溶液中加水,pH由小變大並接近7,但不會等於7,更不會大於7(如下圖所示)。
②向鹼性溶液中加水,pH由大變小並接近於7,但不會等於7,更不會小於7(如下圖所示)。
方法二加酸鹼性相同,pH不同的溶液:原溶液酸鹼性不會發生變化,但混合後溶液的pH介於兩種溶液之間:
方法三加酸鹼性相反的溶液:混合後發生中和反應,溶液的pH可能等於7,若加入的溶液過量,原溶液的酸鹼性就會與原來相反(如下圖所示)。 - pH值測定時的注意事項:
①不能直接把pH試紙浸入待測的溶液中,以免帶入雜質,同時還可能溶解pH試紙上的一部分指示劑,致使比色時產生較大誤差。
②不能先用水將pH試紙潤濕再進行測定。因為將待測溶液滴到用水潤濕後的pH試紙上,其溶質質量分數將變小。
③用pH試紙測得溶液的pH一般為整數。 - 了解溶液的酸鹼度的重要意義:
①化工生產中許多反應必須在一定pH溶液里才能進行;
②在農業生產中.農作物一般適宜在pH為7或接近於7的土壤中生長;
③測定雨水的pH(因溶解有二氧化碳,正常雨水的pH約為5.6,酸雨的pH小於5.6),可以了解空氣的污染情況;
④測定人體內或排出的液體的pH,可以了解人體的健康狀況。
身邊一些物質的pH: