物化性質
Sr屬於
鹼土金屬,氫氧化鍶在水中的溶解度介於氫氧化鈣和氫氧化鋇之間。儘管它的溶解度雖然不大,但是屬於強鹼,具有鹼的通性,溶於水完全電離,具有腐蝕性,鹼性介於氫氧化鈣和氫氧化鋇之間。工業和實驗室常用鍶的可溶鹽(
氯化鍶、
硝酸鍶等)和較濃的氫氧化鈉溶液常溫下作用,即可析出八水氫氧化鍶的無色晶體。
化學反應
1、和
指示劑的反應:紫色石蕊遇到氫氧化鍶溶液變藍,無色
酚酞試液則變紅。
2、和非金屬氧化物的反應:生成鍶鹽和水
Sr(OH)2+SO2=SrSO3↓+H2O
Sr(OH)2+2SO2=Sr(HSO3)2
Sr(OH)2+CO2=SrCO3↓+H2O
Sr(OH)2+2CO2=Sr(HCO3)2
3Sr(OH)2+P2O5=Sr3(PO4)2↓+3H2O
3、和酸的反應:生成鍶鹽和水
Sr(OH)2+2HCl=SrCl2+2H2O
Sr(OH)2+H2SO4=SrSO4↓+2H2O
Sr(OH)2+2HNO3=Sr(NO3)2+H2O
Sr(OH)2+2H3PO4=Sr(H2PO4)2+2H2O
Sr(OH)2+H3PO4=SrHPO4↓+2H2O
3Sr(OH)2+2H3PO4=Sr3(PO4)2↓+6H2O
Sr(OH)2+2HF=SrF2↓+2H2O
Sr(OH)2+2CH3COOH=(CH3COO)2Sr+2H2O
4、和兩性金屬(或其氧化物,氫氧化物)的反應:生成偏鋁酸鍶
2Al+Sr(OH)2+2H2O=Sr(AlO2)2↓+3H2↑
5、和可溶性某些弱鹼鹽的反應:生成鍶鹽和弱鹼
Sr(OH)2+2NH4Cl=SrCl2+2NH3.H2O
Sr(OH)2+MgCl2=SrCl2+Mg(OH)2↓
Sr(OH)2+CuSO4=SrSO4↓+Cu(OH)2↓
6、和酸式鹽的反應:生成鍶鹽和正鹽
Sr(OH)2+NaHCO3=SrCO3↓+NaOH+H2O
Sr(OH)2+2NaHCO3=SrCO3↓+Na2CO3+2H2O
套用
1、氫氧化鍶在歐洲廣泛用於
甜菜糖的精煉加工,它先生成不溶性的雙糖鹽,經過分離、精煉後,在通入
二氧化碳時,又把糖釋出,同時生成難溶的
碳酸鍶;
3、可用於改進幹性油和油漆的乾燥性;
4、用於製取鍶潤滑蠟和各種鍶鹽等。
合成方法
將純淨的
氧化鍶用理論量的水潤濕,即引起激烈反應,放出熱量而生成白色粉末狀的氫氧化鍶。再加水則生成氫氧化鍶的一水合物、七水合物和八水合物。八水合氫氧化鍶難溶。也可由一種可溶性鍶鹽加
強鹼而製得。加熱至100℃轉變為無水物。溶解度比
氫氧化鈣大,尤其在高溫下。無水氫氧化鍶是無色粉末,相對密度3.62。吸濕性強。加熱至701℃轉變為SrO。在100g水中的溶解度0.8g(20℃),17.4g(40℃),21.8g(100℃)。在空氣中吸收CO2轉變成碳酸鹽。
安全信息
危險運輸編碼:UN 3262 8/PG 2
安全標識:S26S27S45S36/S37/S39
S26:不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S27:一旦衣物受到污染,請立即脫去。
S37:戴適當手套。
危險標識:R34
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:2
3、氫鍵受體數量:2
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:2
7、重原子數量:3
8、表面電荷:0
9、複雜度:0
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:3
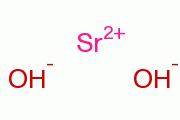 氫氧化鍶
氫氧化鍶
