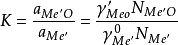介紹
氧化精煉(oxidizing refining)是基於金屬元素對氧的化學親和力大小的不同這一原理, 用氧或空氣或被精煉的主體金屬的氧化物,將粗金屬中的雜質氧化生成不溶 於主體金屬的氧化物以渣形式聚集於熔體表面或以氣態形式(如雜質S)得以 分離的精煉過程。凡是對氧的化學親和力大於主體金屬對氧的化學親和力的 雜質金屬,都可用氧化精煉法去除。該法已廣泛用於銅、鉛、錫、金、銀、鐵等金 屬的精煉。
氧化精煉原理
利用氧或氧化劑將粗金屬中的雜質氧化造渣或氧化揮發除去的火法精煉方法。粗金屬的氧化精煉是以某些雜質元素對氧的化學親和勢大於主金屬對氧的親和勢為依據的。精煉過程的效果以及精煉除去雜質的限度不僅與主金屬和雜質元素的氧化物標準生成吉布斯自由能變化(△G) 有關,而且還取決於雜質和氧化物的活度。
在精煉過程中當將氧引入粗金屬熔體中之後,由於氧分子與主金屬原子接觸的幾率比與雜質原子接觸的幾率多得多,所以主金屬會首先氧化形成氧化物,然後將其本身的氧轉給熔體中的雜質 (如金屬雜質Me'),並建立平衡:
[MeO]+[Me']=[Me]+(Me'O)(1)
平衡體系由一個金屬合金(粗金屬)液相和一個或幾個氧化物凝聚相組成。如果過程產生氣體,則還增加一個氣相組成。在式(1)中,可以認為aM
e=1,並且在氧化精煉過程中熔融金屬始終被MeO所飽和,即aMeO可視為一常數。在此情況下,方程式 (1) 可簡化為:
式中K為反應平衡常數,a為活度,γ為活度係數,N為摩爾分數。由式(2)可見,要獲得除去雜質的良好效果,即式(2)中的NMe′要小,則γ′Me′o和NMe′o的值也要小,而γe′和K值能儘可能大。精煉時,雜質氧化形成的氧化物與加入的熔劑反應生成精煉渣並從爐內排出以及以氣態隨爐氣排走,都可使NMe′O和γMeO值減小。
根據雜質氧化反應K值(或△Gθ值)的大小,可將雜質分為三類。第一類是具有小K值的雜質,這類雜質不可能用氧化精煉法除去;第二類是K值大的雜質,這是氧化精煉容易除去的雜質;第三類是具有中等大小K值的雜質,這類雜質很難在氧化精煉時除去,應該儘可能在其他冶煉過程中除去它們。
通過對物質的△Gθ的計算也能得到相同的結論。即氧化物標準生成吉布斯自由能變化負值最大的雜質首先被氧化除去,而氧化物標準生成吉布斯自由能負值最小的雜質則在最後才開始氧化除去。隨著氧化精煉過程的進行,各種雜質濃度都不斷下降,它們的氧化反應的吉布斯自由能變化△G也相應增大,以致最後達到與主金屬氧化物的標準生成吉布斯自由能變化△GMeO(飽)相等時,雜質便不再被氧化,其濃度也不再下降,此時便是氧化精煉主金屬中雜質最終濃度的極限。
雜誌氧化精煉方式
雜質的氧化可能有三種途徑:(1)雜質直接與空氣中的氧在熔體表 面上進行氧化作用;(2)雜質與鼓入熔體內的空氣或氧進行氧化作用;(3)主體 金屬與氧先化合生成氧化物,反應生成的金屬氧化物再與雜質發生氧化作用。 雜質氧化物在粗金屬中的溶解度一般是很低的,故呈獨立相或進入渣相而達 去除的目的。第(3)種氧化精煉的途徑是主要的。
套用
氧化精煉在有色金屬火法冶金中套用較廣,如粗銅氧化精煉除鉛、鐵、鋅、鈷、錫、硫和部分的砷、銻、鎳,粗鉛氧化精煉除砷、銻、錫、鋅等。氧化過程為放熱反應。