對於組成不變的均相封閉體系,不考慮非膨脹功,設體系吸熱Q,溫度從T1升高到T2,則恆容熱容:Cv=δQv/dT=(∂U/∂T)v。
基本介紹
- 中文名:恆容熱容
- 外文名:Constant capacity heat capacity
- 領域:熱力學
- 公式:Cv=δQ/dT
- 相關名詞:恆壓熱容
簡介


恆容熱容和恆壓熱容
定義
分類




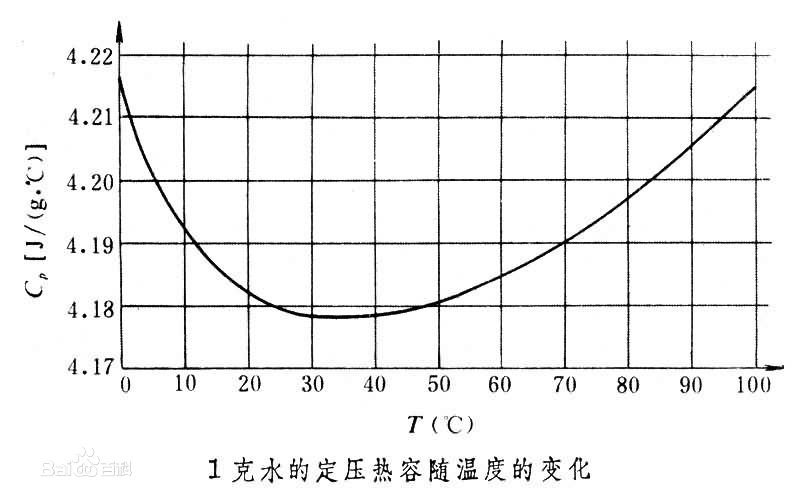



熱容與溫度的關係


性質









對於組成不變的均相封閉體系,不考慮非膨脹功,設體系吸熱Q,溫度從T1升高到T2,則恆容熱容:Cv=δQv/dT=(∂U/∂T)v。





















對於組成不變的均相封閉體系,不考慮非膨脹功,設體系吸熱Q,溫度從T1升高到T2,則恆容熱容:Cv=δQv/dT=(∂U/∂T)v。簡介對於組成不變的均相封閉體系,不考慮非膨脹功,設體系吸熱Q,溫度從T1升高到T2,則恆容...
在不做非體積功的情況下,封閉體系的恆容過程δQ=dU。由此可見,在無化學變化和相變且不做非體積功的過程中,恆容熱容又等於封閉系統的熱力學能隨溫度的變化率。從上式可得 dU=CdT=nCdT 利用上式可以計算封閉系統無化學變化和相變且不做非體積功的過程中的熱力學能變。若恆容熱容與溫度無關,則 ΔU=C(T...
恆容恆壓熱容 定義 熱容的標準定義是:“當一系統由於加給一微小的熱量δQ而溫度升高dT時,δQ/dT 這個量即是該系統的熱容。”(GB3102.4-93),通常以符號C表示,單位J/K。作為某種物質的物理性質之一,該物質的比熱容是指當單位質量該物質吸收或放出熱量引起溫度升高或降低時,溫度每升高1K所吸收的熱量或...
容積熱容量::單位體積的物質,溫度變化 1℃所需吸收或放出的熱量。單位:也稱體積比熱容( ),可以表示為密度與比熱的乘積。發展歷史 早在1818年,Dulong和Petit曾預言固體物質密度和比熱容()的乘積對於所有固體都是恆定的。這就意味著固體中容積熱容量的是一個常量。而後在1819年,他們發現容積熱容量並不完全...
食品比熱容(Cp)是單位質量的食品溫度每升高一度所需的熱量。 比熱的單位為kJ/kg℃。公式 引入比熱後,可用下面的方程計算質量為M的食品溫度從T₁升至T₂時所需的熱量Q:Q=MCₚ(T₂-T₁)其中Cₚ為恆壓下的比熱,它套用於幾乎所有食品加熱和製冷加工上只有帶有氣體的食品計算時需要區別Cₚ和恆...
溶液的熱容表示溫度改變時該溶液與環境交換的熱量。影響溶液熱容的因素有壓力、體積、溶質和溶劑的本質和溶液的濃度。二元溶液的熱容表示如下:式中n1、n2為兩組分的摩爾數;婔V1,婔V2和婔p1,婔p2分別表示兩組分在恆容和恆壓條件下的偏摩爾熱容,定義為: 溶液的熱容和比熱容可利用絕熱式的量熱器或比熱容型的...
等壓熱容與等容熱容的關係 已知:Cₚ——等壓熱容;H——系統的焓;U——系統的內能。利用熱力學第一定律推導等壓熱容和等比熱容的關係,根據定義 所以 假定U=f(T,V),對U全微分得 因為在實際中經常所需要的是 ,所以對T求導並規定恆壓這一條件,得 進行聯立,可得 在上述推導過程中,沒有引...
當計算要求較高的時候,就不能把比熱容看作是一個定值,而是與溫度有關的一個函式,此時稱之為變比熱容。理想氣體變比熱容計算 實驗表明,理想氣體的比熱容是室溫度的複雜函式,隨著溫度的升高而增大。圖1給出了幾種氣體摩爾熱容與溫度的關係。通常c可表達為 固體材料的比熱容隨溫度變化的規律 固體材料比熱...
比熱容(Specific Heat Capacity),用符號c表示,又稱比熱容量,簡稱比熱(specific heat),是單位質量物質的熱容量,即單位質量物體改變單位溫度時吸收或放出的熱量。利用比熱容的概念可以類推出表示1mol物質升高1K所需的熱量的摩爾熱容。而在等壓條件下的摩爾熱容Cₚ稱為定壓摩爾熱容。在等容條件下的摩爾熱容C...
摩爾定壓熱容與溫度函式的關係,通常可以表示成如下的經驗公式: ; ; ;式中a,b,c,c',d均為係數,具有不同的單位。使用這些公式時要注意所適用的溫度範圍。(詳見《物理化學上冊》附表)套用 單純pVT變化過程H的計算 由C的定義可知,利用C可計算物質的量為n的系統發生恆壓的單純pVT變化過程的Qₚ及該過程...
12、恆容熱容C: 一定量氣體,當體積保持不變,在沒有化學反應和相變的條件下,溫度改變1開爾文所吸收或放出的熱量,叫做恆容熱容。13、穩態導熱:物體內的溫度分布不隨時間而變化的導熱過程 14、非穩態導熱: 物體內的溫度分布隨時間而變化的導熱過程。熱自燃理論 1、熱自燃理論的基本出發點:體系能否著火取決於...
Rüchardt實驗是測定理想氣體絕熱指數(即理想氣體恆壓熱容與恆容熱容之比)的一個著名實驗。該實驗最早由Eduard Rüchardt (March 29, 1888 – March 7, 1962)引入,通過測定絕熱氣缸上活塞的微振動周期,從而得出絕熱指數的數值。絕熱指數 絕熱指數(英語:adiabatic index)是指等壓熱容()和等容(等體積)熱容...
格律乃僧定律 格律乃森定律(Grüneisen law)是一個物理學定律,格律乃森從晶格振動的理論推導出材料體積膨脹係數與熱容間的關係式。格律乃森定律(Grüneisen law):物體的熱膨脹係數與恆容熱容成正比,並且它們有相似的溫度依賴關係,在低溫下隨溫度升高急劇增大,而到高溫則趨於平緩,這一規律稱為格律乃森定律。
例如,恆壓熱容Cₚ與恆容熱容C之差等於,其中兩個偏導數就可由狀態方程式來求得。(1)理想氣體的狀態方程:物質在平衡狀態下p-V-T關係的數學方程。當壓力足夠低時,各種氣體的p-V-T關係存在簡單的規律。1661年,英國化學和物理學家R.玻意耳根據實驗得出結論:在恆溫下,一定量氣體的體積與壓力成反比。這...
2.5 恆容熱、恆壓熱及焓 2.5.1 恆容熱與熱力學能 2.5.2 恆壓熱與焓 2.6 熱容 2.6.1 熱容的定義 2.6.2 恆容熱容與恆壓熱容 2.6.3 CPm與Cvm的關係 2.6.4 理想氣體的熱容 2.6.5 Cpm與溫度的關係 2.7 熱力學第一定律對理想氣體的套用 2.7.1 焦耳實驗 2.7.2 熱力...
1.6.1 熱容 1.6.2 恆壓熱容與恆容熱容 1.6.3 Cp,m與Cv,m的關係 1.6.4 Cp,m、Cv,m與溫度的關係 1.7 理想氣體的熱力學性質 1.7.1 Joule實驗 1.7.2 理想氣體的內能與焓 1.7.3 理想氣體的Cp,m與Cv,m 1.8 理想氣體的絕熱過程 1.8.1 理想氣體的絕熱可逆過程 1.8.2 理想氣體的...
13熱容量、關於熱的計算19 131熱平衡原理19 132熱容量的定義19 133恆容熱容(CV)和恆壓 熱容(Cp)19 134Cp與CV的關係20 135相變熱21 14熱力學第一定律對理想氣體的套用23 141理想氣體的內能和焓23 142理想氣體的絕熱過程24 143絕熱可逆過程與恆溫可逆...
溫-熵圖的優點:1) 既顯示體系所作的功,又顯示體系所吸取或釋放的熱量。圖只能顯示所作的功。(2) 既可用於等溫過程,也可用於變溫過程來計算體系可逆過程的熱效應;而根據熱容計算熱效應不適用於等溫過程。T-S圖對於恆溫或恆熵過程是十分方便的,因為這兩個過程在圖上都以直線表示。lnP-H 圖 lnP-H...
2.4恆容熱、恆壓熱、熱容 2.4.1恆容熱 2.4.2恆壓熱 2.4.3熱容 2.5熱力學第一定律對理想氣體的套用 2.5.1理想氣體的內能和焓——焦耳實驗 2.5.2理想氣體的定溫過程 2.5.3理想氣體的絕熱過程 2.5.4*真實氣體的節流膨脹與焦耳湯姆森效應 2.6熱化學 2.6.1化學反應進度與摩爾反應進度 2.6.2...
1.3 恆容熱、恆壓熱和焓 1.3.1 恆容熱 1.3.2 恆壓熱 1.3.3 Qₚ與Q的關係 1.3.4 熱力學標準狀態 1.3.5 熱容 1.4 標準生成焓和標準燃燒焓 1.4.1 熱化學方程式 1.4.2 蓋斯定律 1.4.3 標準摩爾生成焓 1.4.4 標準摩爾燃燒焓 1.5 生命運動中的能量代謝 習題 第2章 化學反應的方向...
經過長期實踐,已發現現有各種簡易量熱計存在如下問題:(1)攪拌過程中容易碰破量熱計內壁或溫度計;(2)手動攪拌不充分、不均勻,反應時間長,由此帶來實驗誤差大;(3)燒杯夾泡沫塑膠型量熱計,在清洗過程中夾層容易進水,熱容變化進而導致較大實驗誤差。反覆探索實踐的基礎上,研製出了使反應系統內的液體產生沖刷力...
量熱法是測量各種過程中所涉及的熱量和熱容量(例如,化學反應熱、相變潛熱等)的方法。實際測量中,大多數情況是測量系統吸收熱量後溫度的變化。常溫下的測量用等溫量熱計或非等溫量熱計。測量溫度不同的物體相互接觸時吸收或放出的熱量,用非等溫量熱計量出其溫度變化的數值。研究對象 直接測定恆容過程熱效應Q(...
isobarically,英語單詞,主要用作副詞,作副詞時譯為“恆壓的”。短語搭配 isobarically control 恆壓力控制 isobarically discharge 恆壓放電 supply isobarically water 恆壓供水 Isobarically Water Supply 恆壓供水 isobarically thermal capacity 恆壓熱容 單詞釋義 恆壓的 ...isobaric表示等壓的isobarically恆壓的...
§2.3 恆容熱、恆壓熱及焓 1. 恆容熱(QV)2. 恆壓熱(Qp)及焓 3. QV=ΔU與Qp=ΔH關係式的意義 §2.4 摩爾熱容 1. 摩爾定容熱容(CV,m)2. 摩爾定壓熱容(Cp,m)3. Cp,m與CV,m的關係 4. Cp,m(CV,m)隨T的變化 5. 平均摩爾熱容 §2.5 相變焓 1. 摩爾相變焓 2. 摩爾相變焓隨溫度的...
2.5摩爾熱容30 2.5.1摩爾恆容熱容30 2.5.2摩爾恆壓熱容31 2.5.3摩爾恆壓熱容與摩爾恆容熱容的關係32 2.5.4摩爾恆壓熱容與溫度的關係34 2.5.5平均摩爾熱容34 2.6可逆過程與可逆體積功34 2.6.1可逆過程34 2.6.2可逆體積功37 2.7相變焓40 2.7.1相變40 2.7.2摩爾相變焓40 2.7.3摩爾相變...
第五節 焓與熱容 一、恆容熱 二、恆壓熱 三、熱容 第六節 熱力學第一定律在理想氣體的套用 一、理想氣體的內能與焓 二、理想氣體的Cp,m與Cv,m的關係 三、理想氣體的絕熱過程 第七節 熱化學 一、化學反應的熱效應 二、反應進度 三、摩爾內能變與摩爾焓變 四、熱化學方程式 五、蓋斯定律 第八節 熱效應...
2.1.1 恆容過程 2.1.2 恆壓過程 2.2 熱容 2.3 摩爾相對焓 2.4 摩爾焓 2.5 化學反應的熱效應 2.5.1 恆溫恆壓反應熱與恆溫恆容反應熱之間的關係 2.5.2 標準反應熱與標準生成熱 2.5.3 溫度對標準反應熱的影響——基爾戈夫方程式 2.5.4 幾個問題的討論 2.5.5 基爾戈夫方程式的用途 2.6 ...
第三節恆容熱、恆壓熱、焓25 1恆容熱25 2恆壓熱25 3焓26 第四節熱容26 1熱容26 2 Cp與CV的關係27 第五節可逆過程28 1準靜態過程28 2可逆過程30 第六節熱力學第一定律對理想氣體的套用31 1焦耳實驗31 2理想氣體的熱力學能31 3理想氣體的焓32 4理想氣體恆溫可逆過程33 5...
四、恆容熱,恆壓熱,焓 五、熱容 第四節 熱化學 一、反應熱效應 二、蓋斯定律 三、生成熱和離子生成熱 四、反應熱與溫度關係——基爾霍夫公式 第五節 熱力學第二定律 一、自發過程的不可逆性 二、熵和熱力學第二定律 三、過程方舟的判據——熵增加原理 四、物理變化中熵變的計算 五、化學變化中熵變的...
