基本介紹
- 中文名:小角張力
- 所屬學科:有機化學
- 涉及理論:價鍵理論
用共價鍵理論解釋小角張力,環丙烷與環丁烷的穩定性低的原因,
用共價鍵理論解釋小角張力
要形成化學鍵,兩個原子必須處於原子軌道能發生交疊的位置才能成鍵;原子軌道的交迭越大,所形成的鍵越強。當碳與四個原予結合時,它的成鍵軌道(sp3軌道)指向四面體的四個頂點;任何兩個軌道間的夾角都是109.5°;當兩個碳原子用sp3軌道互相交迭時,以各原子的sp3軌道彼此正面相對的位置交疊最有效,形成的鍵也最強;這意味著碳與另外兩個碳原子連線時,碳一碳鍵角應該是109.5°。然而,環丙烷分子中的碳一碳鍵角只有60°。從量子化學觀點看,沿鍵軸方向重迭產生的碳一碳鍵角不可能小於90°(純p),且混入s軌道后角度還要變大。顯然,碳原子的sp3軌道不能處於彼此正面相對的位置,軌道交蓋較少,生成的鍵也比一般的碳一碳鍵弱(見圖1);為了既要儘可能沿軸鍵方向交蓋(壓縮鍵角),又要儘可能不致於太大壓縮(即不沿正常鍵軸交蓋),只有二者進行協調,結果是形成了彎曲的碳一碳鍵。 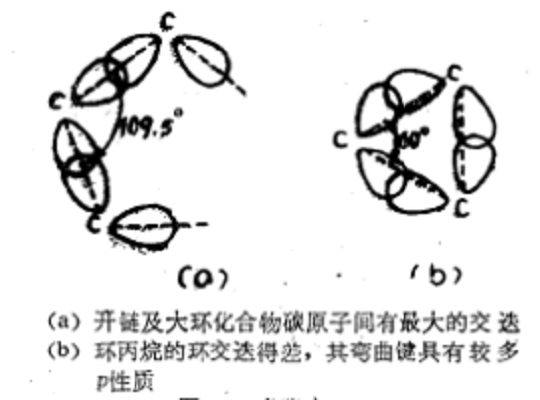 圖1 角張力
圖1 角張力
 圖1 角張力
圖1 角張力環丙烷與環丁烷的穩定性低的原因
由形成碳——碳鍵的原子軌道交迭程度差而產生了角張力。