基本介紹
- 中文名:壓縮因子
- 外文名:compressibility factor
- 符號:Z
- 套用學科 :化學、物理
- 套用領域:實際氣體
- 別名:壓縮係數
定義,性質,套用,臨界壓縮因子,對比參數,圖形,
定義
由於理想氣體作了兩個近似:忽略氣體分子本身的體積和分子間的相互作用力,所以實際氣體都會偏離理想氣體。偏離的程度取決於氣體本身的性質以及溫度、壓強等因素。一般而言,沸點低的氣體在較高溫度和較低壓強時偏差較小,反之偏差較大。
壓縮因子Z被引用來修正理想氣體狀態方程: 。
。

壓縮因子的定義式為: ,壓縮因子的量綱為一。
,壓縮因子的量綱為一。

很顯然,Z的大小反映出真實氣體對理想氣體的偏差程度,即Z等Vm(真實)除以Vm(理想)。由於Z反映出真實氣體壓縮的難易程度,所以將它稱為壓縮因子。
可以看出,Z是同樣條件下真實氣體摩爾體積與理想氣體摩爾體積的比值,它的大小反映出真實氣體偏離理想氣體的程度。理想氣體的Z值在任何條件下恆為1。Z小於1說明真實氣體的摩爾體積比同樣條件下理想氣體的為小,真實氣體比理想氣體更易壓縮。Z大於1則相反。由於它反映出真實氣體的壓縮難易程度,所以稱為壓縮因子。壓縮因子的量綱為一。
性質
對於理想氣體,在任何溫度壓力下,Z=1。

當Z<1時,說明真實氣體的Vm比同樣條件下理想氣體的Vm小,此時真實氣體比理想氣體易於壓縮,這是因為實際分子內聚力使得氣體分子對氣壁碰撞產生的壓強減小,所以實測的壓強比理想狀態的壓強要小些,p測<p理想。
當Z>1時,說明真實氣體的Vm比同樣條件下理想氣體的Vm大,此時真實氣體比理想氣體難於壓縮,這是因為分子占有一定的空間體積,實測的體積總是大於理想氣體的體積,V測>V理想
兩種相反的因素相互制約,Z的大小關鍵看哪一個因素占主導。
用壓縮因子表示的維里方程如下:
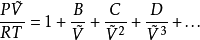
對p取導數可以看到,真實氣體的 圖在
圖在 時的斜率並不為1,而是趨於一個維里係數值。但對於理想氣體
時的斜率並不為1,而是趨於一個維里係數值。但對於理想氣體 (因為所有壓力下Z均=1)。維里係數是溫度的函式;在壓力低或摩爾體積大的情況下,使
(因為所有壓力下Z均=1)。維里係數是溫度的函式;在壓力低或摩爾體積大的情況下,使 在
在 時為0的溫度,稱為波義耳溫度。
時為0的溫度,稱為波義耳溫度。
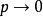



此外可以類似地使用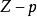 等溫線代替
等溫線代替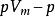 等溫線,反映出真實氣體對理想情況的偏差隨壓力的變化。所有氣體在
等溫線,反映出真實氣體對理想情況的偏差隨壓力的變化。所有氣體在 時均趨近理想氣體,所以任何
時均趨近理想氣體,所以任何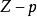 等溫線在
等溫線在 時均趨於Z=1。
時均趨於Z=1。
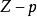
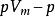

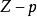

將壓縮因子的概念套用於臨界點,可以類似地得到“臨界壓縮因子”:
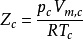
套用
雖然壓縮因子Z表示得是真實氣體行為偏離理想狀態的程度,但由於理想狀態是不存在的,便無實際具體的實驗數據,因而難以從壓縮因子Z的物理意義上直接求出其數值。
臨界壓縮因子
後實驗發現,各個氣體在臨界狀態時偏離理想氣體的程度大致相同。當實際氣體處於臨界點(臨界氣壓Pc,臨界溫度Tc,臨界摩爾體積Vm,c)時,定義此時的壓縮因子稱為臨界壓縮因子ZC,將方程改寫為 ,測得多數氣體的臨界壓縮因子比較接近,0.25-0.31之間。臨界態是真實的,所以臨界參數均可測,可求的Zc也相應列表可查。
,測得多數氣體的臨界壓縮因子比較接近,0.25-0.31之間。臨界態是真實的,所以臨界參數均可測,可求的Zc也相應列表可查。

對比參數
為求出其數值Z,找出Z的普遍性規律,科學家思考:為避免氣體分子性質的不同而導致壓縮因子Z的不同,能否導出一個不具有氣體特性常數的方程呢?
隨後即引入對比氣壓Pr,對比溫度Tr,對比摩爾體積Vm,r,統稱為對比參數。其定義式為: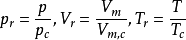 ,這三個對比參數描述了氣體所處狀態與臨界狀態的偏離程度,而與氣體的本質無關。將
,這三個對比參數描述了氣體所處狀態與臨界狀態的偏離程度,而與氣體的本質無關。將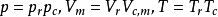 帶入方程改寫為
帶入方程改寫為 。
。
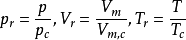
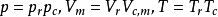

上面的方程式中右方第一項的臨界壓縮因子Zc數值波動不大,可看作一個常數;而右方第二項三個參數可以根據對比態原理(不同物質如果具有相同的對比壓力pr和對比溫度Tr,那么對比體積也相同)表示成兩個參數的函式式,下面根據這兩個參數得出的最為常見壓縮因子圖。
圖形
普遍化壓縮因子圖
荷根(Hougen)和華特生(Watson)測定了許多氣體有機物質和無機物質壓縮因子隨對比溫度Tr和對比壓力Pr變化的關係,繪製成曲線,所得關係圖稱為"普遍化壓縮因子圖"。見右圖。當實際氣體的臨界壓力pc和臨界溫度Tc的數據為已知,可將某態下的壓力p和溫度T換算成相應的對比壓力pr和對比溫度Tr,從圖中找出該對比態下的壓縮因子Z。再由下式計算氣體的摩爾體積Vm。
 壓縮因子圖
壓縮因子圖
