基本信息
多能
幹細胞(Pluripotent stem cell,Ps)是當前
幹細胞研究的熱點和焦點。它可以
分化成體內所有的細胞,進而形成身體的所有組織和器官。因此,多能幹細胞的研究不僅具有重要的理論意義,而且在器官再生、修復和疾病治療方面極具套用價值。但是過去認為多能
幹細胞只能從人
胚胎中獲得。
多能幹細胞(pluripotent stem cell),具有分化出多種
細胞組織的潛能,但失去了
發育成完整個體的
能力,
發育潛能受到一定的限制。骨髓多能造血幹細胞是典型的例子,它可分化出至少十二種
血細胞,但不能分化出
造血系統以外的其它細胞。 2009年6月3日中國科學家
肖磊領導的科研小組首次從豬的體細胞中培育出多能
幹細胞,這也是世界上首次提取出家養
有蹄類動物的多能幹細胞。
2007年,美國和日本科學家發現,套用人和鼠的正常皮膚細胞,導入KLF4、OCT4、SOX2和C-MYC四種基因,即可由正常體細胞轉化成多能幹細胞。這種基因誘導而產生的多能幹細胞稱為
誘導多能幹細胞(iPs)。除了皮膚細胞,像其他APSC多能細胞實驗室等其他體細胞也可以產生iPs。套用iPs已經成功培養和
分化出心肌、神經、胰腺、骨等多種體細胞和不同的組織。但是,過去誘導多能幹細胞必須套用
逆轉錄病毒載體才能進行
基因組整合。由於基因組整合的
隨機性,可發生突變,甚至可以引起癌症和
遺傳疾病。哈佛
幹細胞研究中心和麻省醫院腫瘤中心的科學家,成功套用無害基因組整合病毒載體(重組
腺病毒載體),進行以上四種
基因轉移,成功地將
成纖維細胞和肝
細胞分化成多能幹細胞,成為Adeno-iPs,將幹細胞的實際套用又大大向前推進了一步。多能幹細胞研究和套用將會成為21世紀最偉大的醫學生物學成就之一。
實際上,真正意義上的哺乳動物全能幹細胞只有受精卵和卵裂早期細胞。它們不僅可以分化產生三胚層中各類型細胞,還能發育成胎盤組織,最終產生子代個體。多能幹細胞通常在一定條件下,能分化產生3個胚層中各種類型細胞並形成器官的一類細胞。小鼠的胚胎幹細胞在體內和體外都可以分化產生3個胚層的各種細胞類型,當移植到發育的胚囊中後,還可以發育成新生的個體。因此有人認為,胚胎幹細胞也是一種全能的幹細胞。但如果將其植入到子宮中,由於不能分化成胚外組織,所以無法發育成正常個體。
來源
多能
幹細胞的簡單獲得人類
多能性幹細胞系的建立有兩個來源,其方法與以往在動物模型中建立的方法相同。(1) 在Dr. Thomson進行的工作中,他從人類
胚胎的
囊胚期內細胞群中直接分離多能幹細胞。Dr. Thomson從IVF(
體外受精)
臨床實驗室得到胚胎,這些胚胎是
不育症臨床治療不需要的,用於繁殖,而非研究目的。從捐獻者夫婦處獲得知情同意書後,Dr. Thomson分離了內細胞群,將這些細胞進行培養,產生一個
多能性幹細胞系。
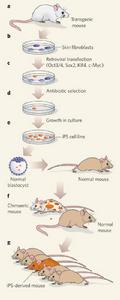 多能幹細胞的簡單獲得
多能幹細胞的簡單獲得(2) 與此相反,Dr. Gearheart從
終止妊娠的胎兒組織中分離出多能性幹細胞。捐獻者自行決定了終止妊娠,從他們那兒獲得了知情同意書後,Dr. Gearheart從原本要發育成
睪丸或卵巢的胎兒部位取得細胞。儘管Dr. Thomson 實驗室和Dr. Gearheart實驗室使用的
細胞系來源不同,但發育成熟的細胞看起來非常相似。
體細胞核轉移(SCNT)是得到多能性幹細胞的另一種途徑。在SCNT的動物研究中,研究者將一個正常的動物
卵細胞去除細胞核(含染色體的
細胞結構)。存留在卵細胞內的物質含營養成分和對
胚胎發育非常重要的能量物質。而後,在非常精細調控的實驗室條件下,將單個體細胞——除卵細胞或
精子細胞之外的任一種細胞——與除去核卵細胞放在一起,使兩者相融合。融合細胞以及其子細胞具有發育成一個完整個體的潛能,因此是
全能性的。正如圖I所示,這些
全能性細胞不久將形成
胚囊,從理論上來說,可利用胚囊的
內細胞群來建立
多能性幹細胞系。實際上,任何一種可生成人類胚囊細胞的方法都有可能成為人體多能性
幹細胞的來源。
中國研究
肖磊是中國科學院上海生命科學研究院生物化學與細胞生物學研究所科研人員。他和吳昭、陳霽君等同事成功運用可誘導(Tet-on/off系統)的
慢病毒表達系統表達
轉錄因子,從而把豬成體細胞成功地
重編程到多能
幹細胞狀態。經過進一步篩選、鑑定,最終獲得符合多能幹細胞標準的豬iPS
細胞系(
誘導多能幹細胞系)。這些細胞系形態類似
人類胚胎幹細胞,具有跟人類胚胎幹細胞類似的幹細胞
標記基因的表達,有很高的
端粒酶活性,並具有正常的
核型,而且在體外和體內都具有向內、中、外三個胚層
分化的能力。
肖磊表示,這是世界首次培育出
有蹄類動物的多能幹細胞。在此之前,無論是通過生殖細胞還是體細胞,人們都沒能從豬身上成功培育出多能幹細胞。這一研究成果對人類和動物的健康具有廣泛的意義。
人工培育豬
幹細胞的醫學套用,還需要若干年時間才能投入臨床使用。
這是全世界首次使用有蹄腳的動物即有蹄類動物的體細胞,而非精細胞或
卵細胞實現了這一成果。該成果可以為建立
人類遺傳病模型、培育供人類器官移植的
轉基因動物,及養殖耐受豬流感等疾病的豬開闢道路。該研究成果發布於新創刊的《分子細胞生物學報》。
誘導幹細胞
IPS (Induced Pluripotent Stem Cells )
iPS技術是
幹細胞研究領域的一項重大突破,它迴避了歷來已久的倫理爭議,解決了
幹細胞移植醫學上的
免疫排斥問題,使幹細胞向臨床套用又邁進了一大步。隨著iPS技術的不斷發展以及技術水平的不斷更新,它在生命科學基礎研究和醫學領域的優勢已日趨明顯。
美國哈佛大學研究人員採取添加特殊化合物的方法,將體細胞製造IPS的效率提高了100多倍。這項研究在大鼠實驗中已獲得成功,而在製造人類IPS時也可採取同樣方法,以提高效率。該成果被業界稱為IPS研究中的一大進步。
IPS是由一些多能遺傳基因導入皮膚等細胞中製造而成。在製造過程中,美國研究人員使用了4種遺傳基因,同時加入了7種包括可阻礙特定
蛋白質合成的物質和酶在內的化合物,以研究其各自的製造效率。研究結果顯示,沒有添加化合物時,遺傳基因的導入效率為0.01%—0.05%,而加入了一種叫“
巴爾普羅酸”的蛋白質合成阻礙劑之後,導入效率竟升至9.6%—14%。
如果從這4種
遺傳基因中排除導致細胞癌化的遺傳基因,只使用3種基因,過去的導入效率只有0.001%甚至更低,而加入“巴爾普羅酸”之後,其效率也提高了約50倍。研究人員認為,這很可能是因為“巴爾普羅酸”可以促進多能遺傳基因的活性。今後,研究人員將就添加化合物是否會使遺傳基因產生變異展開研究,以在提高製造效率的同時保證安全性。
奇兵突圍
英國《自然》雜誌和美國《細胞?
幹細胞》雜誌日前分別報導了中國科學家首次利用iPS細胞培育出活體小鼠的訊息,《自然》雜誌稱這一成果“為克隆成年哺乳動物開闢了一條全新道路”。克隆小鼠本身並不稀奇,而中國科學家的研究成果如此備受關注,關鍵在於克隆實驗所用的新型
全能細胞――iPS細胞。
iPS細胞又稱誘導多功能幹細胞,其神奇之處要從
胚胎幹細胞說起。胚胎幹細胞一直是幹細胞研究中的大明星,因為它能
分化成各種器官細胞,具有最廣泛的發展潛力。從技術角度來說,“
全能性”的胚胎幹細胞對於
治療性克隆來說是最理想的。
然而,由於人類胚胎
幹細胞研究觸及倫理和道德,在很多國家被法律禁止,相關研究也處於進退兩難的境地,幹細胞研究亟待突圍。
2007年,日本和美國科學家分別宣布發現將普通皮膚細胞轉化為幹細胞的方法,這樣得到的幹細胞和具有與胚胎幹細胞類似的功能,被稱為誘導多功能幹細胞,又名iPS細胞。這一發現分別被《自然》和《科學》兩大權威科學雜誌評為當年重大科學進展。
iPS細胞是“初始化”後的普通體細胞,但具有和
胚胎幹細胞類似的功能,能
分化生成各種組織細胞。更重要的是,它繞開了胚胎幹細胞研究一直面臨的倫理和法律等諸多障礙,醫療領域的套用前景非常廣闊。這一發現在克隆研究領域無異於“奇兵突圍”。美國、日本等許多國家更是以極大熱情,或加大投入,或制訂鼓勵政策,推動這一新興的
幹細胞研究。
但是,由於此前未能培育出完全由iPS細胞發育而來的活體哺乳動物,其
全能性一直受到懷疑。它是否能與胚胎幹細胞媲美,在醫療套用領域大顯身手呢?有關驗證性研究一直進展不大。
上海交通大學研究員
曾凡一女士參與了iPS
細胞克隆鼠的研究,她對新華社記者說,用iPS細胞能否培育出
小鼠正是驗證它是否具有全能性的“黃金標準”。先前國際上的相關研究始終未能成功,用iPS細胞培育的小鼠均胎死腹中。
周琪在接受新華社記者採訪時說,事實上,中國
幹細胞基礎研究和套用研究起步較早,2001年後,與幹細胞相關的重大研究項目不少於20個。此外,國家還在研發網路建設、人才建設、研究平台搭建等方面給予了大力支持,為中國在該研究領域的優勢地位奠定了基礎。
高紹榮也向新華社記者表示,iPS細胞具有全能性說明,完全通過體外操作可得到與
胚胎幹細胞具有同樣
分化能力的細胞,這將大大拓展iPS細胞的套用前景。這項成果是從幹細胞研究邁向實際醫療過程中的一大步,對幹細胞全能性的機理研究以及器官移植、
藥物篩選、基因治療等臨床套用研究具有重要價值。
人們完全有理由期待,在一系列危險和潛在危險被一一規避後,尚處在實驗室階段的iPS細胞研究,將能很快套用於人類疾病的治療。
潛在套用
有諸多理由可說明多能幹細胞對科學和人類健康的進展的重要性。最基本的,多能幹細胞可以幫助我們理解人類發育過程中的複雜事件。該項工作的首要目標是,確定參與導致
細胞特化的決定因素。雖然我們已知基因的啟動和關閉是該進程的核心,但我們對這些"決定"基因以及使之啟動或關閉的因素知之甚少。人類最嚴重的醫學難題,如癌症和先天缺陷就是因異常的細胞特化和
細胞分化所導致。如果能更好地了解正常
細胞的分化發育過程,從而能更深刻地理解其中的基本錯誤,了解這些致死疾病的成因。 人體多能幹細胞研究也能大大地改變研製藥品和進行安全性實驗的方法。例如,新的藥物/治療方法可以先用人類細胞系進行實驗,如癌細胞系就是為了這種實驗而建立的。多能幹細胞則使更多類型的細胞實驗成為可能。這不會取代在整個動物和人體身上進行實驗,但這會使藥品研製的過程更為有效。只有當細胞系實驗表明藥品是安全的,並有好的效果時,才有資格在實驗室進行動物和人體的進一步實驗。 也許人體多能幹細胞最為深遠的潛在用途是生產細胞和組織,它們可用於所謂的"細胞療法"。許多疾病及功能失調往往是由於細胞功能障礙或組織破壞所致。如今,一些捐贈的器官和組織常常用以取代生病的或遭破壞的組織。遺憾的是,受這些疾病折磨的病人數量遠遠超過了可供移植的器官數量。多能幹細胞經刺激後可發展為
特化的細胞,使替代細胞和組織來源的更新成為可能,從而可用於治療無數的疾病、身體不適狀況和殘疾,包括
帕金森氏病、Alzheimer’s病(
痴呆症)、
脊髓損傷、
中風、燒傷、心臟病、
糖尿病、
骨關節炎和
類風濕性關節炎。
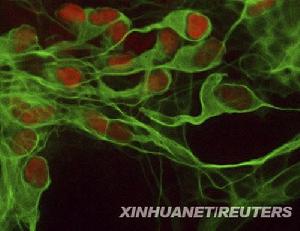 多能幹細胞分化出的運動神經
多能幹細胞分化出的運動神經上海生科院等揭示多能幹細胞在阿爾茨海默病細胞替代治療中的套用
10月15日,國際學術期刊Stem Cell Reports線上發表了中國科學院上海生命科學研究院生物化學與細胞生物學研究所景乃禾研究組的研究論文:Embryonic stem cell-derived basal forebrain cholinergic neurons ameliorate the cognitive symptoms associated with Alzheimer’s disease in mouse models。該論文成功地把小鼠和人胚胎幹細胞誘導分化為成熟的功能性基底前腦膽鹼能神經元(Basal forebrain cholinergic neuron,BFCN),將這些幹細胞來源的BFCN移植到阿爾茨海默病動物模型腦內,可以有效改善模型小鼠的認知功能。該項研究將有助於探討多能幹細胞來源的基底前腦膽鹼能神經元用於阿爾茨海默病細胞治療的可行性,並為基於多能幹細胞的阿爾茨海默病細胞替代治療提供理論依據。
阿爾茨海默病(Alzheimer’s disease,AD)是嚴重危害人類健康,特別是老年人身體健康和生活質量的重大疾病。目前,AD的治療主要依賴於藥物來延緩認知功能的衰退,效果非常有限。近年來,基於多能幹細胞的細胞替代治療在神經退行性疾病上的套用取得一定進展,然而多能幹細胞在AD細胞替代治療中的套用還少有研究。已有的研究證實,與認知活動密切相關的BFCN的功能異常和丟失是導致AD病人認知功能障礙的重要原因,因此BFCN可能具有改善AD認知功能障礙的潛能。但是,從多能幹細胞定向誘導分化為BFCN的研究剛剛起步,幹細胞來源的BFCN在AD細胞替代治療中的套用和功能還很不清楚。
在該項研究中,生化與細胞所景乃禾研究組工作人員岳偉、李媛媛和張婷等將小鼠和人多能幹細胞誘導分化為基底前腦膽鹼能神經元(Basal forebrain cholinergic neuron,BFCN),並發現這些多能幹細胞來源的BFCN具有與腦內BFCN相似的分子和功能特徵。在此基礎上,他們將小鼠和人多能幹細胞來源的BFCN前體細胞移植到AD模型小鼠的基底前腦內,發現移植細胞在AD小鼠基底前腦內主要分化為有功能的乙醯膽鹼能神經元,並能有效整合到AD小鼠基底前腦的乙醯膽鹼能投射環路。同時發現,移植外源BFCN的AD小鼠的學習和記憶功能得到了顯著的改善。這一研究工作是通過與北京師範大學舒友生研究組和上海生科院神經科學研究所於翔研究組合作完成。
該研究項目得到了科技部、國家自然科學基金委和中國科學院的資助。
 多能幹細胞分化出的運動神經
多能幹細胞分化出的運動神經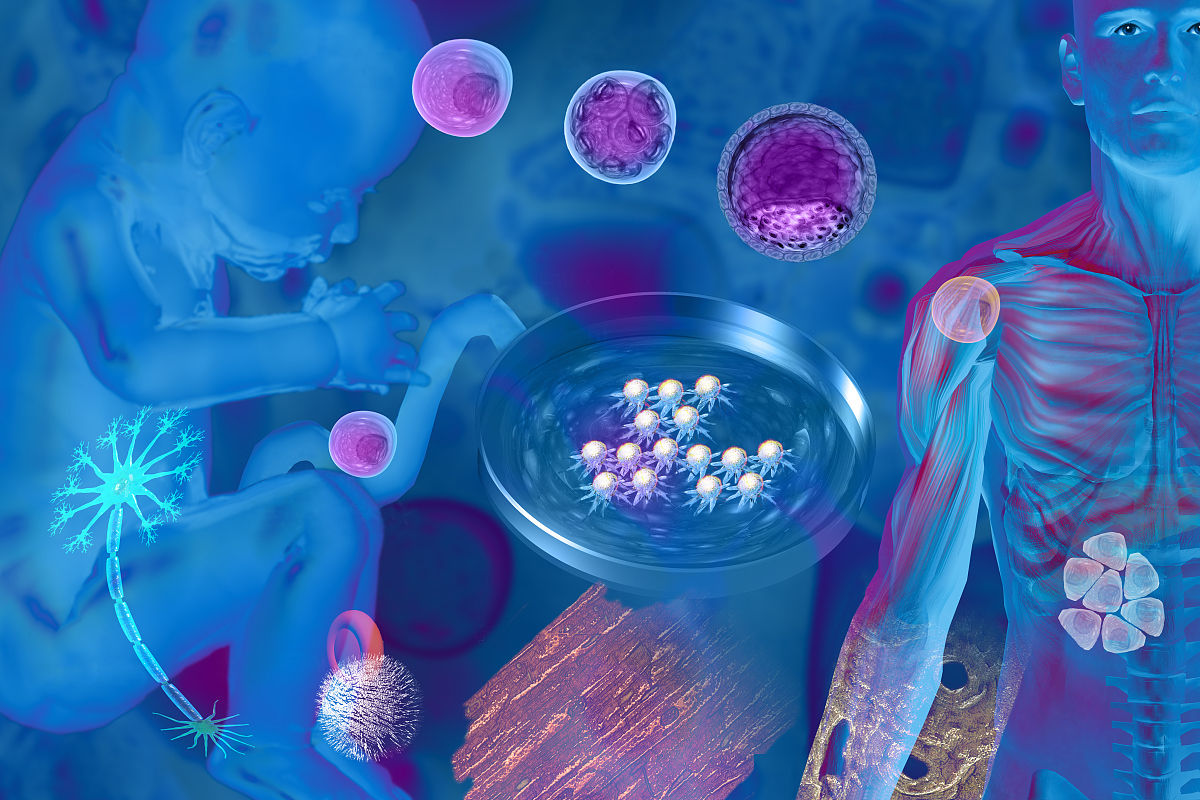
 多能幹細胞分化出的運動神經
多能幹細胞分化出的運動神經