吸附在電極上的H原子化合為H2(稱為塔菲爾反應或複合脫附步驟)。
基本介紹
- 中文名:塔菲爾反應
- 外文名:Tafel
- 定義:電極上H原子化合為H2
- 別稱:複合脫附步驟
塔菲爾反應公式,氫超電勢,塔菲爾經驗公式,
塔菲爾反應公式

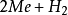
氫超電勢
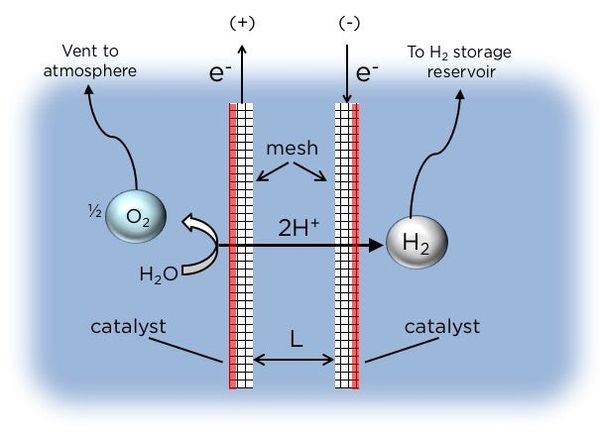
關於氫在陰極析出的機理,從20世紀30年代開始就有人提出了不同的理論,例如遲緩放電理論和複合理論等,雖然不同的人提出的理論不同,但也有一些共同點,如:都提出了H+的放電可分為幾個步驟進行:
(1)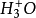 從本體溶液擴散到電極附近;
從本體溶液擴散到電極附近;
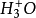
(2)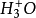 從電極附近的溶液中移到電極;
從電極附近的溶液中移到電極;
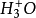
(3)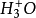 在電極上以下列機理放放電機制有兩類:
在電極上以下列機理放放電機制有兩類:
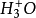
(a)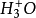 在電極表面上放電而形成H原子,吸附在電極表面(伏爾默反應)
在電極表面上放電而形成H原子,吸附在電極表面(伏爾默反應)
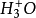


其中Me表示金屬電極。在鹼性溶液中,由於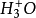 離子少,而直接在陰極上放電的可能是水分子
離子少,而直接在陰極上放電的可能是水分子
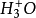
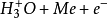

(b)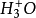 與已經吸附在電極表面上的氫原子H反應生成H2(稱為海洛夫斯基反應)
與已經吸附在電極表面上的氫原子H反應生成H2(稱為海洛夫斯基反應)
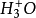


(a)、(b)都是電化學步驟,由於(b)中還包含吸附氫的脫附過程,故反應(b)又稱為電化學脫附步驟。
(4)塔菲爾反應
(5)已經證明,步驟(1)、(2)不能影響反應速率,至於步驟(2)、(3)、(4)究竟哪一步是影響反應速率的慢步驟,各種意見並不一致。遲緩放電理論認為(3)是決速步,而複合理論則認為(4)是慢步驟,但不同的理論最後都得到塔非爾關係式。
塔菲爾經驗公式
1905年,塔菲爾提出了氫超電勢的經驗公式,表示了氫超電勢與電流密度的定量關係,即: