流行病學
GBS的年發病率為0.6~1.9/10萬人,男性略高於女性,各年齡組均可發病。歐美發病年齡有雙峰現象,即16~25歲和45~60歲出現兩個高峰。我國目前尚無大規模的流行病學資料,臨床上似乎以兒童和青壯年多見。國外一般認為本病無明顯季節性,我國GBS發病似有地區和季節流行趨勢,上世紀後期我國河北與河南交界帶的農村,多在夏、秋季節有數年一次的流行趨勢。
病因
病因尚未充分闡明。約70%的GBS患者發病前8周內有前驅感染史,通常見於病前1~2周,少數病人有手術史或疫苗接種史。空腸彎曲菌(campylobacter jejuni,CJ)感染最常見,約占30%,腹瀉為前驅症狀的GBS患者CJ感染率高達85%,常與急性運動軸索型神經病(AMAN)有關。CJ感染潛伏期為24~72小時,腹瀉初為水樣便,以後出現膿血便,高峰期24~48小時,1周左右恢復。患者常在腹瀉停止後發病,約50%的CJ腸炎患者腹瀉2周后就不能分離出細菌。
巨細胞病毒(cytomegalovirus,CMV)感染與嚴重感覺型GBS有關,多數患者較年輕,發病症狀嚴重,常出現呼吸肌麻痹,腦神經及感覺受累多見,與GM2抗體關係密切,抗CMV的IgM抗體和冷凝集抗體滴度增高,觀察發現CMV感染的GBS有群發現象。發生於傳染性單核細胞增多症發病前後的GBS常伴EB病毒(Epstein-Barr virus,EBV)感染。肺炎支原體(myoplasma pneumonia,MP)感染的GBS患者年齡較輕。B型肝炎病毒(HBV)感染患者GBS發生率顯著高於非HBV感染組。另外亦有人類免疫缺陷病毒(HIV)及Lyme病的報導。
發病機制
目前認為GBS是一種自身免疫性疾病。分子模擬學說認為,病原體某些成分的結構與周圍神經的組分相似,機體發生錯誤的免疫識別,自身免疫性T細胞及自身抗體對周圍神經組分進行免疫攻擊,導致周圍神經脫髓鞘。實驗性自身免疫性神經炎(experimental autoimmune neuritis,EAN)動物模型證實,將EAN大鼠抗原特異性T細胞被動轉移給健康Lewis大鼠,經4~5日潛伏期可發生EAN,轉移少量T細胞可見輕微脫髓鞘,轉移大量T細胞可見廣泛軸索變性,可能由於繼發於嚴重炎症反應及神經水腫的“旁觀者效應”,可導致嚴重癱瘓。EAN與脫髓鞘病變為主的AIDP相似,與軸索變性為主的AMAN不同,病變嚴重程度與誘發因子引起免疫反應強度有關。巨噬細胞表面Fc受體可使巨噬細胞通過特異性結合抗體與靶細胞結合併損害之,是抗體介導免疫損害的典型過程,導致GBS脫髓鞘及單個核細胞浸潤典型的病理改變。
GBS是自限性疾病,抑制性T細胞可能對疾病恢復起作用,抑制性細胞因子如IFN-在EAN恢復期占主導地位,治療EAN可減輕病情。巨噬細胞或Schwann細胞釋放的前列腺素E也有免疫抑制作用,自身反應性T細胞通過細胞凋亡可終止免疫反應。
病理
GBS典型的病理改變為血管周圍的炎性細胞浸潤,合併有節段性脫髓鞘,以及不同程度的華勒變性。GBS有兩種病理學理論,一種理論認為脫髓鞘主要是由於神經水腫所致,而另一種理論則認為是由於神經內膜炎性細胞浸潤所致。AIDP病變在鏡下可見周圍神經節段性脫髓鞘和血管周圍淋巴細胞、巨噬細胞浸潤和形成血管鞘,嚴重病例可見多形核細胞浸潤,病變見於腦神經,脊神經前、後根,後根神經節及周圍神經等,運動及感覺神經同樣受損,交感神經鏈及神經節也可受累,不同病例受損神經不同可能是GBS症狀及電生理類型多樣性的原因。前角細胞或腦神經運動核可見不同程度腫脹、染色質溶解,程度取決於軸索損傷部位和程度,如軸索變性靠近神經細胞可引起細胞死亡,后角細胞病變較前角細胞輕,嚴重軸索變性肌肉病理呈神經源性肌萎縮。免疫組化光鏡偶可發現周圍神經IgM、IgG及補體C3沉積,可證實GBS和EAN急性期巨噬細胞及膠質細胞HLA和粘附分子表達。電鏡可見血管周圍巨噬細胞“撕開”髓鞘和吞飲髓鞘過程,AIDP軸索保持完整,髓鞘與軸索間無免疫細胞。
臨床表現
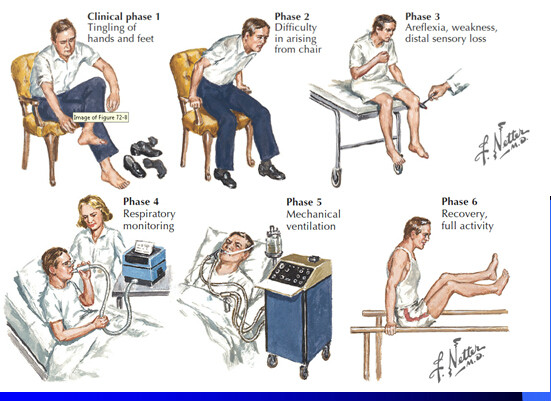
多數患者起病前1~4周可有胃腸道或呼吸道感染症狀或疫苗接種史。急性或亞急性起病;首發症狀為肌無力,多於數日至2周發展至高峰,常見類型為上升性麻痹,首先出現對稱性兩腿無力,典型者在數小時或短短數天后無力從下肢上升至軀幹、上肢或累及腦神經。下肢較上肢更易受累,肢體呈弛緩性癱瘓,腱反射降低或消失,通常在發病早期數天內患者即出現腱反射消失,部分患者輕度肌萎縮,長期臥床可出現廢用性肌萎縮。除極少數復發病例,所有類型AIDP患者均呈單相病程,多在發病4周時肌無力開始恢復。
感覺障礙一般比運動障礙為輕,表現為肢體遠端感覺異常如燒灼、麻木、刺痛和不適感等,以及手套襪子樣感覺減退,可先於癱瘓或與之同時出現,也可無感覺障礙。約30%的患者可有肌痛,尤其是腓腸肌的壓痛。約50%的患者出現雙側面癱,後組顱神經也常受累,造成延髓支配的肌肉無力,並導致清除分泌物及維持氣道通暢的困難。自主神經症狀常見皮膚潮紅、發作性面部發紅、出汗增多、心動過速、手足腫脹及營養障礙等;交感神經受損出現Horner征、體溫調節障礙、胃擴張和腸梗阻等;膀胱功能障礙通常僅發生於嚴重病例,且一般為一過性。
臨床分型
根據臨床表現、病理及電生理表現,將GBS分為以下類型:
(1)急性炎性脫髓鞘性多發神經病(AIDP):是GBS中最常見的類型,也稱經典型GBS,主要病變為多發神經病和周圍神經節段性脫髓鞘。
(2)急性運動軸索性神經病(acute motor axonal neuropathy,AMAN):AMAN以廣泛的運動腦神經纖維和脊神經前根及運動纖維軸索病變為主。
(3)急性運動感覺軸索性神經病(acute motor sensory axonal neuropathy,AMSAN):AMSAN以廣泛神經根和周圍神經的運動與感覺纖維的軸索變性為主。
(4)Miller Fisher 綜合徵(Miller-Fisher syndrome,MFS):與經典GBS不同,以眼肌麻痹、共濟失調和腱反射消失為主要臨床特點。
(5)急性泛自主神經病(acute panautonomic neuropathy):較少見,以自主神經受累為主。
(6)急性感覺神經病(acute sensory neuropathy,ASN):少見,以感覺神經受累為主。
輔助檢查
腦脊液出現蛋白-細胞分離現象是GBS的特徵之一,即蛋白水平升高而細胞數正常;病初CSF蛋白正常,通常在第一周末蛋白水平升高,臨床症狀穩定後蛋白仍可繼續升高,發病後3~6周達高峰,遷延不愈患者CSF蛋白可高達20g/L,是神經根病變導致根袖吸收蛋白障礙。白細胞計數一般<10×10∧6/L。CSF及外周血可檢出寡克隆帶,但不完全相同,提示部分Ig為鞘內合成,說明此病與免疫相關。
神經傳導速度(NCV)和肌電圖檢查有助於GBS診斷及確定原發性髓鞘損傷。發病早期可僅有F波或H反射延遲或消失,F波改變常代表神經近端或神經根損害,對GBS診斷有重要意義。電生理檢查NCV減慢,近端潛伏期延長,波幅正常或輕度異常,提示脫髓鞘改變,NCV減慢出現於疾病早期。肌電圖最初改變時運動單位動作電位(MUAP)降低,發病2~5周可見纖顫電位或正相波,6~10周近端纖顫電位明顯,遠端纖顫電位可持續數月。
診斷
2010年中國吉蘭一巴雷綜合徵診治指南
急性起病的、對稱性的四肢弛緩性癱瘓,可伴有雙側第Ⅶ或Ⅸ、Ⅹ顱神經麻痹,CSF有蛋白細胞分離現象,神經電生理檢查有神經傳導速度的減慢即可診斷本病。
AIDP診斷標準
(1)常有前驅感染史,呈急性起病,進行性加重,多在2周左右達高峰。(2)對稱性肢體和延髓支配肌肉、面部肌肉無力,重症者可有呼吸肌無力,四肢腱反射減低或消失。(3)可伴輕度感覺異常和自主神經功能障礙。(4)腦脊液出現蛋白--細胞分離現象。(5)電生理檢查提示遠端運動神經傳導潛伏期延長、傳導速度減慢、F波異常、傳導阻滯、異常波形離散等。(6)病程有自限性。
AMAN診斷標準
參考AIDP診斷標準,突出特點是神經電生理檢查提示近乎純運動神經受累,並以運動神經軸索損害明顯。
AMSAN診斷標準
參照AIDP診斷標準,突出特點是神經電生理檢查提示感覺和運動神經軸索損害明顯。
MFS診斷標準
(1)急性起病,病情在數天內或數周內達到高峰。(2)臨床上以眼外肌癱瘓、共濟失調和腱反射減低為主要症狀,肢體肌力正常或輕度減退。(3)腦脊液出現蛋白--細胞分離。(4)病程呈自限性。
急性泛自主神經病診斷標準
(1)急性發病,快速進展,多在2周左右達高峰。(2)廣泛的交感神經和副交感神經功能障礙,不伴或伴有輕微肢體無力和感覺異常。(3)可出現腦脊液蛋白.細胞分離現象。(4)病程呈自限性。(5)排除其他病因。
ASN診斷標準
(1)急性起病,快速進展,多在2周左右達高峰。(2)對稱性肢體感覺異常。(3)可有腦脊液蛋白-細胞分離現象。(4)神經電生理檢查提示感覺神經損害。(5)病程有自限性。(6)排除其他病因。
鑑別診斷
脊髓灰質炎
本病是在世界上已宣布消滅的中樞神經系統的病毒感染的傳染病,主要侵犯脊髓前角運動神經元,重症病例亦可有四肢癱瘓或呼吸肌癱瘓。但此病與GBS不同:癱瘓多呈不對稱性,或只侵犯某一肢或某一肌群;無感覺症狀及體徵。無CSF蛋白細胞分離現象;神經電生理檢查無周圍神經損害表現。
周期性癱瘓
為遺傳因素引起骨骼肌鈉通道蛋白的a亞單位突變所致的鉀離子轉運異常,表現為四肢肌肉的發作性、弛緩性癱瘓。發作時伴有血清鉀的改變及其相應的心電圖異常(U波),低鉀型最常見。
卟啉病
是卟啉代謝障礙引起的疾病,亦可表現為運動損害為主的多神經病,急性發作,女性患者多見,常伴有腹痛,患者的尿液在日曬後呈紫色。除周圍神經病外,病人尚可有頭痛、癲癇發作、精神症狀(特別是譫妄)。血卟啉及尿卟啉呈陽性。