化合物簡介,基本信息,物化性質,安全信息,分子結構數據,計算化學數據,合成方法,用途,藥典標準,來源(名稱)、含量(效價),性狀,鑑別,檢查,含量測定,藥理毒理,藥理,毒理,藥代動力學,適應症,用法與用量,不良反應,禁忌,注意事項,警告:,藥物相互作用,藥物過量,專家點評,
化合物簡介 基本信息 中文名稱:司他夫定
中文別名:1-(2,3-Dideoxy-β-D-glycero-pent-2-enofuranosyl)thymine;3'-脫氧-2',3'-雙脫氫胸苷;2',3'-二脫氫-3'-脫氧胸苷;2',3'-二去氫-3'-去氧胸腺定;1-(2,3-Dideoxy-β-D-glycero-pent-2-e;司他夫啶;
英文名稱:stavudine
英文別名:D4T;Stavudine;2',3'-Anhydrothymidine;Stavir;Sanilvudine;2',3'-Didehydro-3'-deoxythyMidine;sanilvudine;2',3'-dideoxy-2',3'-didehydrothymidine;2',3'-dideoxy-2',3'-didehydrothymine;2',3'-didehydro-3'-deoxythimidine;Stauvidine;2',3'-didehydro-3'-deoxythymidine;Avostav;2',3'-Didehydro-3'-deoxythymidine;1-(2,3-Dideoxy-Beta-D-Glycero-2-Pentenofuranosyl)Thymine;Virostav;ZERIT;1-(2,3-Dideoxy-β-D-glycero-2-pentenofuranosyl)thymine;
CAS號:3056-17-5
MDL號:MFCD00132921
RTECS號:XP2075000
PubChem號:24278356
分子式:C10 H12 N2 O4
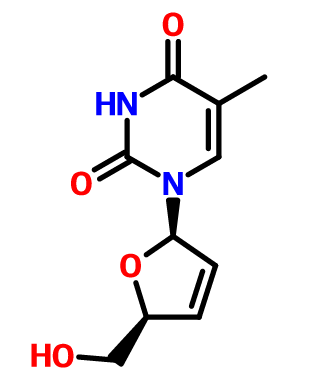
結構式:
分子量:224.21300
精確質量:224.08000
PSA:84.32000
物化性質 外觀與性狀:白色粉末
密度:1.374g/cm3
熔點:159-160°C
折射率:-46 ° (C=0.69, H2O)
水溶解性:5-10 g/100 mL at 21 ºC
穩定性:Stable. Combustible. Incompatible with strong oxidizing agents.
儲存條件:-20ºC
安全信息 海關編碼:2938901000
WGK Germany:2
危險類別碼:R36/37/38
安全說明:S26-S36
RTECS號:XP2075000
危險品標誌:Xi
分子結構數據 1、 摩爾折射率:53.85
2、 摩爾體積(cm/mol):163.0
3、 等張比容(90.2K):441.1
4、 表面張力(dyne/cm):53.5
5、 極化率(10cm):21.35
計算化學數據 1.疏水參數計算參考值(XlogP):無
2.氫鍵供體數量:2
3.氫鍵受體數量:4
4.可旋轉化學鍵數量:2
5.互變異構體數量:3
6.拓撲分子極性表面積78.9
7.重原子數量:16
8.表面電荷:0
9.複雜度:388
10.同位素原子數量:0
11.確定原子立構中心數量:2
12.不確定原子立構中心數量:0
13.確定化學鍵立構中心數量:0
14.不確定化學鍵立構中心數量:0
15.共價鍵單元數量:1
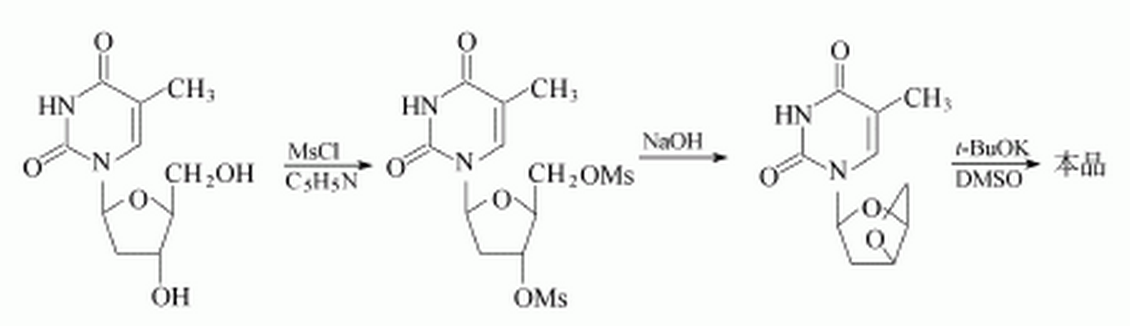
合成方法 胸苷溶於無水吡啶,冰鹽冷卻下滴加甲磺醯氯,攪拌、過濾,真空乾燥,得磺醯化粗品。粗品用90%乙醇重結晶,得精品。將上述磺醯化產物溶於氫氧化鈉水溶液,回流。用鹽酸中和,蒸去溶劑,殘液加氯仿,濾除不溶物,蒸去氯仿,用乙酸、乙醇結晶,得。色固體的環氧物。用乙醇重結晶2次可得白色絮狀固體。將該環氧物溶於二甲亞碸,加入叔丁醇鉀,在室溫下攪拌。用50%乙酸的乙醇溶液中和至pH=7。減壓濃縮,得到的物質用熱丙酮洗滌。洗液過濾後濃縮,再加乙醇,活性炭脫色,過濾。蒸出乙醇,加少量苯旋轉蒸發至溶液出現渾濁,靜置。析出的固體用乙醇-苯(1:5)重結晶,得白色粉狀的司他夫定。
用途 抗病毒藥。其生物利用度較高,有望改善抗HIV感染的現狀。
藥典標準 來源(名稱)、含量(效價) 本品為1-(2,3-二脫氧-β-D-甘油基-戊基-2-烯呋喃糖基)胸腺嘧啶。按無水物計算,含C10H12N2O4應為98.0%~102.0%。
性狀 本品為白色或類白色結晶性粉末。
本品在水中溶解,在乙醇或乙腈中略溶,在正己烷中幾乎不溶。
3.5.1比旋度
取本品,精密稱定,加水溶解並定量稀釋製成每1ml中含10mg的溶液,依法測定(2010年版藥典二部附錄ⅥE),比旋度為-39.5°至-45.9°。
鑑別 (1)在有關物質項下記錄的色譜圖中,供試品溶液主峰的保留時間應與司他夫定系統適用性試驗混合對照品溶液中司他夫定峰的保留時間一致。
(2)在含量測定項下記錄的色譜圖中,供試品溶液主峰的保留時間應與對照品溶液主峰的保留時間一致。
(3)取本品,加水溶解並稀釋製成每1ml中約含10μg的溶液,照紫外-可見分光光度法(2010年版藥典二部附錄ⅣA)測定,在266nm的波長處有最大吸收,在235 nm的波長處有最小吸收。
(4)本品的紅外光吸收圖譜應與對照品的圖譜一致(2010年版藥典二部附錄Ⅳ C),如不一致,取本品與對照品用無水乙醇重結晶後測定。
以上(1)、(2)兩項可選做一項。
檢查 有關物質
取胸腺嘧啶對照品適量,精密稱定,加水溶解並定量稀釋製成每1ml中約含250μg的溶液,作為對照品貯備液;另取本品,加水溶解並稀釋製成每1ml中約含0.5mg的溶液,作為供試品溶液(臨用新制);精密量取1ml與對照品貯備液2ml,置同一200ml量瓶中,用水稀釋至刻度,搖勻,作為對照溶液(臨用新制)。照高效液相色譜法(2010年版藥典二部附錄ⅤD)試驗,用十八烷基矽烷鍵合矽膠為填充劑,以乙腈-0.01mol/L醋酸銨溶液(3.5:96.5)為流動相A,乙腈-0.01mol/L醋酸銨溶液(25:75)為流動相B,按下表進行梯度洗脫,檢測波長為254nm。取司他夫定系統適用性試驗混合對照品適量,加水溶解並稀釋製成每1ml中約含0.5mg的溶液,作為系統適用性試驗溶液(溶液中含胸腺嘧啶、胸苷與其異構體、司他夫定與α-司他夫定),量取10μl注入液相色譜儀,調節流速使司他夫定主峰的保留時間在8.5分鐘至12.5分鐘之間,胸腺嘧啶峰相對於司他夫定峰的保留時間約為0.28,胸苷峰相對於司他夫定峰的保留時間約為0.5,胸苷峰與其異構體峰的分離度應不小於1.15,司他夫定峰與α-司他夫定峰的分離度應不小於1.0。量取對照溶液10μl注入液相色譜儀,調節檢測靈敏度,使司他夫定色譜峰的峰高約為滿量程的10%。再精密量取供試品溶液與對照溶液各10μl,分別注入液相色譜儀,記錄色譜圖。供試品溶液的色譜圖中如顯雜質峰,胸腺嘧啶按外標法以峰面積計算,不得過0.5%,其他單個雜質峰面積不得大於對照溶液主峰面積的0.2倍(0.1%),其他各雜質峰面積的和不得大於對照溶液主峰面積(0.5%)。
時間(分鐘)
流動相A(%)
流動相B(%)
0
100
0
10
100
0
20
0
100
30
0
100
35
100
0
40
100
0
殘留溶劑- 甲醇、異丙醇、甲苯、乙酸丁酯、吡啶、N,N-二甲基乙醯胺與N-甲基吡咯烷酮
取本品約0.5g,精密稱定,精密加入二甲亞碸-水(1:l)10ml,振搖使溶解,作為供試品溶液;分別精密稱取甲醇、異丙醇、甲苯、乙酸丁酯、吡啶、N,N-二甲基乙醯胺和N-甲基吡咯烷酮各適量,用二甲亞碸-水(1:1)稀釋製成每1ml中分別含甲醇0.15mg、異丙醇0.15mg、甲苯0.0445mg、乙酸丁酯0.15mg、吡啶0.01lmg、N,N-二甲基乙醯胺0.0545mg和N-甲基吡咯烷酮0.0265mg的溶液,搖勻,作為對照品溶液。照殘留溶劑測定法(2010年版藥典二部附錄ⅧP 第三法),用聚乙二醇-TPA修飾的毛細管色譜柱,起始溫度為40℃,維持5分鐘,以每分鐘15℃的速率升溫至120℃,維持2分鐘,再以每分鐘10℃的速率升溫至200℃,維持5分鐘;進樣口溫度為150℃;檢測器溫度為250℃。精密量取供試品溶液與對照品溶液各1μl,分別注入氣相色譜儀,記錄色譜圖。各相鄰色譜峰之間的分離度均應符合要求。按外標法以峰面積計算,含異丙醇與乙酸丁酯不得過0.3%,其他均應符合規定。
三氯甲烷
取本品約0.25g,精密稱定,置頂空瓶中,精密加水5ml與無水硫酸鈉1g,搖勻,作為供試品溶液;精密稱取三氯甲烷適量,用水溶解並定量稀釋製成每1ml中含3μg的溶液,精密量取5ml,置頂空瓶中,加無水硫酸鈉1g,搖勻,作為對照品溶液。照殘留溶劑測定法(2010年版藥典二部附錄Ⅷ P 第二法),以5%苯基-95%甲基聚矽氧烷(或極性相近)為固定液的毛細管柱為色譜柱;柱溫為45℃;進樣口溫度為150℃;檢測器溫度為250℃;頂空瓶平衡溫度為90℃,平衡時間為30分鐘。量取供試品溶液與對照品溶液分別頂空進樣,記錄色譜圖。按外標法以峰面積計算,應符合規定。
水分
取本品0.2g,照水分測定法(2010年版藥典二部附錄Ⅷ M 第一法)測定,含水分不得過0.5%。
熾灼殘渣
取本品1.0g,依法檢查(2010年版藥典二部附錄Ⅷ N),遺留殘渣不得過0.1%。
重金屬
取熾灼殘渣項下遺留的殘渣,依法檢查(2010年版藥典二部附錄ⅧH 第二法),含重金屬不得過百萬分之二十。
含量測定 照高效液相色譜法(2010年版藥典二部附錄Ⅴ D)測定。
色譜條件與系統適用性試驗
用十八烷基矽烷鍵合矽膠為填充劑;以乙腈-0.01mol/L醋酸銨溶液(5:95)為流動相;檢測波長為268nm。取胸腺嘧啶對照品5mg、胸苷對照品7.5mg與司他夫定對照品10mg,置同一100ml量瓶中,加水溶解並稀釋至刻度,搖勻,精密量取10ml,置50ml量瓶中,用水稀釋至刻度,搖勻,作為系統適用性試驗溶液,取10μl注入液相色譜儀,胸苷峰與胸腺嘧啶峰的分離度應不小於3.5,理論板數按司他夫定峰計算不低於800。
測定法
精密稱取本品適量,加水溶解並定量稀釋製成每1ml中含20μg的溶液(臨用新制),作為供試品溶液,精密量取25μl,注入液相色譜儀,記錄色譜圖。另取司他夫定對照品,同法測定,按外標法以峰面積計算,即得。
藥理毒理 藥理 作用機制:司他夫定是胸苷類似物,對體外人類細胞中HIV的複製有抑制作用。司他夫定被細胞激酶磷酸化後形成有活性的代謝物三磷酸司他夫定。三磷酸司他夫定抑制HIV逆轉錄酶,其機制包括與自然底物三磷酸脫氧胸苷競爭(Ki=0.0083-0.032μM),以及摻入至病毒DNA,因司他夫定無3ˊ羥基,從而終止DNA鏈的延長。三磷酸司他夫定抑制細胞β和γDNA多聚酶,也顯著減少線粒體DNA的合成。
體外HIV敏感性:使用外周血單核細胞、單核細胞和成淋巴細胞細胞株,測定司他夫定體外抗病毒活性。對於實驗和臨床分離出的HIV,50%抑制病毒複製的藥物濃度(ED50)範圍在:0.009到4mM之間。在體外實驗中,司他夫定與去羥肌苷合用有相加作用;與扎西他濱合用有協同作用。司他夫定與齊多夫定合用,隨兩個藥物的濃度比例不同,它們體外的抗病毒作用有時相加,有時拮抗。儘管體外HIV對司他夫定的敏感性已確定,司他夫定對人體內HIV複製的抑制作用尚不明確。
毒理 耐藥性:從體外和經司他夫定治療的病人中都分離出了對司他夫定敏感性減弱的HIV。經司他夫定治療的病人中分離出20對HIV。對它們進行了表型分析後發現其中有3對HIV對司他夫定的敏感性減弱了4-12倍。至於這種敏感性改變的遺傳基礎,目前尚未確定。同樣,敏感性的臨床意義也不明確。
交叉耐藥:司他夫定治療後從11個病人中分離出HIV。其中有5個產生對齊多夫定的中度耐藥性(9-176倍);有3個產生對去羥肌苷e的中度耐藥性(7-29倍),此種交叉耐藥的臨床意義尚未明了。
致癌作用、致突變作用和生育力損害:一項為期兩年的致癌作用的研究中,司他夫定用在小鼠和大鼠的劑量分別為臨床推薦劑量的39倍和168倍時(此倍數系據兩者總吸收量,即AUC的比例),均無發現致癌作用,當司他夫定用在小鼠和大鼠的劑量分別達到臨床推薦劑量的250倍和732倍時,小鼠和大鼠中出現良性和惡性肝臟腫瘤,雄性大鼠出現尿路膀胱腫瘤。
在Ames試驗、大腸桿菌逆向突變試驗和CH0/HGPRT哺乳類細胞順向突變試驗,無論有無代謝活化,司他夫定均無致突變作用。在體外人類淋巴細胞致畸變試驗、小鼠成纖維細胞試驗和體內小鼠微核試驗,司他夫定均呈陽性。無代謝活化的情況下,司他夫定濃度在25μg/ml至250μg/ml之間,能增加人類淋巴細胞染色體畸變的發生頻率;在25μg/ml至250μg/ml之間,能增加小鼠成纖維細胞轉型灶的發生頻率。體內微核試驗顯示,小鼠口服劑量在600至2000mg/kg/日的司他夫定三日後,骨髓細胞發生突變。
按臨床劑量lmg/kg/日形成的最高濃度(Cmax)折算,216倍的司他夫定在大鼠試驗中沒有造成生育能力損害。
分別在兔和鼠中進行了致畸敏感期毒性試驗,當暴露到正常臨床劑量1毫克每公斤每天的399倍到183倍(基於Cmax)時,均無證據表明有致畸性。當給予鼠399倍人類的暴露劑量時,胸骨節骨化不全或末骨化這-常見骨變異在胚胎中的發生率增加,而當給予216倍於人類的暴露劑量時,未觀察到有影響。當給予人類暴露劑量的216倍時,可見輕微的種植後丟失,而給予接近135倍量時,未見有影響。給予399倍的人類暴露劑量時,早期新生鼠(生後4天內)的死亡率升高,而接近l35倍量時,新生鼠存活率沒有影響。鼠的研究表明,司他夫定可經過胎盤進入胎仔體內,胎仔組織內的藥物濃度大約為母體血漿濃度的一半。不能完全根據動物生殖毒性的研究來推測人類的反應。
藥代動力學 已在HIV感染的成人和兒童患者中研究了司他夫定的藥代動力學。無論是單劑量給藥,還是多劑量給藥,在0.03到4mg/kg劑量範圍內,血漿峰濃度(Cmax)和曲線下面積(AUC)與劑量成正比。每隔6、8或12小時重複給藥,均無顯著的司他夫定積蓄。
吸收-口服後吸收迅速,給藥後1hr內達血藥峰濃度。
分布-在0.01至11.4μg/ml的濃度範圍內,司他夫定與血清蛋白的結合微弱,可不予考慮。司他夫定在紅細胞和血漿中的分布相同。
代謝-司他夫定在人體內的代謝情況尚未被闡明。
排泄-無論何種給藥途徑,司他夫定有40%通過腎臟排泄。其平均腎臟清除率為內生肌酐清除率的兩倍。提示除了腎小球濾過外,還存在腎小管主動分泌。
適應症 司他夫定與其它抗病毒藥物聯合使用,用於治療I型HIV感染。
臨床用藥:關於該品與其它抗病毒藥物聯合治療HIV感染病人,現已有數項其二聯和三聯用藥的臨床研究結果。
其中有一項編號為STARTl的多中心的臨床研究。此項開放隨機研究在202個首次接受治療的患者身上,比較了該品(40mg,BID)加用拉米夫定和indinavir,齊多夫定加用拉米夫定和indinavir兩種治療方案。結果顯示,在48周內,無論是HIV RNA的抑制程度,還是CD4細胞的增加,兩種治療方案作用相同。
在1992年至1994年,有一項編號為AI455-019的隨機雙盲研究收集了822個有一系列與HIV有關的症狀的病例,比較了該品和齊多夫定的療效,結果表明,兩者對HIV疾病的進展和死亡的作用相同。
用法與用量 司他夫定用藥間隔為12小時。服用司他夫定與進餐無關。
成人:推薦劑量按體重為≥60公斤患者,—次40mg,每日兩次。<60公斤患者,一次30mg,每日兩次。
兒童:兒童患者的推薦劑量為<30公斤,每次lmg/公斤,每12小時一次,>30公斤的兒童患者,按成人推薦劑量服用。
劑量調整:若在治療期間發生外周神經病變,立即停止司他夫定治療。停止後,中毒症狀可消退。有時停止治療後,中毒症狀可暫時加重。若症狀完全消退,患者可繼續耐受半推薦劑量的治療:≥60公斤患者,一次20mg,每日兩次。<60公斤患者,一次15mg,每日兩次。
繼續使用司他夫定後,若再發生神經病變,需考慮完全停止司他夫定治療。
腎臟損害患者:腎功能損害的患者服用司他夫定須按下表調整用藥劑量。
肌酐清除率(ml/min) ≥60公斤 <60公斤
≥50 每12小時40mg 每12小時30mg
26-50 每12小時20mg 每12小時15mg
10-25 每24小時40mg 每24小時15mg
鑒於在兒童患者中,尿液排泄也是消除司他夫定的主要途徑,若兒童患者腎功能有損害,其司他夫定的清除率也將隨之改變。雖然還沒有實驗數據表明這類患者用藥劑量需調整,仍可考慮減少劑量或延長用藥間隔。
血液透析患者--推薦劑量為:每24小時20mg(≥60kg),或每24小時15mg(<60kg),於血透完畢後給藥。在非透析日,也應在相同時間給藥。
不良反應 司他夫定能產生外周神經病變。外周神經病變與劑量有關,有時呈重度,使用去羥肌苷等有神經毒性藥物治療的、HIV感染的晚期、有神經病變病史的患者,較易發生外周神經病變。需監控患者發生外周神經病變的毒性。外周神經病變主要表現為手足麻木刺痛。患者一旦有此毒性發生,立即停止使用,司他夫定中毒症狀可消退。有時,停止治療後,中毒症狀可暫時加重。若症狀完全消退,患者可繼續耐受半劑量的治療。繼續使用司他夫定後,若再發生神經病變,需考慮完全停止司他夫定治療。
司他夫定與其它有相似毒性的藥物合用時,其不良反應比單用司他夫定更易發生。司他夫定與去羥肌苷合用時,不良反應發生率會增加,如胰腺炎、外周神經病變和肝功能異常。
臨床研究發現了下列幾項不良反應。這裡選出的幾項是較嚴重的、經常報告的不良反應。
全身反應一腹痛、過敏反應、寒顫和發燒。
消化系統一厭食。
外分泌腺一胰腺炎
造血系統一貧血、白細胞缺乏症和血小板缺乏症。
肝臟一乳酸中毒和肝臟脂肪變性,肝炎和肝功能衰竭。
肌肉骨骼系統一肌肉疼痛。
神經系統一失眠。
兒童患者:兒童患者中發生的不良反應及嚴重的實驗室檢查異常,其類型和發生率均與成人的相同。
禁忌 對司他夫定過敏的患者,禁用該品。
注意事項 司他夫定有外周神經病變的毒性。患者應知道外周神經病變主要表現為手足麻木刺痛,患者一但發現這些症狀,應告訴醫生。接受司他夫定治療的兒童患者,他們的看護人需知道上述內容,以便及時發現和報告外周神經病變毒性。
當司他夫定與其他有司他夫定相似毒性的藥物聯合使用時,有害反應發生的機率可能比單獨使用司他夫定要高。
司他夫定不能治癒HIV感染,他們仍會患HIV感染引起的疾病,如機會致病菌感染,患者在使用司他夫定時,仍需看醫生。另外,服用司他夫定不能防止HIV通過性接觸或血傳染。
HIV感染的母親不要給新生兒哺乳,以減少產後HIV傳染。
警告: ⒈乳酸酸中毒/嚴重的伴有肝脂肪變性的肝腫大/肝衰竭
乳酸酸中毒和伴有肝脂肪變性的肝腫大包括致命的病例,在單獨使用或聯合使用核苷類似物包括司他夫定及其他抗逆轉錄病毒藥物時都已有報導。在使用司他夫定、去羥肌苷和抗逆轉錄病毒藥物聯合治療的孕婦中,致命的乳酸酸中毒已被報導。妊娠期間用司他夫定和去羥肌苷聯合治療時,應謹慎使用,只有當可能的得益明顯大於危害時,才推薦使用。在聯合使用司他夫定、去羥肌苷和羥基脲的患者中,曾發生過因肝中毒而導致死亡,在已知有肝病危險因素的病人中使用司他夫定需特別小心,然而,也有無肝病危險因素的病例被報導。司他夫定與去經肌苷及羥基脲聯合使用進行治療的病人與單獨使用司他夫定的病人相比發生肝中毒的危險性更大,可能會致命。聯合用藥治療的病人應密切監測肝毒性的指標。
⒉外周神經病變
服用司他夫定的患者可出現外周神經病變。HIV感染的晚期患者、有神經病變病史的和同時使用如去羥肌苷神經毒藥物的患者,較易發生外周神經病變。
⒊胰腺炎
當懷疑患者有胰腺炎時,聯合使用的司他夫定、去羥肌苷(包括或不包括羥基脲)以及其他對胰腺有毒的藥物均應暫緩使用。當確診為胰腺炎時,重新使用司他夫定應特別小心並密切監測病
藥物相互作用 研究表明,司他夫定與去羥肌苷、拉米夫定和茚地那韋均無相互作用。齊多夫定能競爭性抑制細胞內司他夫定磷酸化,不建議齊多夫定與司他夫定並用。
藥物過量 在成人治療時,曾用到推薦劑量的12至24倍,未發現急性毒性。長期用藥過量的併發症包括外周神經病變和肝臟毒性。司他夫定可通過血液透析排出。尚未研究司他夫定是否能通過腹膜透析排出。
專家點評 本品為胸腺嘧啶脫氧核苷類似物,其對抗人體免疫缺陷病毒的活性與齊多夫定相似,對齊多夫定耐藥的HIV-1對本品敏感。在一項有822例患者參加的臨床試驗中,分別使用齊多夫定每次200mg、每天3次或本品每次40mg、每天2次治療,連續至少6個月。兩種藥物相比,司他夫定的有效性明顯,耐受性也更好一些,副作用出現較少。且本品的療程可明顯延長,可達79周;而齊多夫定最長為53周。國外報導,對一組33例CD4細胞計數為400/mm或少於400/mm的HIV感染者,其中4例為AIDS,29例為ARC,每天2、4、8mg/kg,分3~4次口服,或每天12mg/kg司他夫定,每一個劑量治療組至少5位患者。在6個月的治療中均顯示出司他夫定的治療效果,11例患者中有10例P24抗原滴度下降,31例患者中有11例CD4細胞計數上升50/mm超過基數。以體重增加2.5kg或2.5kg以上作為臨床改善指標,33例患者中有12例獲得明顯臨床改善。按臨床症狀綜合評分,20/30病例有改善,17/31病例觀察到生化指標改善,24/33病例取得臨床療效。截至1994年5月20天已有13000例患者經美國FDA“雙軌政策”(Parallel tack)許可接受司他夫定治療。在一項有822例患者參加的臨床試驗中,分別使用齊多夫定每次200mg,每天3次或本品每次40mg,每天2次治療,連續至少6個月,兩種藥物相比,司他夫定的有效性明顯,耐受性也更好一些,不良反應出現較少。且本品的療程可明顯延長,可達79周;而齊多夫定最長為53周。本品的劑量研究結論表明,成人使用劑量應為每次40mg,每天2次;兒童用藥量在每天0.125~4mg/kg的範圍內。有38例兒童患者使用本品長達12~36個月,平均用量為每天2mg/kg,療效良好而無與藥物有關的不良反應發生。HIV嚴重感染的成年晚期病例以成人劑量持續用藥22周,也取得了較好的臨床療效。目前,經美國FDA批准,已在美國開始給一些曾長期服用齊多夫定的成年HIV感染者臨床使用司他夫定。