《匹伏阿德福韋的晶型》是江蘇正大天晴藥業股份有限公司於2002年7月8日申請的專利,該專利的申請號為02137905X,公布號為CN1396170,授權公布日為2003年2月12日,發明人是張喜全、張愛明、徐健。
《匹伏阿德福韋的晶型》涉及9-[2-[[雙(新戊醯氧基)甲氧基]氧膦基]甲氧基]乙基]腺嘌呤(Adefovir dipivoxil,匹伏阿德福韋)的晶型。另外,該發明還涉及匹伏阿德福韋晶型在治療病毒性肝炎等肝臟疾病中的套用,含有匹伏阿德福韋晶型的藥物組合物和製備匹伏阿德福韋晶型的方法。
2007年,《匹伏阿德福韋的晶型》獲得第五屆江蘇省專利項目獎優秀獎。
(概述圖為《匹伏阿德福韋的晶型》摘要附圖)
基本介紹
- 中文名:匹伏阿德福韋的晶型
- 公布號:CN1396170
- 公布日:2003年2月12日
- 申請號:02137905X
- 申請日:2002年7月8日
- 申請人:江蘇正大天晴藥業股份有限公司
- 地址:江蘇省連雲港市新浦區巨龍北路8號
- 發明人:張喜全、張愛明、徐健
- 分類號:C07F9/6561、A61K31/675、A61P1/16、A61P31/12
- 代理機構:南京蘇科專利代理有限責任公司
- 代理人:徐冬濤
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,附圖說明,技術領域,權利要求,實施方式,榮譽表彰,
專利背景
在中國專利CN1251592A(公開號)中記載了美國吉爾利特科學股份公司發明的9-[2-[[雙(新戊醯氧基)甲氧基]氧膦基]甲氧基]乙基]腺嘌呤的四種結晶形態及其鹽。其中,結晶“形態1”AD基本不含水及其它結晶化溶劑;結晶“形態2”是AD的二水合物,除水外,通常不含其它結晶化溶劑;結晶“形態3”在晶格中約含1個當量的甲醇;結晶“形態4”為含富馬酸的AD。《匹伏阿德福韋的晶型》的E型匹伏阿德福韋不同於該專利四種晶型中任一種,為一種新的基本不含水及其它溶劑的結晶形態。
發明內容
專利目的
《匹伏阿德福韋的晶型》目的提供一種基本不含水及其它溶劑的E型匹伏阿德福韋。
該發明另一個目的是提供製備基本不含水及其它溶劑的E型匹伏阿德福韋的方法。
該發明另一個目的提供含有E型匹伏阿德福韋的藥物組合物。
另外,該發明還有一個目的是含有E型匹伏阿德福韋的組合物在治療病毒性肝炎等肝臟疾病中的套用。
技術方案
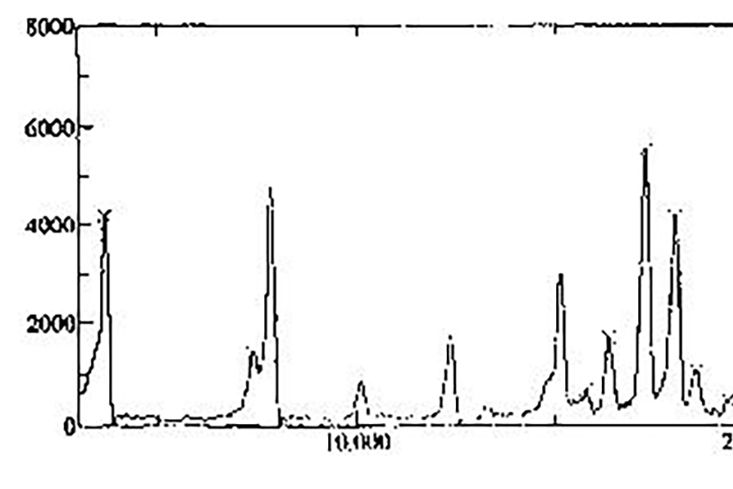
E型匹伏阿德福韋的特徵:《匹伏阿德福韋的晶型》提供非溶劑化的E型匹伏阿德福韋,使用Cu-Ka輻射,其X-射線衍射圖見圖1,以度表示的2θ在7.4、7.8、10.1、12.4、15.2、16.4、17.3、18.0、18.6、20.1、20.4、21.3、21.6、22.3、22.8、23.4、24.4、26.1、27.5、28.5、30.1有吸收峰。相對於專利CN1251592A報導的非溶劑化的晶型“形態1”,其典型的特徵為,在15.2,16.4有吸收峰,而專利中“形態1”有吸收峰的12.7、15.7、20.7位置,該發明的E型匹伏阿德福韋無吸收峰。
該發明的E型匹伏阿德福韋的DSC圖譜見圖2,其吸熱轉變在約94℃,而專利中“形態1”的吸熱轉變在約102℃。
該發明的E型匹伏阿德福韋用KBr壓片測得的紅外吸收圖譜見圖3,其特徵為在約3323厘米、3166厘米、1652厘米、1592厘米處有吸收峰。
E型匹伏阿德福韋的性質及其藥效學研究:一、溶解性:參照中國藥典2000年版二部凡例進行試驗,方法:精密稱取E型匹伏阿德福韋適量,緩慢加入一定量的溶劑,每隔5分鐘強力振搖30秒,觀察30分鐘內的溶解情況,結果見表1。
溶劑 | 溶質量(克) | 溶劑量(毫升) | 溶劑/溶質 | 現象 | 結論 |
甲醇 | 2.08 | 1.4 | 0.67 | 溶解 | 極易溶解 |
無水乙醇 | 2.16 | 5.6 | 2.59 | 溶解 | 易溶 |
0.1NHCl | 0.48 | 20 | 23.8 | 溶解 | 溶解 |
水 | 0.11 | 1100 | 10000 | 不溶 | 難溶 |
0.1NNaOH | 0.21 | 2100 | 10000 | 不溶 | 難溶 |
E型匹伏阿德福韋極易溶於甲醇,易溶於無水乙醇,在0.1NHCl溶液中溶解,在水及0.1NNaOH溶液中難溶。
二、穩定性
1、光照試驗
將E型匹伏阿德福韋原料均勻分攤至敞口培養皿中,厚度≤5毫米,調節距離,使光照強度為4500±500勒克斯,分別於5,10天取樣檢測,並與0天的結果進行對照。結果見表2。10天的x-射線衍射圖見圖4。
時間(天) | 考察項目 | ||
外觀 | 含量(%) | 熔點(℃) | |
0 | 白色結晶性粉末 | 98.7 | 91.4-92.8 |
5 | 白色結晶性粉末 | 98.8 | 91.2〜92.6 |
10 | 白色結晶性粉末 | 98.6 | 913-92.7 |
註:溫度變化23~26℃;相對濕度變化56%~63%
2、高溫試驗
將E型匹伏阿德福韋原料放置於密封潔淨玻璃瓶中,置於60℃恆溫乾燥箱中,分別於5,10天取樣檢測,並與0天的結果進行對照。結果見表3。10天的x-射線衍射圖見圖5。
時間(天) | 考察項目 | ||
外觀 | 含量(%) | 熔點(℃) | |
0 | 白色結晶性粉末 | 98.7 | 91.4-92.8 |
5 | 白色結晶性粉末 | 98.7 | 91.4-92.9 |
10 | 白色結晶性粉末 | 98.6 | 91.4-92.7 |
註:相對濕度變化54%~62%3、高濕試驗。
將E型匹伏阿德福韋原料均勻分攤至敞口培養皿中,厚度≤5毫米,置於室溫(25℃左右),相對濕度為75±5%的恆溫恆濕培養箱中,分別於5,10天取樣進行測定,並與0天的結果進行對照。結果見表4。10天的x-射線衍射圖見圖7。
時間(天) | 考察項目 | |||
外觀 | 吸濕增重(%) | 含量(%) | 熔點(℃) | |
0 | 白色結晶性粉末 | — | 98.7 | 91.4-92.8 |
5 | 白色結晶性粉末 | 1.9 | 98.6 | 89.2-90.7 |
10 | 白色結晶性粉末 | 4.7 | 98.6 | 89.1-90.7 |
註:溫度變化23~26℃4、加速試驗
將E型匹伏阿德福韋原料用聚乙烯薄膜塑膠袋密封包裝,置於40±2℃,相對濕度為75±5%的恆溫恆濕培養箱中,放置六個月,分別於1,2,3,6個月末取樣檢測,並與0月的結果進行對照。結果見表5。6個月的X-射線衍射圖見圖7。
時間(月) | 考察頊目 | ||
外觀 | 含量(%) | 熔點(℃) | |
0 | 白色結晶性粉末 | 98.7 | 91.4-92.8 |
1 | 白色結晶性粉末 | 98.8 | 91.4-93.2 |
2 | 白色結晶性粉末 | 98.7 | 91.1-92.8 |
3 | 白色結晶性粉末 | 98.7 | 91.3-92.8 |
6 | 白色結晶性粉末 | 98.6 | 91.4-93.0 |
由上述結果可知,該發明得到的E型匹伏阿德福韋在光照試驗和高溫試驗中(60℃),外觀和含量均無較大改變,說明其性質穩定;該品在高濕試驗中其外觀和含量均沒有明顯變化,但有一定吸濕性,其熔點降低。該品在高濕空氣中,易轉化為含結晶水的結晶。所以,為了防止該品與水結合,應密封保存。除高濕條件外,沒有發現晶型的轉變,表明在乾燥條件下,此結晶形態穩定。
三、藥效學研究
E型匹伏阿德福韋能夠被製成一種有效治療動物,特別是人病毒性肝炎等肝臟疾病的製劑,對E型匹伏阿德福韋進行藥效學研究,結果如下:
1、體外抗病毒試驗:在B型肝炎病毒基因轉染的人肝癌細胞系2.2.15細胞中,研究匹伏阿德福韋對細胞的毒性和對HBsAg、HBeAg及HBVDNA分泌的抑制效果。兩批試驗表明:匹伏阿德福韋16.0微克/毫升開始兩倍稀釋,加入細胞培養8天,對細胞半數中毒濃度TC50為20微克/毫升,最大無毒濃度TC0為10微克/毫升。最大無毒濃度時對HBsAg分泌的抑制率為15.3±6.9%;對細胞HBeAg分泌無抑制作用,對HBVDNA的抑制率為59.3%,抑制HBVDNA的IC50為6.1微克/毫升。
2、體內抗病毒試驗:在鴨B型肝炎病毒感染鴨體內進行治療試驗,觀察藥效。試驗結果表明:鴨B型肝炎病毒感染鴨在感染後第7天口服匹伏阿德福韋,30毫克/千克組一天2次,10天給藥後對鴨血清DHBV-DNA水平的抑制效果顯著,三批試驗統計學處理結果都有非常顯著作用(P<0.01)。15毫克/千克組給藥後第10天對感染鴨血清DHBV-DNA水平也有顯著抑制效果,統計學處理兩批(P<0.05),一批(P<0.01)。但停藥3天抑制%與對照組對比,僅1批效果顯著(P<0.01)。7.5毫克/千克組一天2次10天對感染鴨血清DHBV-DNA效果不穩定。試驗說明有效劑量在15-30毫克/千克1天2次10天組。30毫克/千克口服1天2次10天未見毒付反應。
E型匹伏阿德福韋的製備方法:據文獻1、2、3報導,製備匹伏阿德福韋的方法主要有兩種,一種為在N,N-二甲基甲醯胺中,加入9-(2-膦醯甲氧乙基)-腺嘌呤(PMEA)與新戊酸氯甲酯,用N,N-二環己基-4-嗎啉作縮合劑,三乙胺作催化劑,反應製得。另一種為在1-甲基-2-吡咯烷酮中,加入9-(2-膦醯甲氧乙基)-腺嘌呤與新戊酸氯甲酯,三乙胺作縮合劑,反應製得。為了提高產物的純度,該發明對9-(2-膦醯甲氧乙基)-腺嘌呤進行了純化。該發明對這兩種方法的後處理進行最佳化改進,減低了成本,提高了收率,避免了使用對人體有害的有機溶劑正丁醚、乙酸異丙酯等,並且獲得了新晶型E型匹伏阿德福韋,使該發明更適宜於工業化生產。
方法一:根據文獻1、2報導的方法,先製得9-(2-膦醯甲氧乙基)-腺嘌呤,然後用N,N-二甲基甲醯胺作溶劑,N,N-二環己基-4-嗎啉作縮合劑,三乙胺作催化劑,使9-(2-膦醯甲氧乙基)-腺嘌呤與新戊酸氯甲酯反應,反應完全後,用甲苯提取產物,然後濃縮甲苯,得到含有AD的油狀物。該發明採用向含有AD的油狀物中加入適量水或向油狀物中加入一定量的有機溶劑,攪拌使油狀物溶解在溶劑中,然後加入水,攪拌至有大量白色固體析出,過濾,將濾餅溶於甲醇中,加無水硫酸鎂乾燥後,減壓蒸乾,即得E型匹伏阿德福韋。用HPLC法檢測,純度達98.0%以上。
其中,加入的水量為PMEA投入量的1~30倍(包括以下提到的加入的量均以重量計),以使析出的固體容易攪拌。向油狀物中加入的有機溶劑對匹伏阿德福韋有較好的溶解性,如甲醇、乙醇、丙酮等,加入有機溶劑的量一般為PMEA量的0.5~5倍,加入水的量一般為加入水量的5~20倍。乾燥劑為無水硫酸鎂或無水硫酸鈉等能夠乾燥甲醇中水分並且不與匹伏阿德福韋反應的固體乾燥劑,或分子篩。其加入的量以能夠將甲醇中水分完全乾燥為準,一般為PMEA量的2~10倍。減壓的真空度一般為-0.1兆帕,也可以較低,均可達到很好的製備效果。蒸乾時的外浴溫度一般為30~60℃。甲醇溶劑的量一般為PMEA的1~10倍,使濾出固體溶解並便於操作即可。
方法二:用1-甲基-2-吡咯烷酮作溶劑,三乙胺作縮合劑,使9-(2-膦醯甲氧乙基)-腺嘌呤與新戊酸氯甲酯反應,反應完全後,加入乙酸乙酯,用水洗滌,濃縮乙酸乙酯,得到含有AD的油狀物。由油狀物製得E型匹伏阿德福韋的方法同方法一。純度達98.0%以上。
該發明的製劑包含E型匹伏阿德福韋和一種或多種藥用賦形劑的組合物,視需要,還可含其它治療成分。其賦形劑包括粘合劑、稀釋劑、崩解劑、防腐劑、分散劑、助流劑和潤滑劑等。該發明的製劑包括片劑和膠囊。這些組合物可以是含E型匹伏阿德福韋約5~250毫克的片劑或膠囊。
其片劑可通過任選地與一種或多種賦形劑一起制粒壓模而成,視需要可以對片劑進行包衣或壓花。膠囊也一樣可以與一種或多種賦形劑混合,由制粒或不制粒填充於膠囊殼製得。
附圖說明
圖1是《匹伏阿德福韋的晶型》E型匹伏阿德福韋x-射線衍射圖。
圖2是該發明E型匹伏阿德福韋差示掃描量熱測定圖(DSC圖)。
圖3是該發明E型匹伏阿德福韋紅外吸收光譜圖。
圖4是該發明E型匹伏阿德福韋強光照射10天的x-射線衍射圖。
圖5是該發明E型匹伏阿德福韋60℃考察10天的x-射線衍射圖。
圖6是該發明E型匹伏阿德福韋高濕考察10天的x-射線衍射圖。
圖7是該發明E型匹伏阿德福韋置40℃環境中考察6月的x-射線衍射圖。
技術領域
《匹伏阿德福韋的晶型》涉及9-[2-[[雙(新戊醯氧基)甲氧基]氧膦基]甲氧基]乙基]腺嘌呤的晶型E。9-[2-[[雙(新戊醯氧基)甲氧基]氧膦基]甲氧基]乙基]腺嘌呤通用名為匹伏阿德福韋(Adefovir dipivoxil,簡稱AD)。另外,該發明還涉及E型匹伏阿德福韋在治療病毒性肝炎等肝臟疾病中的套用,含有E型匹伏阿德福韋的藥物組合物和製備E型匹伏阿德福韋的方法。
權利要求
1、一種匹伏阿德福韋的晶型,其特徵在於所述晶狀匹伏阿德福韋為不含水及其它結晶化溶劑的結晶,其使用Cu-Ka輻射、以度2θ表示的X-射線粉末衍射光譜在7.4、7.8、10.1、12.4、15.2、16.4、17.3、18.0.18.6、20.1、20.4、21.3、21.6、22.3、22.8、23.4、24.4、26.1、27.5、28.5、30.1有峰,其DSC吸熱轉變在約94℃,紅外吸收圖譜約在3323厘米、3166厘米、1652厘米、1592厘米處有吸收峰。
2、一種製備權利要求1所述的匹伏阿德福韋晶體的方法,其特徵在於向含匹伏阿德福韋的油狀物中,加入水,攪拌使析出固體,回收固體,使溶於甲醇中,用乾燥劑乾燥後,減壓蒸乾,製得匹伏阿德福韋晶體。
3、一種製備權利要求1所述的匹伏阿德福韋晶體的方法,其特徵在於向含匹伏阿德福韋的油狀物中,加入有機溶劑甲醇、乙醇或丙酮使油狀物溶解,再加入水,攪拌使析出固體,回收固體,使溶於甲醇中,用乾燥劑乾燥後,減壓蒸乾,製得匹伏阿德福韋晶體。
4、一種藥物組合物,它含有權利要求1所定義的匹伏阿德福韋晶體和一種或多種藥用賦形劑。
5、如權利要求4所述的組合物,其特徵在於含5~250毫克匹伏阿德福韋晶型E的組合物製成片劑。
6、如權利要求4所述的組合物,其特徵在於含5~250毫克匹伏阿德福韋晶型E的組合物製成膠囊。
7、權利要求1所定義的匹伏阿德福韋晶型,作為活性成分在製備治療病毒性肝炎疾病藥物中的套用。
實施方式
實施例1
9-(2-膦醯甲氧乙基)-腺嘌呤純化方法:於100升反應鍋中,將9-(2-膦醯甲氧乙基)-腺嘌呤粗品1.0千克,加入50升的水中,加熱至回流,溶解後,保持溫度,加100克活性碳脫色10分鐘,過濾,放冷析晶,過濾,將結晶80℃烘乾即得純品。
實施例2
匹伏阿德福韋晶形E的製備:在10升反應鍋中,將純化的9-(2-膦醯甲氧乙基)-腺嘌呤0.5千克(1.8摩爾)懸浮於5升N,N-二甲基甲醯胺中,攪拌,加入1.044千克N,N-二環己基-4-嗎啉、三乙胺100毫升及1.382千克(9.2摩爾)新戊酸氯甲酯,升溫至50℃,保溫攪拌3小時,濾去不溶物,濾液在真空度-0.1兆帕下減壓濃縮,濃縮液用甲苯提取(10升×2)。在真空度-0.1兆帕下減壓回收甲苯,向剩餘的油狀液中加入純水5升,攪拌5小時,有大量白色固體析出,濾出,將其溶解在1.5升無水甲醇中,加無水硫酸鎂1.0千克攪拌2小時,過濾,母液加入活性碳50克,於50℃脫色10分鐘,外浴50℃,減壓蒸乾得白色固體,50~70℃乾燥8小時,即得匹伏阿德福韋結晶E553克,收率58%,Mp.92~94℃,HPLC法測含量為:98.6%。
實施例3
匹伏阿德福韋晶形E的製備:在10升反應鍋中,將純化的9-(2-膦醯甲氧乙基)-腺嘌呤0.5千克(1.8摩爾)懸浮於5升N,N-二甲基甲醯胺中,攪拌,加入1.044千克N,N-二環己基-4-嗎啉、三乙胺100毫升及1.382千克(9.2摩爾)新戊酸氯甲酯,升溫至50℃,保溫攪拌3小時,濾去不溶物,在真空度-0.1兆帕下減壓濃縮,濃縮液用甲苯提取(10升×2)。在真空度-0.1兆帕下減壓回收甲苯,向剩餘油狀液中加入乙醇0.5升,攪拌使油狀物溶解,然後加入水4升,攪拌5小時,有大量白色固體析出,濾出,將其溶解在1.5升無水甲醇中,加無水硫酸鎂1.0千克,乾燥水分,過濾,母液加入活性碳50克,於50℃脫色10分鐘,外浴60℃,在真空度-0.1兆帕下減壓蒸乾得白色固體,50~70℃乾燥8小時,即得匹伏阿德福韋結晶E548克。收率57%,Mp.92~94℃,HPLC法測含量為:99.3%。
實施例4
匹伏阿德福韋晶形E的製備
在10升反應鍋中,將純化的9-(2-膦醯甲氧乙基)-腺嘌呤0.5千克(1.8摩爾)加入1-甲基-2-吡洛烷酮中,氮氣保護,然後加入三乙胺0.927千克(9摩爾),攪拌下加入新戊酸氯甲酯1.377千克(1.296摩爾),升溫至60℃,反應2小時,加入6.8升乙酸乙酯終止反應,攪拌半小時,過濾,母液用水洗滌(5升×2),在真空度-0.1兆帕下減壓回收乙酸乙酯,向剩餘的油狀液中加入純水5升,攪拌4小時,有大量白色固體析出,濾出固體,溶解於1.5升無水甲醇中,加無水硫酸鎂1.0千克,乾燥2小時,過濾,母液加入活性碳50克,於50℃脫色10分鐘,外浴50℃,在真空度-0.1兆帕下減壓蒸乾得白色固體,50~70℃乾燥8小時,得匹伏阿德福韋結晶E534克。收率56%。Mp.92~94℃。
實施例5
片劑的製備:按下述方法用幾種賦形劑將E型匹伏阿德福韋配製成每片含10毫克的片劑。
原輔料名稱 | 配方用量(克/1000片) | |
配方1 | 配方2 | |
匹伏阿德福韋 | 10.0 | 10.0 |
乳糖 | 100.0 | 100.0 |
澱粉 | — | 30.0 |
低取代羥丙基纖維素 | 3.0 | 3.0 |
微晶纖維素 | 3.0 | — |
滑石粉 | 6.0 | 6.0 |
硬脂酸鎂 | 1.0 | 1.0 |
1%羥甲基纖維素鈉 | 適量 | 適量 |
含E型匹伏阿德福韋的片劑的製造方法是將上述賦形劑與E型匹伏阿德福韋混合均勻,加入1%羥甲基纖維素鈉溶液適量,製成軟材,過篩制粒,濕顆粒烘乾,過篩整粒,加入硬脂酸鎂和滑石粉混合均勻,壓片。
實施例6
膠囊的製備:按下述方法用幾種賦形劑將E型匹伏阿德福韋配製成每粒含10毫克的膠囊。
原輔料名稱 | 配方用量(克/1000粒) | ||
配方1 | 配方2 | 配方3 | |
匹伏阿德福韋 | 10.0 | 10.0 | 10.0 |
乳糖 | — | — | — |
澱粉 | 139.0 | — | — |
微晶纖維素 | — | 139.0 | 139.0 |
硬脂酸鎂 | 1.0 | 1.0 | 1.0 |
1%羥甲基纖維素鈉 | 適量 | — | 適量 |
含E型匹伏阿德福韋的膠囊的製造方法是將上述賦形劑與E型匹伏阿德福韋混合均勻,加入1%羥甲基纖維素鈉,製成濕顆粒,烘乾,過篩整粒,加入硬脂酸鎂,混合均勻,插入膠囊製得。或不制粒,將E型匹伏阿德福韋與上述賦形劑混合均勻,過篩,直接插囊製得。
參考文獻: | |
1 | 劉曉輝,王琳,貫寶和等:藥學學報1996;31(2):112~117; |
2 | 張勇,李欣,宮平等:瀋陽藥科大學學報2001;18(2)95~97 |
3 | 中國專利,公開號CN1251592A |
榮譽表彰
2007年,《匹伏阿德福韋的晶型》獲得第五屆江蘇省專利項目獎優秀獎。