本品與其他抗逆轉錄病毒藥物聯合使用,適用於治療開始時1型人類免疫缺陷病毒核糖核酸(HIV-1 RNA)低於或等於100,000拷貝/mL的1型人類免疫缺陷病毒(HIV-1)感染的初治患者。
用藥局限性:
與在開始治療時HIV-1 RNA低於或等於100,000拷貝/mL的受試者相比,高於100,000拷貝/mL的受試者在接受本品治療時發生了更多的病毒學失敗(HIV-1 RNA≥50拷貝/mL)。
無論治療開始時HIV-1 RNA水平如何,CD4+細胞計數低於200細胞/mm3受試者比 CD4+細胞計數高於或等於200細胞/mm3受試者接受本品治療發生的病毒學失敗更多。
對於非核苷類反轉錄酶抑制劑產生耐藥和交叉耐藥的受試者,與依非韋倫相比,本品治療發生的病毒學失敗率更高。
與依非韋倫相比,本品治療的更多的受試者對拉米夫定/恩曲他濱產生耐藥性。
.
基本介紹
- 藥品名稱:利匹韋林片
- 用途分類:逆轉錄酶抑制藥
藥品名稱,成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,進口藥品註冊證號,
藥品名稱
通用名稱:利匹韋林片
英文名稱:Rilpivirine Tablets
漢語拼音:Lipiweilin Pian
成份
主要成份:鹽酸利匹韋林
化學名稱:4-[[4-[[4-[(E)-2-氰基乙烯]-2,6- 二甲基苯基]氨基]-2-嘧啶基]氨基]苯甲腈單鹽酸鹽
化學結構式:
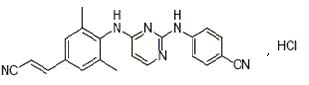
分子式:C22H18N6·HCl
分子量:402.88(366.42+36.46)
輔料:乳糖、交聯羧甲纖維素鈉、矽化微晶纖維素、硬脂酸鎂、聚維酮K30、聚山梨酯20、白色包衣粉
性狀
本品為白色至類白色薄膜衣片,除去包衣後顯白色。
適應症
本品與其他抗逆轉錄病毒藥物聯合使用,適用於治療開始時1型人類免疫缺陷病毒核糖核酸(HIV-1 RNA)低於或等於100,000拷貝/mL的1型人類免疫缺陷病毒(HIV-1)感染的初治患者。
用藥局限性:
- 與在開始治療時HIV-1 RNA低於或等於100,000拷貝/mL的受試者相比,高於100,000拷貝/mL的受試者在接受本品治療時發生了更多的病毒學失敗(HIV-1 RNA≥50拷貝/mL)。
- 無論治療開始時HIV-1 RNA水平如何,CD4+細胞計數低於200細胞/mm3受試者比 CD4+細胞計數高於或等於200細胞/mm3受試者接受本品治療發生的病毒學失敗更多。
對於非核苷類反轉錄酶抑制劑產生耐藥和交叉耐藥的受試者,與依非韋倫相比,本品治療發生的病毒學失敗率更高。
- 與依非韋倫相比,本品治療的更多的受試者對拉米夫定/恩曲他濱產生耐藥性。
規格
25mg(以利匹韋林計)
用法用量
本品在12歲及以上且體重≥35kg的患者中的推薦劑量是25mg,每日一次,一次一片,隨餐口服(參見【兒童用藥】和【藥理毒理】)。不建議12歲以下患者使用本品。
與利福布汀同時使用:對於與利福布汀合用的患者,應將本品劑量提高至每日一次,每次50mg(兩片,25mg/片),隨餐服用。停止合用後,應將本品劑量降低至每日一次,每次25mg,隨餐服用(參見【藥物相互作用】和【藥理毒理】)。
不良反應
臨床試驗證據:成人患者
因為臨床試驗是在極多樣化的條件下進行的,故某一藥物在其臨床試驗中觀察到的不良反應發生率不能與另一藥物在其臨床試驗中的發生率直接進行比較,而且臨床試驗中的不良反應發生率可能無法反映臨床實踐中的發生率。
安全性評估是基於對Ⅲ期臨床對照研究TMC278-C209(ECHO)和TMC278-C215(THRIVE)的為期96周的匯總數據分析得出,共包括1368名成年HIV-1感染的抗逆轉錄病毒初治患者,其中有686名接受本品(25mg 每天1次)治療(參見【臨床試驗】)。本品組和依非韋倫組中患者暴露的中位時間分別為104.3和104.1周。藥物不良反應大多出現在治療的前48周。由於藥物不良反應而導致終止使用本品或依非韋倫治療的受試者所占比例(不考慮嚴重程度的區別)分別為2%和4%。最常見的導致治療終止的藥物不良反應為精神疾病:本品組和依非韋倫組分別有10例(1%)和11例(2%)受試者出現。因皮疹導致終止治療:本品組1例(0.1%)而依非韋倫組為10例(1.5%)。
常見的藥物不良反應
表1列舉了成年受試者中報告的至少中等強度(≥2級)且發生率≥2%的藥物不良反應。表2包含了在治療過程中出現的被視為藥物不良反應的實驗室檢查結果異常。
表1:成年HIV-1感染的抗逆轉錄病毒初治受試者在治療過程中發生率≥ 2%且中度以上強度*(2~4級)的藥物不良反應(96周分析)
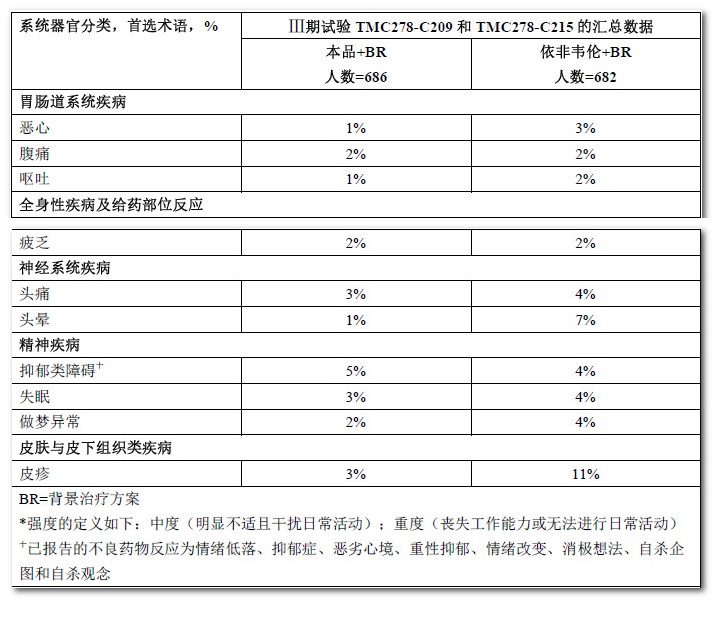
在Ⅲ期臨床試驗TMC278-C209和TMC278-C215的48周至96周,以及Ⅱb期臨床試驗TMC278-C204的截至240周的成年受試者中未發現新的藥物不良反應。TMC278-C204 的Ⅱb期臨床試驗的不良事件發生率與為期96周的Ⅲ期臨床試驗相似。
少見(<2%)的藥物不良反應
未接受過抗逆轉錄病毒治療受試者接受本品治療出現的至少中等強度(≥2級)且發生率<2%的藥物不良反應按不同系統器官分類列舉如下。這些不良事件包括那些研究者評估認為可能具有潛在因果關係以及被考慮為嚴重的或有1例以上使用本品治療受試者報告的藥物不良反應。
胃腸道疾病:腹瀉、腹部不適;
肝膽疾病:膽囊炎、膽石症;
代謝和營養疾病:食慾減退;
神經系統疾病:嗜睡;
精神疾病:睡眠障礙、焦慮;
腎和泌尿系統疾病:膜性腎小球腎炎、系膜增生型腎小球腎炎、腎結石。
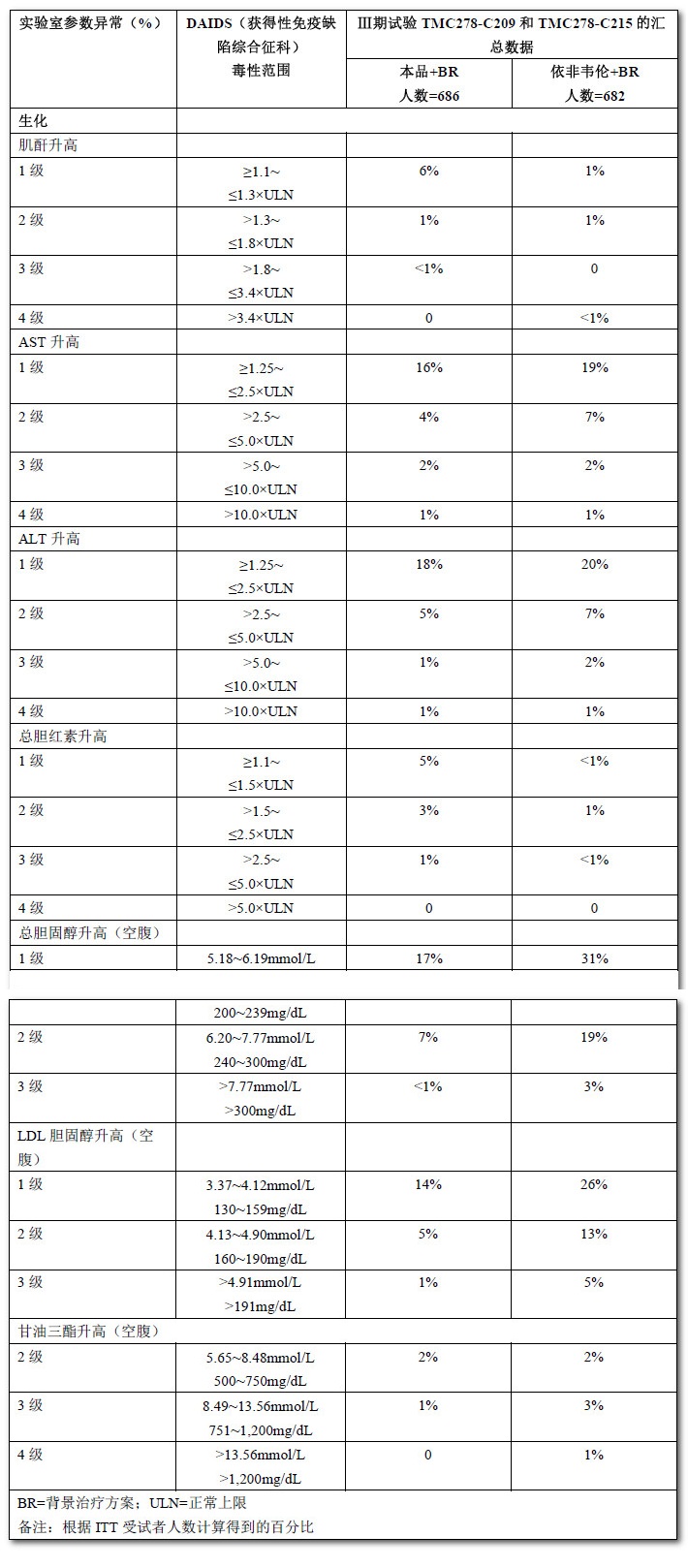
在初治受試者中出現的實驗室檢查結果異常
表2顯示的是在Ⅲ期臨床試驗中,受試者在使用本品或依非韋倫治療時被視為嚴重藥物不良反應的臨床實驗室檢查異常結果(1~4級)的比例。
表2:成年HIV-1感染的抗逆轉錄病毒初治受試者在治療過程中出現的實驗室參數(1~4級)的改變(96周分析)
腎上腺功能
在匯總的Ⅲ期臨床試驗數據中,第96周時,本品組中的皮質醇總體平均變化值相較於基線的總體平均變化為-0.69(-1.12;0.27)μg/dL ,依非韋倫組為-0.02(-0.48;0.44)μg/dL 。
與依非韋倫組18/561(3.2%)相比,本品組基線時250 μg促腎上腺皮質激素(ACTH)刺激試驗結果正常的受試者中,43/588(7.3%)在試驗期間出現結果異常(皮質醇水平峰值< 18.1 μg/dL)。上述250μg ACTH刺激試驗結果異常的受試者中,本品組和依非韋侖組中分別有14例和9例受試者第96周時的試驗結果異常。總的來說,未出現與腎上腺功能不全相關的嚴重不良事件、死亡或治療終止。本品組中250 μg ACTH刺激試驗的結果異常率較高,其臨床意義尚不明確。
血清肌酐
在匯總的Ⅲ期試驗數據中,在96周的本品治療期間觀察到血清肌酐升高,且大多出現在前4周,治療96周后觀察到的平均變化為0.1mg/dL(範圍:-0.3mg/dL至0.6mg/dL)。參加試驗有輕度或中度腎損傷的受試者,血清肌酐的升高程度與腎功能正常的受試者相似。故不考慮這些變化與臨床有關且無受試者因血清肌酐升高而終止治療。血清肌酐升高與使用背景治療方案的核苷類反轉錄酶抑制劑(N(t)RTI)無關。
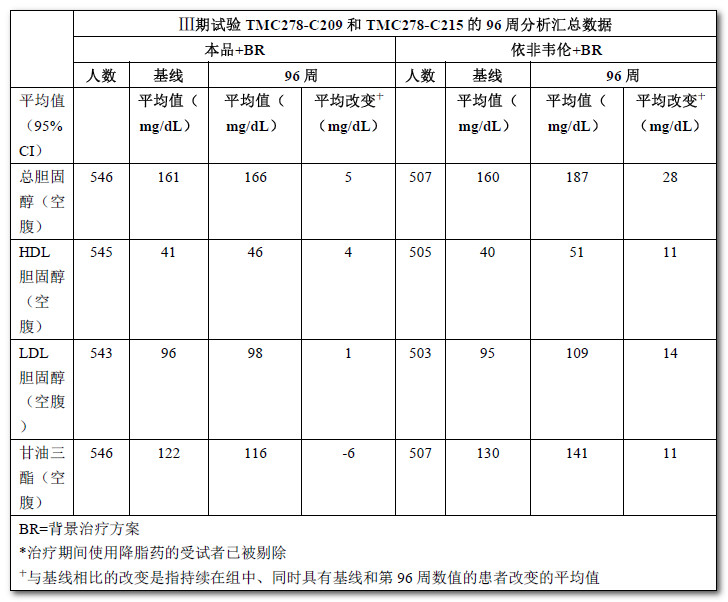
血脂
表3顯示的是總膽固醇、LDL-膽固醇、HDL-膽固醇和甘油三酯較基線的變化,尚未證明這些觀察結果的臨床獲益。
表3:脂質值,較基線的平均變化*
合併感染B型肝炎病毒和/或C型肝炎病毒的受試者
接受本品治療且合併感染了乙型或C型肝炎病毒的受試者,肝酶升高的發生率高於無合併肝炎病毒感染的受試者。這一觀察結果與依非韋倫組類似。合併感染的受試者利匹韋林藥代動力學暴露量與無合併感染的受試者相似。
臨床試驗證據:兒科患者
基於一項單臂、開放性、Ⅱ期臨床試驗TMC278-C213的第48周分析進行安全性評估,試驗中36例12 - < 18歲、體重≥ 32 kg且未接受過抗逆轉錄病毒治療的HIV-1感染患者接受本品(25 mg每日一次)與其他抗逆轉錄病毒藥物聯合治療(參見【臨床研究】)。中位暴露持續時間為63.5周。無患者因藥物不良反應終止治療。與在成人患者中觀察到的不良反應相比,未發現新的藥物不良反應。
19例兒科受試者報告藥物不良反應(52.8%),多數藥物不良反應為1級或2級,其中至少有2例受試者報告最常見的藥物不良反應(不考慮嚴重程度的區別)包括頭痛(19.4%)、抑鬱(19.4%)、嗜睡(13.9%)、噁心(11.1%)、頭暈(8.3%)、腹痛(8.3%)、嘔吐(5.6%)和皮疹(5.6%)。
觀察到的實驗室檢查結果異常與成人相似。
腎上腺功能
在試驗TMC278-C213中,第48周時基底皮質醇總體平均值較基線變化顯示,該指標增加1.59(0.24,2.93)μg /dL。
30例基線時250μg ACTH刺激試驗結果正常的受試者中,6例(20%)受試者在試驗期間出現結果異常(皮質醇水平峰值< 18.1 μg/dL),其中3例受試者第48周時的試驗結果異常。總體而言,未出現可明確歸因於腎上腺功能不全的嚴重不良事件、死亡或治療終止。250 μg ACTH刺激試驗結果異常的臨床意義尚不明確。
上市後經驗
上市後階段,在接受含利匹韋林治療方案的患者中發現了不良反應。由於這些反應來自一組人數未知的群體的自發報告,因此不一定能夠可靠估算其發生率或者確定其與藥物暴露之間的因果關係。
腎和泌尿生殖系統疾病:腎病綜合徵;
皮膚及皮下組織類疾病:重症皮膚反應和超敏反應,包括藥物反應伴嗜酸性粒細胞增多症和全身性症狀(DRESS)。
禁忌
本品不應與下列藥物同時使用,這主要是因為這些藥物對CYP3A 酶有誘導作用或導致胃液的pH升高,從而可能顯著減低利匹韋林的血漿濃度並可能導致病毒學應答失敗和可能產生
USPI Aug 2015
對本品或對非核苷類反轉錄酶抑制劑(NNRTIs)的耐藥性(參見【藥物相互作用】和【藥理毒理】):
- 抗癲癇藥:卡馬西平、奧卡西平、苯巴比妥、苯妥英鈉;
- 抗分枝桿菌藥:利福平、利福噴丁;
- 質子泵抑制劑:例如埃索美拉唑、蘭索拉唑、奧美拉唑、泮托拉唑、雷貝拉唑;
- 系統性糖皮質激素治療:地塞米松(多於一劑);
- 聖約翰草(貫葉金絲桃)。
注意事項
藥物相互作用
在處方本品時應謹慎開具可能減少利匹韋林暴露的藥物(參見【禁忌】、【藥物相互作用】和【藥理毒理】部分)。
對心電圖的影響
一項包含了60名健康成年受試者的隨機、安慰劑和陽性對照(莫西沙星400mg每天1次)交叉研究,通過超過24小時的13次心電圖檢查評估了推薦劑量(25mg每天1次)的本品穩態時對QTcF間期的影響。QTcF間期經安慰劑基線校正後時間匹配的最大平均值(95%可信上限)差異為2.0(5.0)毫秒(低於具有臨床意義的閾值)。
健康成人超治療劑量使用本品(每日1次,每次75mg和每日1次,每次300mg)的過程中,QTcF間期經安慰劑基線校正後時間匹配的最大平均值(95%可信上限)分別為10.7(15.3)和23.3 (28.4)毫秒。穩態給予本品75mg每天1次和300mg每天1次,使得平均穩態Cmax較推薦劑量25mg每天1次者的平均Cmax分別約高2.6倍和6.7倍。
本品與已知的可能導致尖端扭轉型室性心動過速的藥物同時使用時需謹慎。
皮膚反應和超敏反應
上市後經驗有接受含利匹韋林的治療方案後出現重症皮膚反應和超敏反應的報告,包括出現藥物反應伴嗜酸性粒細胞增多症和全身性症狀(DRESS)的病例。部分皮膚反應伴有全身症狀(例如發熱),其他皮膚反應則與器官功能障礙有關,包括肝臟血清生化指標升高。在Ⅲ期臨床試驗中,有3%接受本品治療的受試者報告出現嚴重程度≥2級的與治療相關的皮疹。未見嚴重程度為4級的皮疹報告。總體來說,大部分皮疹的嚴重程度為1級或2級,且出現在治療開始的4~6周(參見【不良反應】)。
如出現重症皮膚反應或超敏反應的症狀或體徵,包括但不限於重症皮疹或皮疹伴發熱、水皰、累及黏膜、結膜炎、面部水腫、血管性水腫、肝炎或嗜酸性粒細胞增多,需立即停止本品治療。監測包括實驗室參數在內的臨床狀況,同時給予適當的治療。
抑鬱性疾病
有報告使用本品治療的患者可能會出現與抑鬱性疾病有關的不良反應(情緒低落、抑鬱症、惡劣心境、重性抑鬱、情緒改變、消極想法、自殺企圖和自殺觀念)。出現嚴重抑鬱症狀的患者應立即求醫以評估該症狀與本品有關的可能性。若有關,則應權衡繼續治療的風險和受益。
在一項針對成人受試者的Ⅲ期臨床試驗(人數 = 1368)中,截至96周,使用本品(人數= 686)和依非韋倫(人數 = 682)後抑鬱性疾病的發生率(不管因果關係,嚴重程度)分別為9%和8%。大多數事件的嚴重程度為輕度或中度。本品組和依非韋倫組的3級和4級抑鬱性疾病的發生率(不管因果關係)都是1%。本品組或依非韋倫組的因抑鬱性疾病而終止治療的發生率為1%。報告指出每組有4例受試者出現自殺意念,而本品組有2例受試者出現自殺企圖。
在一項針對12至18歲的兒科受試者的Ⅱ期臨床試驗(人數=36)中,截至48周,接受本品的受試者抑鬱性疾病的發生率(不管因果關係,嚴重程度)為19.4%(7/36)。大多數事件的嚴重程度為輕度或中度。3級和4級抑鬱性疾病的發生率(不管因果關係)為5.6%(2/36)。無受試者因抑鬱性疾病而終止治療。報告指出1例受試者出現自殺企圖和自殺意念。
肝毒性
接受含利匹韋林治療方案的患者中曾報告過肝臟不良事件。有基礎乙型或C型肝炎或者治療之前轉氨酶明顯升高的患者使用本品後出現轉氨酶升高或惡化的風險較高。接受含利匹韋林治療方案但不存在原有肝病或其他明確風險因素的成人患者中曾報告過肝毒性病例。對於有基礎肝病(例如乙型或C型肝炎)的患者或者治療開始之前轉氨酶明顯升高的患者,建議在本品治療開始之前進行適當的實驗室檢查,並且在治療期間進行肝毒性監測。對於不存在原有肝功能障礙或其他風險因素的患者,也應考慮進行肝酶監測。
脂肪重新分布
接受抗逆轉錄病毒治療的患者有可能會出現身體脂肪的重新分布/堆積,包括向心性肥胖、 頸背部脂肪蓄積(水牛背)、周圍型消瘦、顏面部消瘦、乳房脹大和“類庫欣面容”。這些事件的發生機制及遠期結果目前尚未明確。體脂分布異常與本品套用是否存在因果關係亦未明確。
免疫重建綜合徵
接受抗逆轉錄病毒治療、聯合用藥中包括本品的患者有發生免疫重建綜合徵的報告。在初始抗逆轉錄病毒聯合用藥治療期間,患者的免疫系統可能會對無症狀或殘留的機會致病菌產生炎症反應(例如鳥型分枝桿菌複合感染、巨細胞病毒感染、傑氏肺囊蟲肺炎和肺結核),從而可能需要進一步評估和治療。
有報告指出免疫重建情況下也可發生自身免疫疾病(例如毒性瀰漫性甲狀腺腫、多肌炎和格林-巴利綜合徵),但發病時間存在較大差異,可能發生於治療開始的數月之後。
請置於兒童不易拿到處。
孕婦及哺乳期婦女用藥
妊娠級別 B
目前本品在妊娠婦女中尚無充分的嚴格隨機對照研究和藥代動力學研究。動物試驗顯示,沒有證據證明存在相關的胚胎或者胎仔毒性,或者對生殖功能有影響。妊娠和哺乳期間接受利匹韋林給藥的大鼠和兔試驗數據中,沒有證據證明存在明顯的發育毒性。在大鼠和兔中的胚胎-胎仔無明顯副作用劑量水平(NOAELs)的暴露量,分別較人體推薦劑量的暴露量(25mg每天1次)高15和70倍。妊娠期間只有潛在受益大於對胎兒的潛在危險時才能使用本品 。
哺乳患者護理
建議感染HIV的母親不應母乳餵養嬰兒以避免出生後HIV的傳播風險。對哺乳大鼠和其子代的研究表明大鼠乳汁中存在利匹韋林。尚不清楚利匹韋林是否會經人的乳汁分泌。由於存在傳播HIV的風險以及母乳餵養嬰兒發生不良事件的可能,因此建議正在服用本品的母親不要進行母乳餵養。
兒童用藥
在一項單臂、開放性、Ⅱ期臨床試驗中評價了本品的安全性、療效和藥代動力學,該試驗入組了36例12 - < 18歲、體重≥ 32 kg且未接受過抗逆轉錄病毒治療的HIV-1感染兒科受試者(參見【不良反應】、【藥理毒理】和【臨床研究】)。12歲及以上兒科患者的推薦劑量請參見【用法用量】。
目前尚未明確本品在12歲以下兒童患者中的安全性和有效性。
老年用藥
本品的臨床研究未包括足夠數量的65歲及以上的受試者,不能確認他們使用本品後的效應是否較年輕受試者有所不同。一般來說,老年患者的腎和肝功能降低,合併其他疾病或合併其他藥物治療的可能性更大,故應謹慎使用本品並密切監測。
藥物相互作用
利匹韋林主要經細胞色素P450(CYP)3A代謝。因此,具有誘導或抑制CYP3A作用的藥物可能影響利匹韋林的清除。本品和誘導CYP3A的藥物同時使用可能導致利匹韋林血漿濃度下降,並使得病毒學應答失敗和產生對利匹韋林或對NNRTIs類的耐藥。本品和抑制CYP3A藥物同時使用可能導致利匹韋林血漿濃度升高。本品與升高胃液pH的藥物同時使用可能導致利匹韋林血漿濃度下降,並使得病毒學應答失敗和產生對利匹韋林或對NNRTIs類的耐藥。
本品按劑量25mg每天1次使用時,一般不會對經CYP酶代謝的藥物產生臨床相關性影響。
表4顯示了已確定的和其他可能發生的藥物相互作用,有可能需要調整本品和/或同時使用藥物的劑量或方案。表4中還包括建議不要與本品同時使用的藥物。
表4:已確定的和其他可能發生的藥物相互作用:依據藥物相互作用研究結果或預測的相互作用對給藥劑量或方案的調整建議 (參見【藥理毒理】部分)
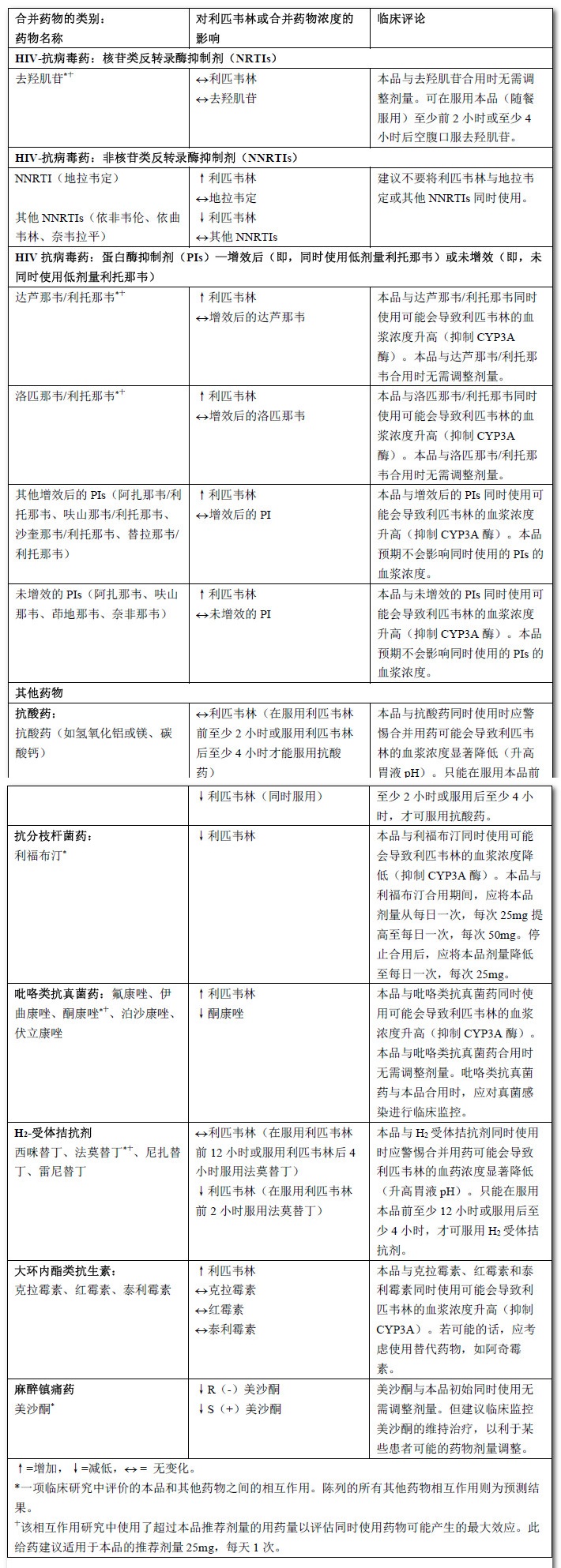
除表4中所包含的藥物外,在臨床研究中還評估了本品和下列藥物間的相互作用並且在合用時無需調整任一藥物的劑量(參見【藥理毒理】部分):對乙醯氨基酚、阿托伐他汀、氯唑沙宗、乙炔雌二醇、炔諾酮、拉替拉韋、西地那非、特拉匹韋和富馬酸替諾福韋二吡呋酯。利匹韋林未對地高辛或二甲雙胍的藥代動力學產生具有臨床意義的影響。本品與馬拉韋羅、利巴韋林或NRTIs阿巴卡韋、恩曲他濱、拉米夫定、司他夫定和齊多夫定同時使用時未觀測到具有臨床相關性的藥物相互作用。
致QT間期延長藥物
目前研究利匹韋林與導致心電圖QTc間期延長的藥物是否具有相互作用的資料有限。在一項健康受試者的研究中,超治療劑量使用利匹韋林(每日1次,每次75 mg和每日1次,每次300 mg)時曾出現受試者心電圖QTc間期延長(參見【藥理毒理】部分)。本品與已知的可能導致尖端扭轉型室性心動過速的藥物同時使用時需謹慎。
藥物過量
目前尚無特異性解毒藥可用於治療本品過量。有關人過量使用本品的經驗有限。過量使用本品的治療包括一般支持性措施[監視生命體徵和ECG(QT間期)]及觀察患者的臨床狀況。給予活性炭也可能有助於清除未吸收的活性成分。由於利匹韋林與血漿蛋白高度結合,因此透析很可能無法顯著清除這些活性成分。
臨床試驗
治療初治成人受試者
本品的療效證據是基於對兩項在成年抗逆轉錄病毒初治受試者中開展的隨機、雙盲、活性對照的Ⅲ期試驗TMC278-C209(ECHO)和TMC278-C215(THRIVE) 的48周和96周數據分析得出。HIV-1感染的抗逆轉錄病毒初治受試者在納入Ⅲ期試驗時檢測了血漿的HIV-1 RNA≥5000拷貝/mL,並篩選了N(t)RTI的易感性以及檢查了是否缺乏特異性的NNRTI 耐藥相關性突變(RAMs)。除了背景治療方案(BR)外,這些Ⅲ期試驗設計均相同。在TMC278-C209試驗中,將BR固定為N(t)RTIs,富馬酸替諾福韋二吡呋酯加恩曲他濱。在TMC278-C215試驗中,BR由研究者選擇的兩種N(t)RTIs組成:富馬酸替諾福韋二吡呋酯加恩曲他濱或齊多夫定加拉米夫定或阿巴卡韋加拉米夫定。這兩項試驗,均依據篩選時的病毒載量進行隨機分層。TMC278-C215試驗也同時按N(t)RTI BR進行了隨機分層。
TMC278-C209和TMC278-C215試驗的匯總分析發現,本品組和依非韋倫組間的人口統計學和基線特徵均衡。表5顯示了本品和依非韋倫組中受試者的部分人口統計學和基線疾病特徵。
表5:TMC278-C209和TMC278-C215試驗中成年HIV-1感染的抗逆轉錄病毒初治受試者的人口統計學和基線疾病特徵(匯總分析)
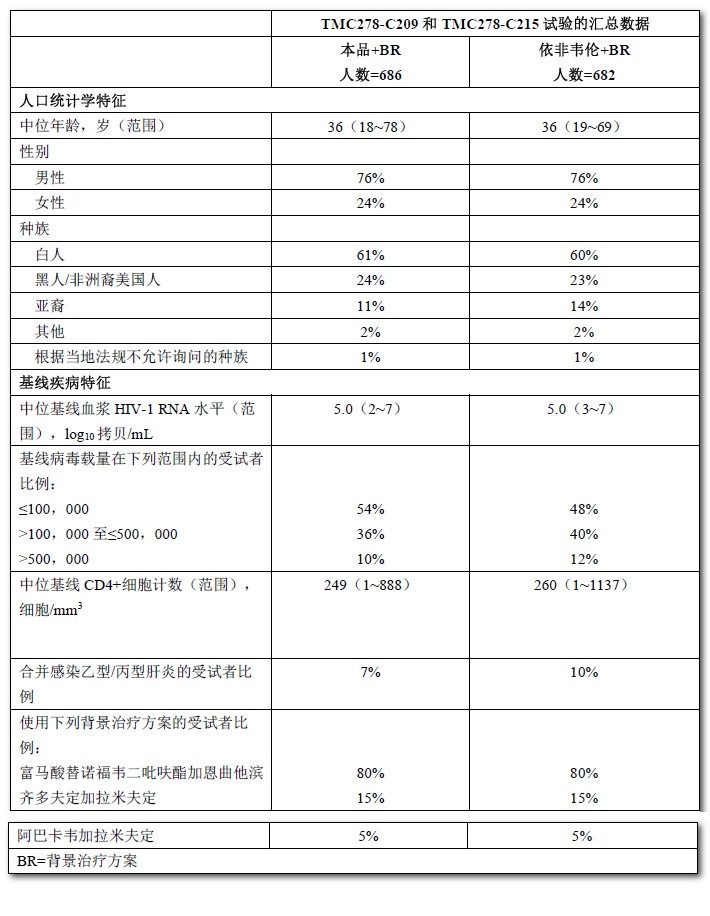
表6顯示了使用本品25mg每天1次治療的受試者第96周匯總分析的療效結果。第96周時,本品組的病毒學失敗發生率高於依非韋倫組。由病毒學失敗和不良事件導致的中止治療大多發生於前48周治療期間。
表6:TMC278-C209和TMC278-C215隨機治療研究(匯總數據)第96周的病毒學結果
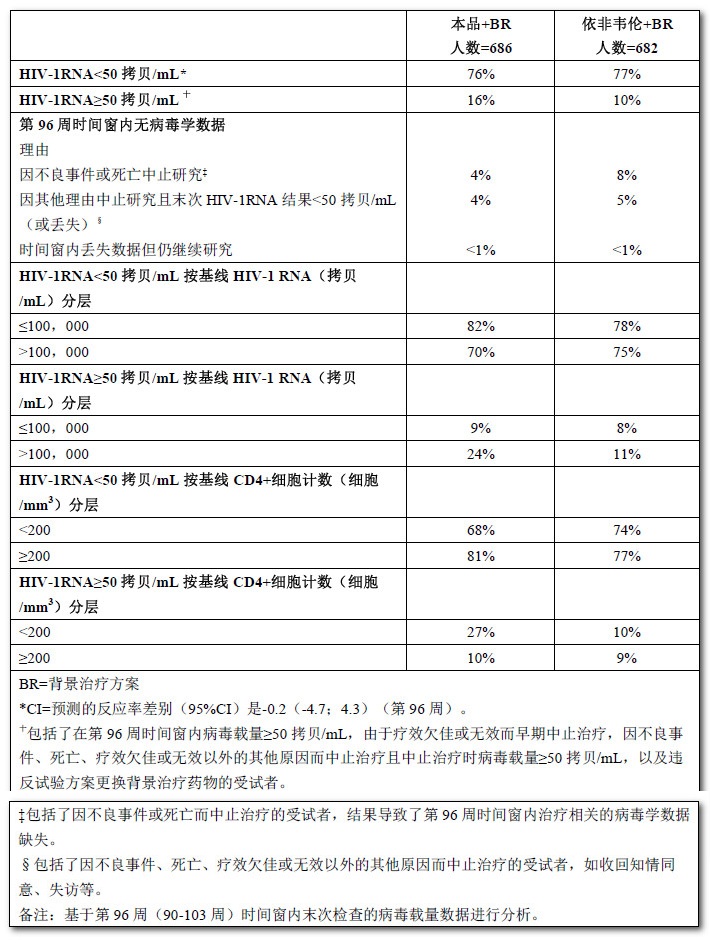
TMC278-C209和TMC278-C215試驗經過96周治療後的匯總分析發現,本品治療受試者平均CD4+細胞計數從基線增加至228細胞/mm3,而依非韋倫治療受試者為219細胞/mm3。
TMC278-C204研究是一項針對成年HIV-1感染的抗逆轉錄病毒初治受試者的隨機、活性對照、Ⅱb期試驗。該研究由兩部分組成:第一部分為初始的96周,是部分設盲的劑量摸索[本品劑量設盲];之後是第二部分,長期、開放性研究。96周后,最初隨機化接受本品3個劑量之一的受試者全部轉為服用本品25mg每天1次。在兩部分研究中,對照組中的受試者接受依非韋倫600mg每天1次加一種BR治療。BR由研究者選擇的兩種N(t)RTIs組成:齊多夫定加拉米夫定或富馬酸替諾福韋二吡呋酯加恩曲他濱。
TMC278-C204研究納入了368名成年HIV-1-感染的初治受試者,這些受試者的血漿HIV-1 RNA≥5000拷貝/ml,並且在之前接受過≤2周的一種N(t)RTI或蛋白酶抑制劑治療,但既往未接受過NNRTIs治療,經篩選認為對N (t)RTI易感且無特異性NNRTI 耐藥相關性突變(RAMs)。
96周時,接受本品25mg治療的受試者(人數 = 93)與接受依非韋倫治療的受試者(人數 = 89)HIV-1 RNA<50拷貝/ml的比例分別為76%和71%。接受本品25 mg治療的受試者CD4+計數從基線平均增加至146細胞/mm3,接受依非韋倫治療的受試者則升高至160細胞/mm3。
240周時,與對照組受試者的57%(51/89)相比,最初接受本品25mg 每天1次的受試者達到HIV-1 RNA < 50拷貝/mL的比例為60%(56/93)。
治療初治兒科受試者(12 - < 18歲)
在針對12 - < 18歲、體重≥ 32 kg且未接受過抗逆轉錄病毒治療的HIV-1感染兒科患者進行的一項單臂、開放性、Ⅱ期臨床試驗TMC278-C213中,評價了本品(25 mg每日一次)與含2種NRTI的研究者選定背景治療方案(BR)聯用時的藥代動力學、安全性、耐受性和療效。試驗入組了36例受試者,完成至少48周治療。這36例受試者的中位年齡為14.5歲(範圍:12-17歲),其中女性占55.6%,88.9%為黑人,11.1%為亞洲人。
在療效分析中,大多數受試者(75%;28/36)的基線HIV RNA <100,000拷貝/mL。上述28例受試者基線時的中位血漿HIV-1 RNA為44,250拷貝/mL(範圍:2,060-92,600拷貝/mL),中位CD4+細胞計數為445.5細胞/mm3(範圍:123-983 細胞/ mm3)。
第48周時,基線HIV RNA≤100,000拷貝/mL和>100,000拷貝/mL的受試者中分別有79%(22/28)和50%(4/8)達到HIV-1 RNA<50拷貝/mL。基線病毒載量≤100,000拷貝/mL和>100,000拷貝/mL的受試者中分別有21.4%(6/28)和37.5%(3/8)發生病毒學失敗。第48周時,CD4+細胞計數相對於基線的平均增幅為201.2細胞/ mm3。
藥理毒理
藥理作用
作用機制
利匹韋林是一種特異性作用於1型人類免疫缺陷病毒 (HIV-1)的二芳基嘧啶非核苷類反轉錄酶抑制劑(NNRTI),並通過非競爭性抑制HIV-1反轉錄酶(RT)而抑制HIV-1的複製。利匹韋林不抑制人類細胞DNA聚合酶α, β和γ。
抗病毒活性
在急性感染的T細胞系中,利匹韋林顯示出對實驗室培養的野生型HIV-1病毒株具有抗病毒活性,其對HIV-1IIIB的中位EC50值為0.73nM(0.27ng/mL)。對細胞培養的HIV-2病毒株,利匹韋林顯示的抗病毒活性有限,其中位EC50值為5220nM(範圍:2510至10830nM)(920至3970ng/mL)。
利匹韋林也顯示出對M組HIV-1(亞型A、B、C、D、F、G、H)的主要分離株具有廣譜的抗病毒活性,其EC50值範圍為0.07至1.01nM(0.03至0.37ng/mL),而對O組的主要分離株活性較低,其EC50值範圍為2.88至8.45nM(1.06至3.10ng/mL)。
利匹韋林與以下藥物聯合使用時不會拮抗其抗病毒活性:NNRTIs:依非韋倫、依曲韋林或奈韋拉平;N(t)RTIs:阿巴卡韋、去羥肌苷、恩曲他濱、拉米夫定、司他夫定、替諾福韋或齊多夫定;PIs:氨普那韋、阿扎那韋、達蘆那韋、茚地那韋、洛匹那韋、奈非那韋、利托那韋、沙奎那韋或替拉那韋;融合抑制劑:恩夫韋肽;CCR5共同受體拮抗劑馬拉韋羅,或整合酶鏈轉移抑制劑拉替拉韋。
耐藥
在不同來源和亞型的野生型HIV-1以及NNRTI耐藥的HIV-1的細胞培養物中選擇利匹韋林-耐藥病毒株。當顯現或具有利匹韋林表型易感性降低時的最常見胺基酸置換通常包括:L100I,K101E,V106I和A,V108I,E138K和G、Q、R,V179F和I,Y181C和I,V189I,G190E,H221Y,F227C,M230I和L。
初治成人受試者
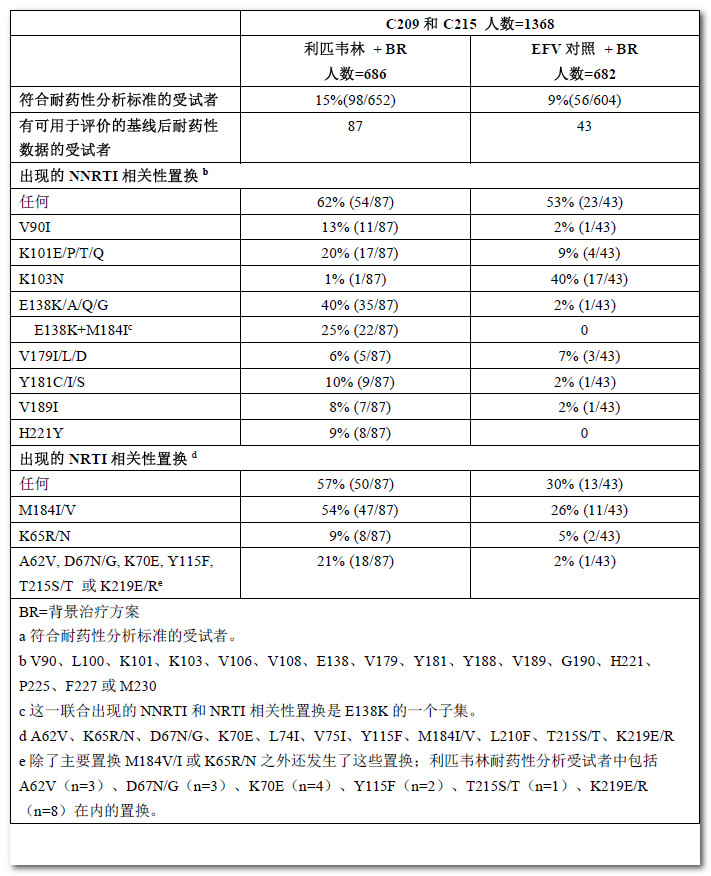
在對C209和C215的為期96周的Ⅲ期研究的耐藥性數據進行的匯總分析中,利匹韋林組受試者的病毒較依非韋倫組更易出現耐藥性,並且取決於基線病毒載量。在對耐藥性數據進行的匯總分析後,利匹韋林組中58%(57/98)的符合耐藥性分析標準的受試者(耐藥性分析受試者)的病毒對利匹韋林存在基因型和/或表型耐藥,與之相比依非韋倫組中該比例為45%(25/56)。此外,利匹韋林組中52%(51/98)的耐藥性分析受試者的病毒對於背景治療藥物(恩曲他濱、拉米夫定、替諾福韋、阿巴卡韋或齊多夫定)存在基因型和/或表型耐藥,與之相比依非韋倫組中該比例為23%(13/56)。
對受試者的病毒進行的利匹韋林耐藥性分析中出現的NNRTI相關性置換,包括V90I、K101E/P/T、E138K/A/Q/G、V179I/L、Y181C/I、V189I、H221Y、F227C/L和M230L,這些與利匹韋林表型變化倍數範圍相關,可達2.6~621倍。E138K置換在利匹韋林治療期間最常出現,通常與M184I置換聯合出現。與依非韋倫耐藥性分析受試者相比,恩曲他濱和拉米夫定耐藥性相關置換M184I或V以及NRTI耐藥性相關置換(K65R/N、A62V、D67N/G、K70E、Y115F、T215S/T或K219E/R)更常出現於利匹韋林耐藥性分析受試者(見表7)。
在對受試者的病毒進行的耐藥性分析中,與基線病毒載量>100,000拷貝/mL的受試者相比,NNRTI和NRTI耐藥相關性置換較少出現於基線病毒載量≤100,000拷貝/mL的受試者:NNRTI耐藥相關性置換分別為74%(40/54)和26%(14/54),NRTI耐藥相關性置換分別為78%(39/50)和22%(11/50)。在恩曲他濱/拉米夫定和替諾福韋耐藥相關性置換方面也觀察到上述差異:M184I/V分別為77%(36/47)和23%(11/47),K65R/N分別為100%(8/8)和0%(0/8)。此外,在對受試者的病毒進行的耐藥性分析中,與基線CD4+細胞計數<200細胞/mm3的受試者相比,NNRTI和NRTI耐藥相關性置換較少出現於基線CD4+細胞計數≥200細胞/mm3的受試者:NNRTI耐藥相關性置換分別為63%(34/54)和37%(20/54),NRTI耐藥相關性置換分別為72%(36/50)和28%(14/50)。
表7:Ⅲ期TMC278-C209和TMC278-C215試驗的第96周匯總數據中常出現的反轉錄酶置換的耐藥性分析受試者a的比例
交叉耐藥
NNRTI定點突變株病毒
在使用NNRTIs的患者中曾觀察到存在交叉耐藥。單個NNRTI相關性K101P、Y181I和Y181V位點的置換會使利匹韋林易感性分別降低52倍、15倍和12倍。與單獨E138K的置換相比(2.8倍),E138K和M184I的聯合置換可明顯降低利匹韋林的易感性(6.7倍)。K103N的置換本身不會降低利匹韋林的易感性,但同時存在K103N和L100I會導致利匹韋林的易感性降低7倍。同時存在2或3個NNRTI耐藥相關性置換位點的突變株(所占比例分別為38%和66%)可使利匹韋林的易感性降低(倍數變化範圍為3.7~554)。
初治HIV-1感染成人受試者
鑒於全部已有的細胞培養和臨床資料, 基線時存在下列任一胺基酸置換的,很可能會降低利匹韋林的抗病毒活性:K101E、K101P、E138A、E138G、E138K、E138R、E138Q、V179L、Y181C、Y181I、Y181V、H221Y、F227C、M230I或M230L。
病毒學失敗和發生利匹韋林耐藥後很可能對依非韋倫、依曲韋林和/或奈韋拉平產生交叉耐藥性。在TMC278-C209和TMC278-C215的Ⅲ期為期96周的臨床試驗的匯總分析中,有基線後耐藥性數據的87例利匹韋林耐藥性分析受試者中,50例(57%)受試者的病毒的利匹韋林易感性降低(變化≥2.5倍)。其中86%(n= 43/50)對依非韋倫耐藥(變化≥3.3倍),90%(n= 45/50)對依曲韋林耐藥(變化≥3.2倍),62%(n= 31/50)對奈韋拉平耐藥(變化≥6倍)。依非韋倫組的21例依非韋倫耐藥性分析受試者中,3(14%)例的病毒對依曲韋林和利匹韋林耐藥,95%(n= 20/21)對奈韋拉平耐藥。與依非韋倫治療失敗的受試者相比,本品治療後發生病毒學失敗的受試者的病毒出現了更多的NNRTI耐藥相關性置換,致使對NNRTI類出現了更多地交叉耐藥,對所有NNRTIs出現交叉耐藥的可能性也較高。
毒理研究
遺傳毒性
利匹韋林的Ames試驗、小鼠淋巴瘤細胞試驗和小鼠微核試驗結果均為陰性。
生殖毒性
在大鼠中進行的一項研究顯示,當利匹韋林劑量最高至400mg/kg/天出現母體毒性時,未顯示對交配或生育力產生影響。該劑量下的暴露量高於人體推薦劑量(25mg每天1次)下暴露量的近40倍。
大鼠和兔在妊娠和哺乳期間給予利匹韋林,未見明顯的發育毒性,胚胎-胎仔無明顯副作用劑量水平(NOAEL)下的暴露量分別較成人推薦劑量的暴露量(25mg每天1次)高15和70倍。
致癌性
在小鼠和大鼠最長104周經口給予利匹韋林(灌胃法)的致癌試驗中,小鼠劑量為20、60和160mg/kg/天,大鼠劑量為40、200、500和1500mg/kg/天。大鼠試驗中未見藥物相關腫瘤的發生。在雄性和雌性小鼠中可見肝細胞腫瘤,該發現可能是嚙齒類特異性的。致癌性試驗最低試驗劑量下利匹韋林的全身暴露量(基於AUC)分別是人體推薦劑量(25mg 每天1次)下暴露量的21倍(小鼠)和3倍(大鼠)。
藥代動力學
成人的藥代動力學
已經對成年健康受試者和成年HIV-1感染的抗逆轉錄病毒初治受試者評價了利匹韋林的藥代動力學特性。利匹韋林的暴露量在HIV-1感染的受試者中通常低於健康受試者。
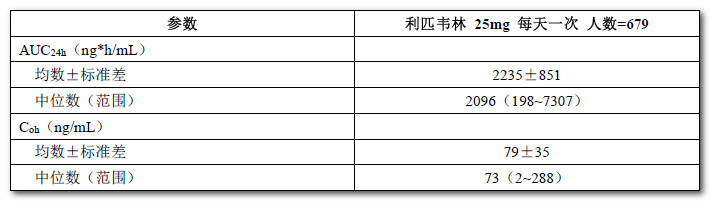
表8:HIV-1感染的抗逆轉錄病毒初治成人患者利匹韋林(25mg 每天一次)的群體藥代動力學估算值(來自為期96周的Ⅲ期試驗匯總數據)
吸收和生物利用度
口服給藥後,利匹韋林一般在4~5小時內達到最大血漿濃度。目前本品的絕對生物利用度尚未知曉。
食物對口服吸收的影響
與進食正常熱量(533 kcal)或高脂高熱量(928 kcal)的膳食相比,空腹條件下服用本品時利匹韋林的暴露量約降低40%。當本品僅與富含蛋白質的營養性飲品同時服用時,其暴露量比隨餐服用時低50%。
分布
體外試驗顯示,利匹韋林與血漿蛋白的結合率大約是99.7%,主要與白蛋白結合。目前尚未在人體中對利匹韋林在血漿之外(如,腦脊液,生殖道分泌物)的分布進行評估。
代謝
體外試驗顯示,利匹韋林主要在細胞色素P450(CYP)3A系統的介導下進行氧化代謝。
清除
利匹韋林的終末清除半衰期大約是50小時。單劑量口服給予14C-利匹韋林後,在糞便和尿液中可分別回收到平均85%和6.1%的放射性物質。在糞便中,未代謝的利匹韋林平均占給藥劑量的25%。在尿液中,只能檢測到微量未代謝的利匹韋林(< 劑量的1%)。
特殊人群
肝功能損傷
利匹韋林主要通過肝臟進行代謝和清除。在一項8例輕度肝損傷(Child-Pugh評分A級)受試者與8例無肝損傷受試者對照,8例中度肝損傷(Child-Pugh評分B級)受試者與8例無肝損傷受試者對照的研究中,輕度肝損傷受試者多次給藥後利匹韋林暴露量增高47%,中度肝損傷受試者增高5%。輕度或中度肝損傷患者中無需調整劑量。目前尚未在重度肝損傷(Child-Pugh評分 C級)患者中進行有關本品的研究。
乙型和/或C型肝炎病毒合併感染
群體藥代動力學分析顯示,乙型和/或C型肝炎病毒合併感染不會對利匹韋林的暴露產生臨床相關性影響。
腎功能損傷
群體藥代動力學分析顯示,輕度腎功能損傷的HIV-1感染受試者與腎功能正常的HIV-1感染受試者利匹韋林的暴露量相似。輕度腎損傷患者無需調整劑量。由於繼發於腎功能不全的藥物吸收、分布和代謝的改變,可能會導致利匹韋林的血漿濃度升高,但目前中度或重度腎損傷患者或晚期腎病患者的利匹韋林藥代動力學資料有限或缺乏。利匹韋林對中度腎損傷的HIV-1感染受試者帶來的潛在影響預期不具有臨床相關性,故這些患者無需調整劑量。重度腎損傷或終末期腎病的患者應謹慎使用利匹韋林並加強對不良反應的監控。由於利匹韋林與血漿蛋白高度結合,因此很可能無法通過血液透析或腹膜透析得到顯著清除。
性別
在男性和女性之間尚未觀察到具有臨床相關性的利匹韋林藥代動力學差異。
種族
HIV感染患者的群體藥代動力學分析顯示,種族不會對利匹韋林的暴露產生臨床相關性影響。
兒科患者
12 - < 18歲且未接受過抗逆轉錄病毒治療的HIV-1感染兒科患者接受本品(25 mg每日一次)治療時,其利匹韋林藥代動力學與未接受過抗逆轉錄病毒治療的HIV-1感染成人患者接受本品(25 mg每日一次)治療時的結果相似。試驗C213表明,體重(33~93 kg)未對兒科受試者中的利匹韋林藥代動力學產生有臨床意義的影響。
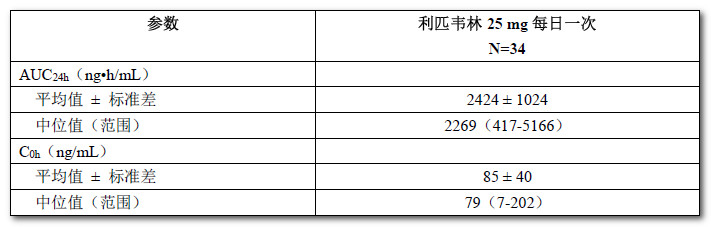
表9:12 - < 18歲且未接受過抗逆轉錄病毒治療的HIV-1感染兒科患者接受本品(25 mg每日一次)治療時的群體藥代動力學估計值(來自為期48周的Ⅱ期試驗數據)
尚未確定利匹韋林在12歲以下兒童患者中的藥代動力學參數和給藥的推薦劑量。
藥物的相互作用
利匹韋林主要經細胞色素P450(CYP)3A代謝。因此,具有誘導或抑制CYP3A作用的藥物可能影響利匹韋林的清除。本品和誘導CYP3A的藥物同時使用可能導致利匹韋林血漿濃度下降,並使得病毒學應答失敗和產生對利匹韋林或對NNRTIs類的耐藥。本品和抑制CYP3A藥物同時使用可能導致利匹韋林血漿濃度升高。本品與升高胃液pH的藥物同時使用可能導致利匹韋林血漿濃度下降,並使得病毒學應答失敗和產生對利匹韋林或對NNRTIs類的耐藥。
本品按劑量25 mg每天1次使用時,可能並不會對經CYP酶代謝的藥物產生臨床相關性影響。
目前已完成了本品與可能同時使用的藥物或為探討藥代動力學相互作用而常用作探針的其他藥物的相互作用研究。表10中總結了與其他藥物同時使用對利匹韋林的Cmax,AUC和Cmin值的影響(其他藥物對本品的影響)。表11中總結了與本品同時使用對其他藥物的Cmax,AUC和Cmin值的影響(本品對其他藥物的影響)。相關臨床建議信息見藥物相互作用。
表10:藥物相互作用:同時使用其他藥物時利匹韋林顯現的藥代動力學參數
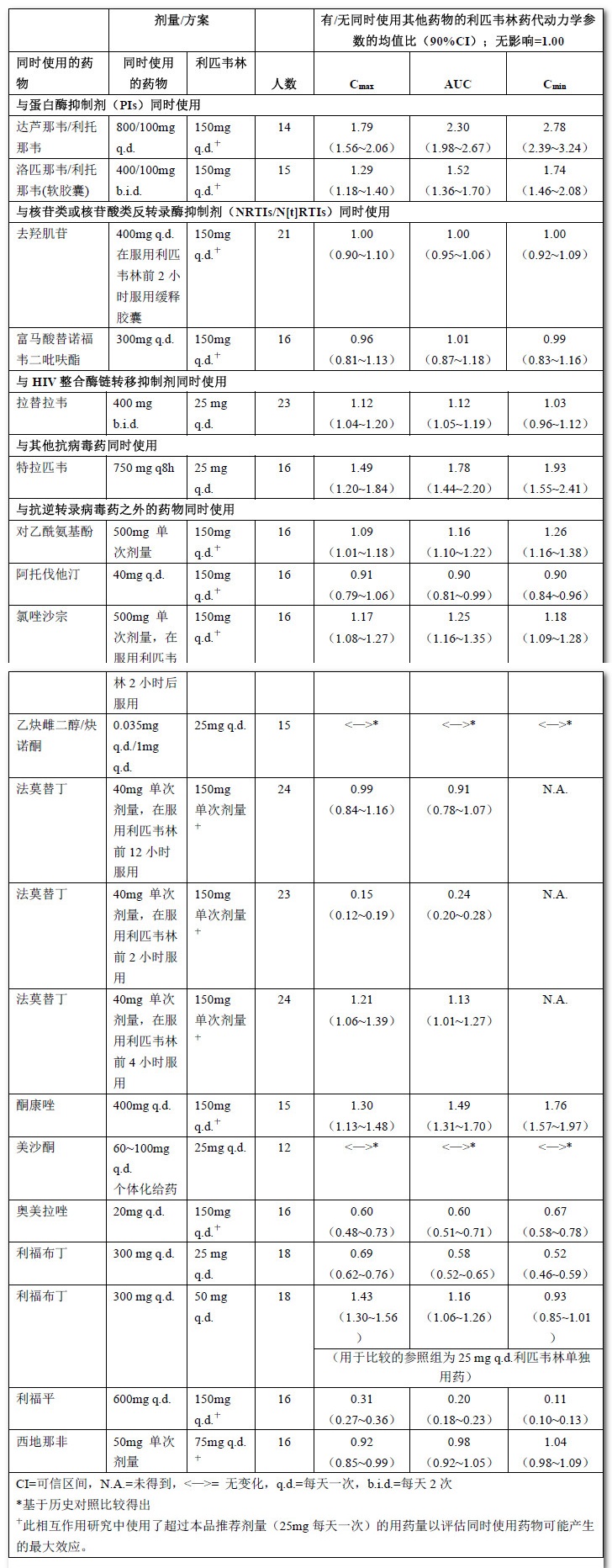
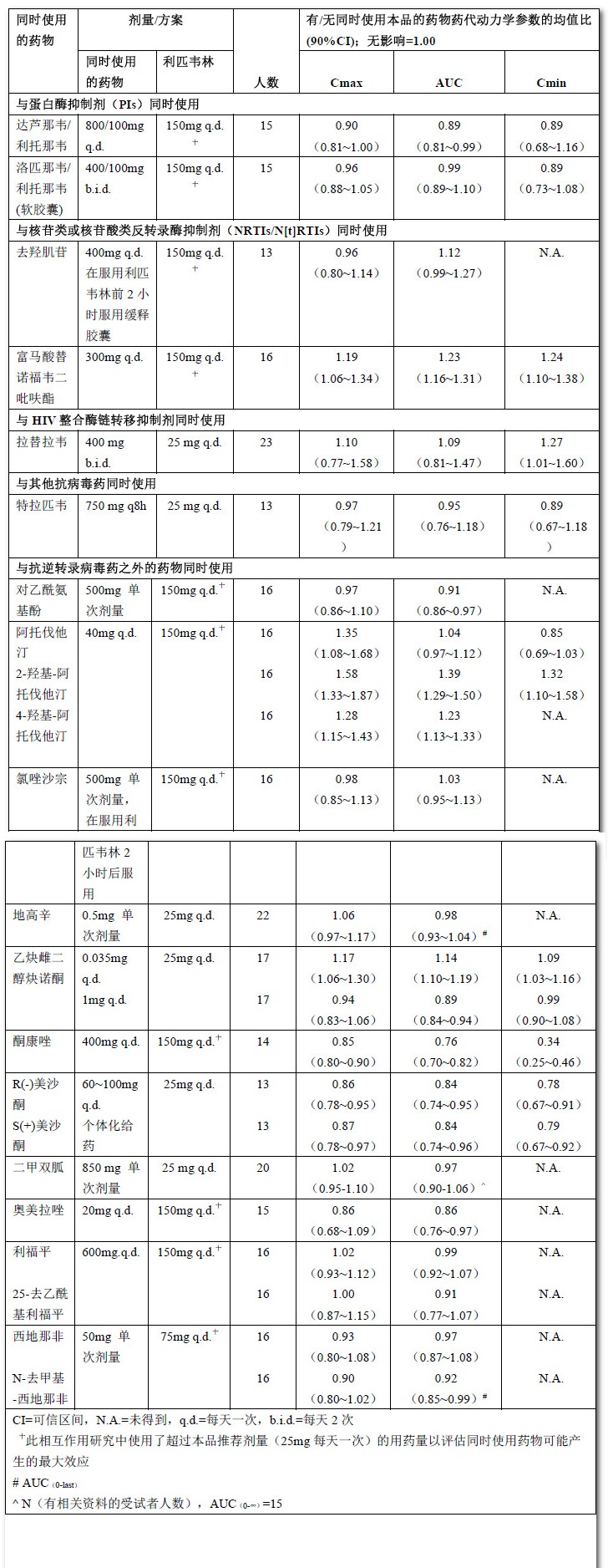
表11:藥物相互作用:與本品同時使用的藥物顯現的藥代動力學參數
貯藏
避光,不超過30 ℃密閉保存。
包裝
高密度聚乙烯塑膠瓶裝,配有兒童不易打開的瓶蓋。30片/瓶/盒。
有效期
36個月
執行標準
進口藥品註冊標準JX20120187
進口藥品註冊證號
H20171075
