《保健食品新功能技術評價實施細則》由市場監管總局組織制定。
基本介紹
- 中文名:保健食品新功能技術評價實施細則
- 發布單位:市場監管總局
內容解讀
《保健食品新功能技術評價實施細則》由市場監管總局組織制定。






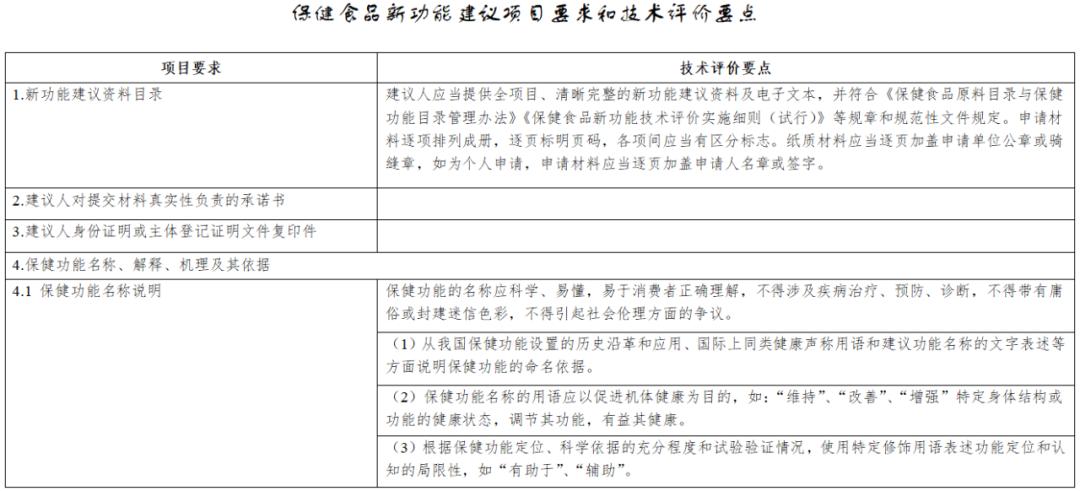
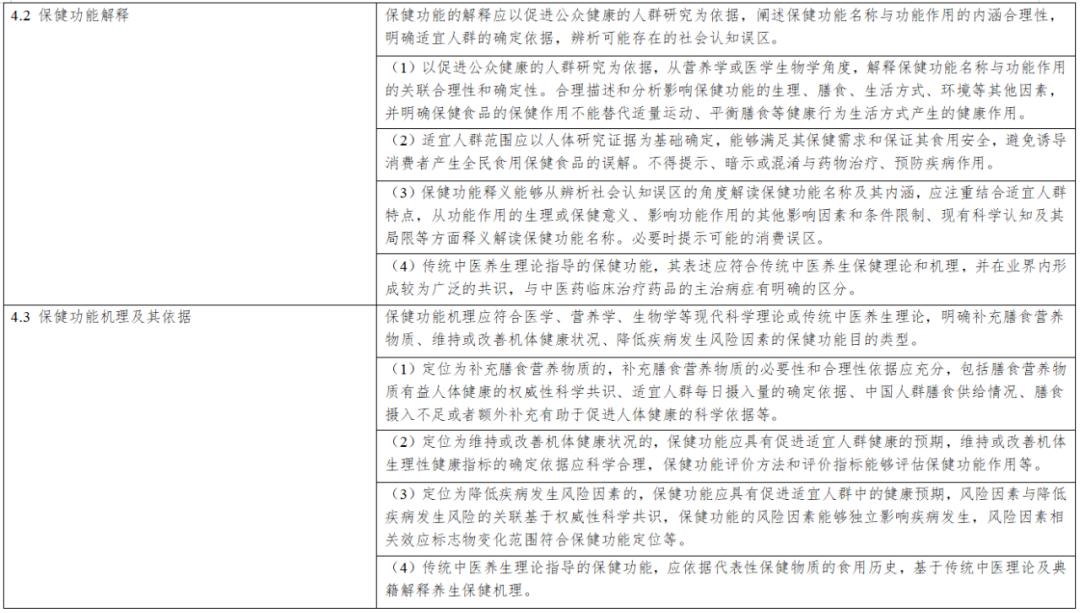
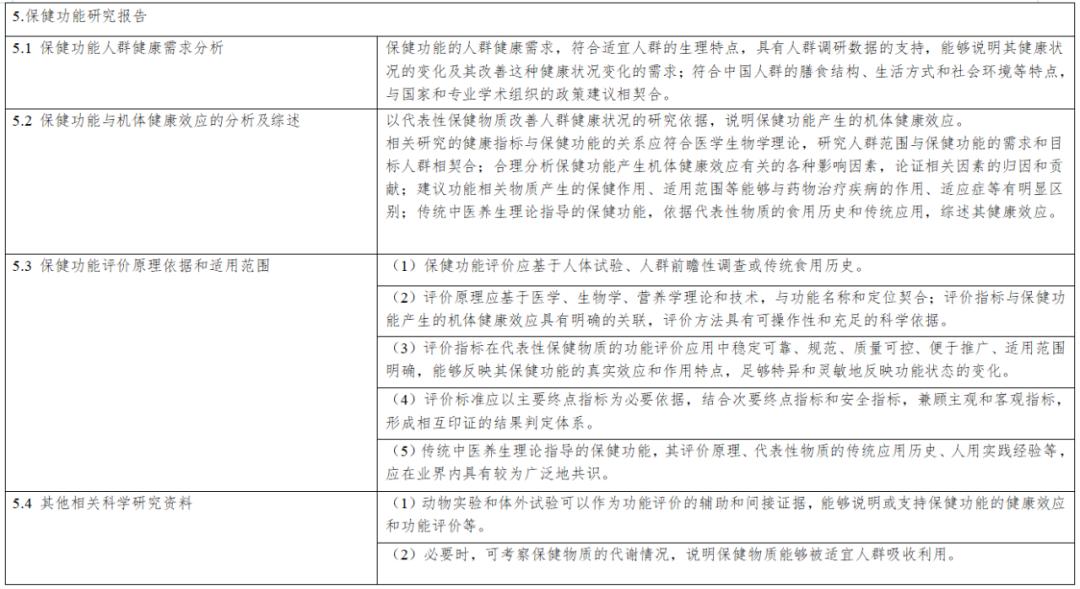
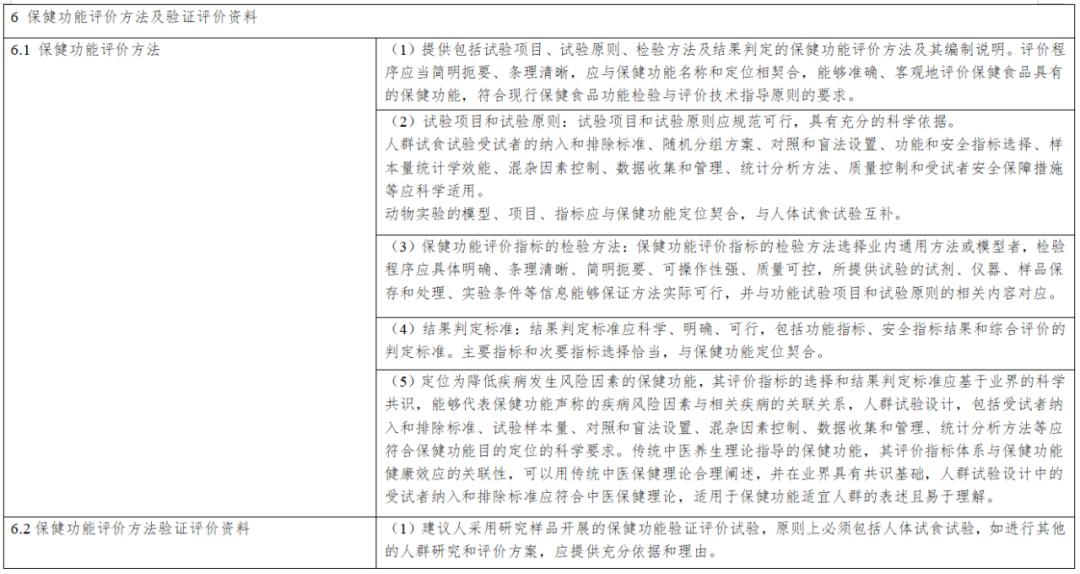
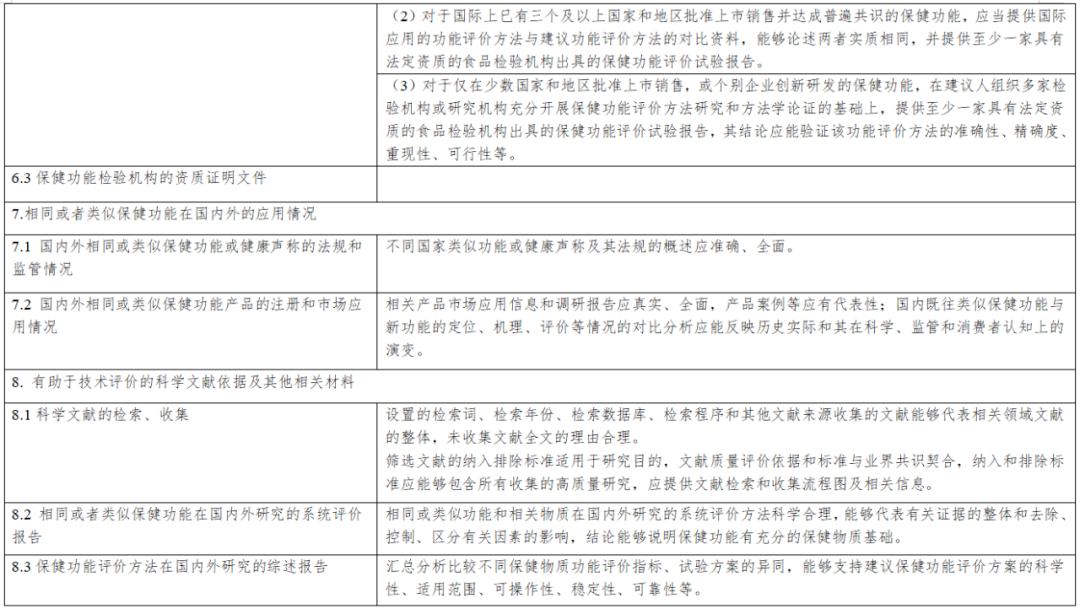
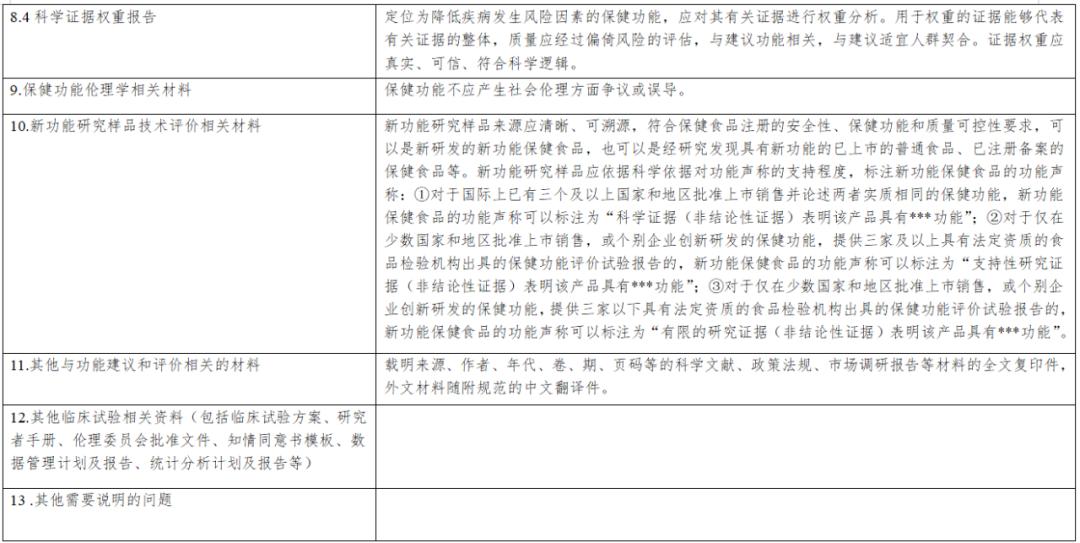
《保健食品新功能技術評價實施細則》由市場監管總局組織制定。內容解讀第一章 總則第一條 為規範保健食品新功能的技術評價工作,根據《中華人民共和國食品安全法》《保健食品原料目錄與保健功能目錄管理辦法》等法律和規章,制定本細則...
《實施細則》從“總則”“新功能研究”“材料接收”“技術評價”“上市後評價”“附則”等6個方面進行了詳細論述,鼓勵引導企業、高校、科研機構等社會力量開展功能創新和產品研發,進一步促進產業高質量發展。《實施細則》是從制度上改革...
第二章技術審評要點 第五條 申報資料應當真實、合法,其內容及形式應符合保健食品申報受理規定的要求。第六條 研發報告應當是產品整體研發思路和過程的反映,應當詳細闡述研發思路,包括保健功能的篩選、劑型選擇、工藝路線設計及工藝參數...
熱點六:保健食品新功能——制度“破冰”賦能產業創新 解讀專家:謝明勇,中國工程院院士、中國食品科學技術學會副理事長、南昌大學食品科學與資源挖掘全國重點實驗室主任 發布實施的24項保健食品功能聲稱與《保健食品新功能技術評價實施細則(...
是指國家食品藥品監督管理局根據申請人的申請,依照法定程式、條件和要求,對申請註冊的保健食品的安全性、有效性、質量可控性以及標籤說明書內容等進行系統評價和審查,並決定是否準予其註冊的審批過程;包括對產品註冊申請、變更申請和技術...
(四)保健功能評價報告;(五)保健食品的功效成分名單,以及功效成分的定性和/或定量檢驗方法、 穩定性試驗報告。因在現有技術條件下,不能明確功效成分的,則須提交食品中與保健功能相關的主要原料名單;(六)產品的樣品及其衛生學檢驗...
第九章 保健食品功能學評價 一、增強免疫力功能檢驗方法 二、輔助降低血脂功能檢驗方法 三、輔助降血糖功能檢驗方法 四、抗氧化功能檢驗方法 五、輔助改善記憶功能動物實驗設計及準備過程 六、緩解視疲勞功能檢驗方法 七、促進排鉛功能檢驗...
允許保健食品聲稱的保健功能目錄(以下簡稱保健功能目錄),是指依照本辦法制定的具有明確評價方法和判定標準的保健功能信息列表。第四條 保健食品原料目錄和保健功能目錄的制定、調整和公布,應當以保障食品安全和促進公眾健康為宗旨,遵循依法...
第一條 為加強和規範保健食品審評專家(以下簡稱審評專家)的聘用與管理,促進審評工作科學化和規範化,保證技術審評的公正、公平、公開,根據《保健食品註冊管理辦法(試行)》,制定本辦法。第二條 國家食品藥品監督管理局負責審評專家的...
以信息化建設為依託,建立並完善“技術審評機構、核查機構、覆核檢驗機構和安全功能驗證機構”四類機構的工作規範和有效銜接,統籌推進保健食品新註冊監管工作制度的依法開展和有效實施。 (十)發揮市場資源配置作用和優勢。充分發揮社會機構...
各省、自治區、直轄市食品藥品監督管理局,總局保健食品審評中心: 為規範保健食品註冊行為,進一步提高工作效率,現就增設網上發放保健食品技術審評意見通知書(以下簡稱審評意見通知書)的有關事項通知如下:中文...
《保健食品功能評價實驗教程》可作為高等院校食品科學與工程、食品質量與安全、食品營養與檢測、食品安全與檢測等專業教學用書,也可供相關企業技術人員參考。圖書目錄 第一章 概述 一、功能食品的概念 二、功能食品的發展 三、功能食品與...
(二)受國家食品藥品監督管理局委託,開展保健食品註冊相關政策的研究;(三)開展保健食品技術審評諮詢工作;(四)承擔國家食品藥品監督管理局交付的保健食品註冊技術方面的其他任務。第八條 參加保健食品審評的專家由國家食品藥品監督...
(八)以死菌和/或其代謝產物為主要功能因子的保健食品應提供功能因子或特徵成分的名稱和檢測方法。(九)生產的技術規範和技術保證。(十)生產條件符合《保健食品生產良好規範》的證明檔案。(十一)使用《可用於保健食品的益生菌菌種名單》...
第十八條 國家食品藥品監督管理局應當根據科學技術的發展和需要適時調整保健食品的功能範圍、保健食品的評價和檢驗方法以及審評技術規定等,並予以公告。第二節 產品註冊申請與審批 第十九條 產品註冊申請包括國產保健食品註冊申請和進口...
第二十一條 檢驗機構收到申請人提供的樣品和有關資料後,應當按照國家食品藥品監督管理局頒布的保健食品檢驗與評價技術規範,以及其他有關部門頒布和企業提供的檢驗方法對樣品進行安全性毒理學試驗、功能學試驗、功效成分或標誌性成分檢測、...
第三條 保健食品註冊,是指食品藥品監督管理部門根據註冊申請人申請,依照法定程式、條件和要求,對申請註冊的保健食品的安全性、保健功能和質量可控性等相關申請材料進行系統評價和審評,並決定是否準予其註冊的審批過程。保健食品備案,是...
第二十五章 保健食品化學檢測方法控制 附錄1 關於進一步加強保健食品註冊有關工作的通知(國食藥監許[2010]100號)附錄2 關於印發保健食品再註冊技術審評要點的通知(國食藥監許[2010]390號)附錄3 關於印發保健食品註冊申報資料項目要求補充...
實施備案管理的產品,生產許可審查時應依據《保健食品原料目錄與保健功能目錄》中關於產品的配方、生產工藝、質量標準等產品技術要求和產品檢驗信息,開展生產許可審查。生產許可應重點審查企業的實際生產條件和質量保障能力是否滿足產品註冊與...
《保健食品功效成分檢測技術與方法》含總論和各論兩部分。總論包括保健食品概述、國內外保健食品發展現狀、保健食品原輔料管理、保健食品功效成分或標誌性成分、保健食品有關的標準、技術規範;各論介紹了200餘種保健食品功效性成分的含量測定...
