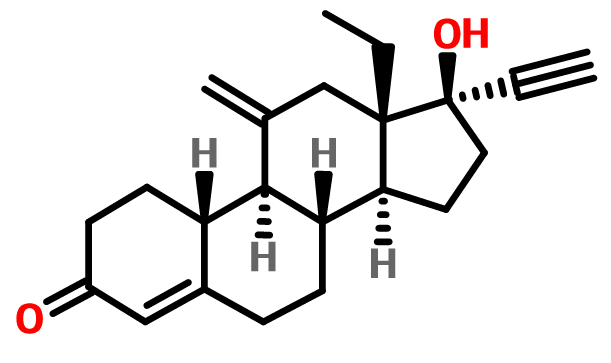
依託孕烯學名為3-酮去氧孕烯,是一種白色或近乎於白色結晶粉末 ,分子式C22H28O2 ,密度:1.13 g/cm3 ,熔點:182-184ºC ,沸點:473.1ºC at 760 mmHg ,是單孕激素皮下植入劑。
基本介紹
- 中文名:依託孕烯
- 外文名:etonogestrel
- CAS號:54048-10-1
- 密度:1.13 g/cm3
- 熔點:182-184ºC
化合物簡介,基本信息,物化性質,安全信息,適應症,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年患者用藥,藥物相互作用,藥物過量,藥理作用,藥代動力學,研發歷程,指南推薦,臨床數據研究,
化合物簡介
基本信息
中文名稱:依託孕烯
中文別名:3-酮去氧孕烯; 3-酮-去氧孕烯;
英文名稱:etonogestrel
英文別名:Etonoestrel; 3-Keto-desogestrel 3-Oxo-desogestrel;[3H]-3-keto-Desogestrel; Etonogestrel; Implanon;3-oxodesogestrel;3-keto-Desogestrel; org3236; 3-Ketodesogestrel,3-Oxodesogestrel,Org-3236,Implanon; Desogestrel Related Compound C (25 mg) (3-Keto-desogestrel);
CAS號:54048-10-1
分子式:C22H28O2
結構式: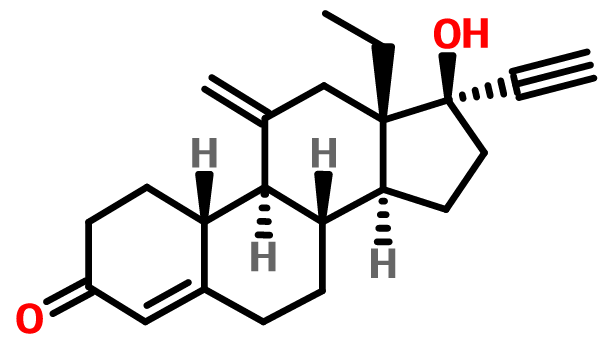

分子量:324.45700
精確質量:324.20900
PSA:37.30000
LogP:4.04870
物化性質
外觀與性狀:白色或近乎於白色結晶粉末
密度:1.13 g/cm3
熔點:182-184ºC
沸點:473.1ºC at 760 mmHg
閃點:201.1ºC
折射率:1.574
儲存條件:-20ºC
安全信息
符號: GHS08
信號詞:危險
危害聲明:H351; H360
警示性聲明:P201; P281; P308 + P313
適應症
避孕。
用法用量
每支植入劑含68mg依託孕烯:釋放率在植入後5-6周內約為60-70µg/天,第一年末下降到約35-45µg/天,第2年末下降到約30-40µg/天,第3年末下降到約25-30µg/天。新給藥器的設計使操作可單手完成只需一隻手,並使得正確皮下植入本品更為便利。
在植入本品前應該先排除妊娠。
強烈建議醫療專業人員在實施本品植入或取出操作前參加有關操作的培訓,以熟悉本品給藥器的使用以及本品的植入和取出技術。建議在適當的情況下,在植入和取出本品時在有經驗的醫生指導下進行。
在植入和取出本品前應仔細閱讀本說明書“如何植入本品”和“如何取出本品”中植入和取出的說明。
有關植入劑植入和取出的更多信息和詳細指導可免費從本公司獲取。
如何使用本品
本品是一種長效避孕藥,皮下植入1支植入劑,提供長達三年的避孕效果。使用者可以在任何時候要求取出植入劑,但同一支植入劑不可持續埋植超過3年。對體重較重的婦女,臨床醫師可以考慮提早替換植入劑(見“注意事項”)。取出植入劑後,立即植入另一支植入劑以便繼續得到避孕保護。如果不想繼續使用本品,但還想繼續避孕,應予以推薦其他的避孕方法。
按照說明書正確並認真地實施皮下植入,是確保正確植入和隨後取出本品的前提。如果本品沒有按照說明書要求的方法及正確的時間被植入(參見“如何植入本品”和“何時植入本品”),可能導致意外懷孕。
本品植入劑應植入在上臂內側皮下,以避開位於二頭肌和三頭肌肌肉之間結締組織深層的大血管和神經。
植入劑的存在與否可以在植入後通過直接觸摸來證實。如果未觸到本品或不能確定是否有本品時,必須用其他方法證實其存在(參見“如何植入本品)。在證實本品存在前,應建議使用一種非激素避孕方法。
本品的包裝內有一個給使用者的用戶卡片,以記錄植入劑的批號。要求醫生在用戶卡片記錄植入的日期、植入側上臂和預期取出的日期。包裝中還含有顯示批號的不乾膠標籤供醫生記錄。
如何植入本品
按照說明書正確認真地將植入劑皮下植入於非慣用手臂中,是正確植入和隨後取出本品的前提。在植入後,醫生和使用者均應可觸摸到皮下的植入劑。
植入劑應僅在皮下淺表層被植入。如果植入太深,可能發生神經或血管損傷。太深或不正確的植入可能出現感覺異常(神經損傷)和植入劑移動(因植入到筋膜或肌肉層而造成),罕見有插到血管內的植入錯誤。此外,植入太深也可使植入劑無法被觸摸到,並使植入劑的定位和/或取出困難。
本品的植入必須在無菌條件下由熟悉操作過程的合格的醫生進行。植入本品必須採用包裝內含有的預填充無菌給藥器。
建議醫生在整個植入過程中保持坐位,以便可以從側面清楚地看到植入位置和針的移動。
- 使用者應平臥,非慣用手臂的肘部彎曲向外展,使腕部與耳朵平行或手與頭靠近(圖1)
- 確定插入位置,應在非慣用上臂內側內上髁以上8-250px處(圖2)。應僅在皮下淺表層植入本品以避開皮下組織三頭肌和二頭肌溝之間的大血管和神經(見【注意事項】)
- 用無菌標記筆做兩個記號:第一個記號是插入點;第二個記號是距第一個點幾厘米近身體近端的點(圖2)。第二個點隨後將被用作植入時的方向指引。
- 用消毒劑清潔插入部位。
- 對植入部位施行麻醉(如噴灑麻醉劑麻醉或沿著插入路徑皮下注射2ml 1%的利多卡因)。
- 從泡罩中取出含有本品的一次性無菌給藥器。如可疑被污染,則不應使用。
- 握住給藥器的針頭上方紋理處。將透明保護套按照箭頭方向水平劃出,拿掉針頭(圖3)。如果保護套不易拿掉,則不應使用此給藥器。通過針尖可以看到白色的植入劑。在沒有完全將針頭插入皮下前千萬不要碰紫色滑塊,否則它會使針頭回縮並提前將植入劑從給藥器中釋放出來。

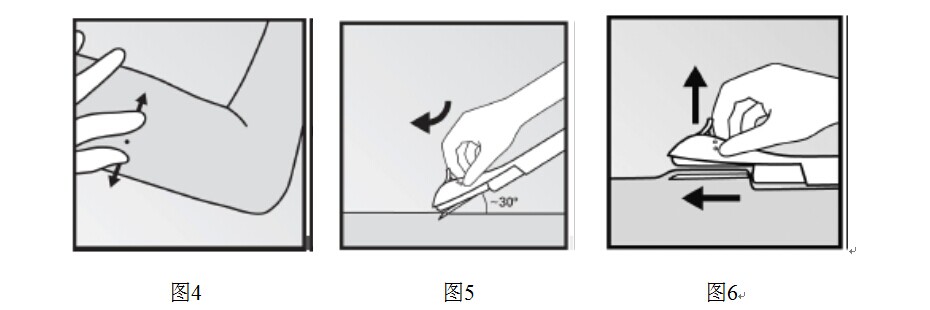
- 用另一隻手的拇指和食指在插入部位周圍繃緊皮膚(圖4)。
- 與皮膚約成30度角略微插入針尖(圖5)。
- 放低給藥器到水平位置,用針尖提起皮膚(圖6),輕輕將針全部扎入,會感覺到略微的阻力但阻力不會太大。如果針頭沒有全部插入,植入劑將不會被正確植入。
如果是坐位從側面(而不是上方)看給藥器可以最清楚的看到針頭的移動。在該位置,可以清楚的看到植入位置和針頭在皮下的移動。
- 保持給藥器位置並確定針的整個長度全部插入。如果需要的話,可以在隨後步驟中使用另一隻手將給藥器固定在一個位置。略微向下按紫色滑塊將其解鎖。將滑塊移到最後直至停止(圖7)。此時植入劑在其最終的皮下位置,同時針頭被鎖在給藥器內。此時可以拿開給藥器。如果給藥器在操作過程中未保持位置或紫色滑塊沒有完全移到最後,植入劑將不能正確植入。
- 植入後立即觸摸受試者上臂以確認植入劑的存在。通過觸摸到植入劑的兩端,可以確認100px軟桿的存在(圖8)。
- 同樣也讓婦女自己來觸摸它。
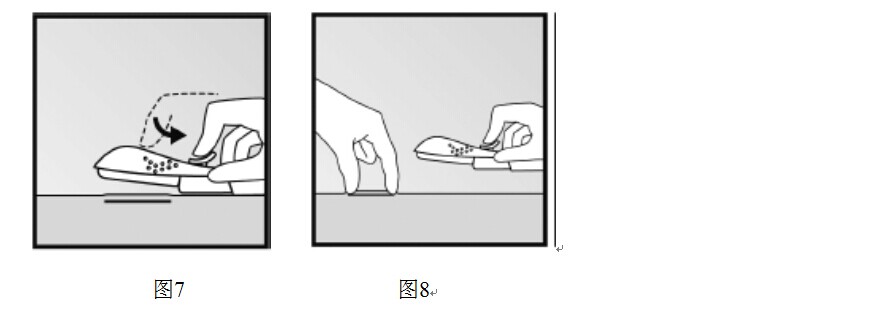
如果未觸到植入劑或懷疑其存在
- 檢查給藥器。針應當完全收回,只能看到針內芯的紫色小尖。
- 套用其他方法來確認本品的存在。適合的方法有:二維X射線,X射線電腦斷層掃描(CT掃描),帶高頻線陣探頭(10MHz或更高)的超音波掃描(USS)或核磁共振成像(MRI)。在進行X-射線CT、USS或MRI確定植入劑位置前,建議諮詢當地本產品的供應商以便得到指導。如果這些影像學方法失敗,建議檢測血液中依託孕烯的含量來確定植入劑的存在。這種情況下當地的供應商將會提供適當的操作指導。在確認本品被植入之前,必須採取一種非激素避孕法避孕。
- 將一小塊貼上繃帶貼於植入位置上。讓婦女觸摸植入劑。
- 用無菌紗布加壓包紮避免淤血。婦女可以在24小時內去除加壓繃帶,然後在第3-5天去除小塊繃帶。
- 填寫用戶卡片,將其交給被植入者本人保存。另外,完整填寫標籤將其附在醫療記錄後。
- 給藥器為一次性用品,用完後,必須適當銷毀,按照當地的規定進行生物廢棄處理。
何時植入本品
重要:植入本品前需排除妊娠。
植入時間取決於婦女近期的避孕情況,如下:
上個月沒有使用過激素類避孕藥
本品也應在婦女自然月經的第1-5天(第1天為月經來潮的第1天)植入,即便仍在出血期。
如按照說明書植入本品,則不需避孕措施。如植入時間與推薦時間有偏差,應建議婦女在植入7天內使用屏障避孕。如已同房,則應排除妊娠。
從其他避孕方法轉為植入本品
從複方激素避孕藥(複方口服避孕藥(COCs)、陰道環或透皮貼劑) 轉為植入本品
最好在服用原複方口服避孕藥最後一片活性藥片(最後一片含有活性成份的藥片)的次日植入本品,但最晚不超過原複方口服避孕藥最後一天停藥期(或原複方口服避孕藥最後一片非活性片)的次日。如果已經使用了陰道環或透皮貼劑,應當在陰道環或透皮貼劑被取出的當天植入本品,最晚不超過下一次應使用陰道環或透皮貼劑的當日。
如按照說明書植入本品,則不需採取避孕措施。如植入時間與推薦時間有偏差,應建議婦女應在植入後7天內使用屏障避孕。如已同房,則應排除妊娠。
從單純孕激素避孕法(如僅含孕激素的藥片、注射劑、植入劑或宮內節育器(IUS))轉為植入本品。
由於有很多單純孕激素的避孕法,本品的植入時間必須按照以下說明:
- 從使用僅含孕激素的避孕藥片的:可隨時從僅含孕激素的避孕片轉為植入本品,應在停用避孕片24小時內植入本品。
- 從使用其他植入劑或宮內節育器(IUS)的:應在被取出當日轉為植入本品。
- 從使用避孕注射劑的:在下一次應使用注射劑的當日轉為植入本品。
如按照說明書植入本品,則不需採取避孕措施。如植入時間與推薦時間有偏差,應建議婦女應在植入後7天內使用屏障避孕。如已同房,則應排除妊娠。
流產或人工流產後
- 早孕期:本品可在早孕期流產或人流後5天內植入。
- 中孕期:應在中孕期流產或人流後的第21至28天植入本品。
如按照說明書植入本品,則不需採取避孕措施。如植入時間與推薦時間有偏差,應建議婦女應在植入後7天內使用屏障避孕。如已同房,則應排除妊娠。
產後
- 哺乳:應在第四個哺乳周后植入本品,參見“妊娠和哺乳期用法”。 應建議婦女應在植入7天內使用屏障避孕。如已同房,則應排除妊娠。
- 非哺乳:應在產後第21-28天植入本品。如按照說明書植入本品,則不需採取避孕措施。如在產後第28天之後植入,應建議婦女應在植入後7天內使用屏障避孕。如已同房,則應排除妊娠。
如何取出本品
本品的取出只能在無菌條件下由有經驗的醫生操作。
取出操作開始前,醫生應參考用戶卡片上植入劑的位置。通過觸摸來確定植入劑在上臂的準確位置。
如果未觸摸到植入劑,可以進行二維X射線以確認其存在。未能觸及的植入劑必須先定位再取出。合適的定位方法包括X射線電腦斷層掃描(CT)、高頻線陣探頭(10 MHz或更高)的超聲(USS)或選擇核磁共振成像(MRI)。如果以上影像學方法失敗,可以通過檢測依託孕烯的血液水平來確證本品的存在。關於進一步的操作指導請聯繫當地供應商。
在對未能觸及的植入劑定位後,應考慮在超聲指導下進行取出操作。
偶有報導植入劑移動,通常在原位置小幅移動,除非插入的太深(見 “注意事項”)。這可能使通過觸摸、超聲和/或MRI方法進行定位變得複雜,導致取出需要更大的切口及更多的時間。
強烈反對在不了解植入確切位置的情況下進行探察性手術。
取出被深埋的植入劑時應該謹慎操作以防損傷上肢較深神經和血管結構。該操作應由熟悉上肢解剖學結構的醫師進行。
如果植入劑不能取出,請聯繫當地供應商以獲得指導。
- 清潔將要切口的位置並用消毒劑消毒。通過觸摸確定植入劑的位置,使用無菌記號筆標出植入劑遠端(近肘部端)(圖9)。
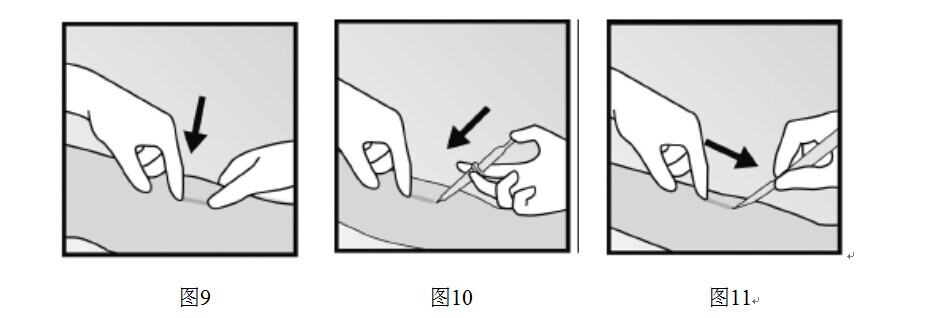
- 手臂局部麻醉,如用0.5-1ml 1%的利多卡因對標記好的將要進行切口處進行局部麻醉(圖10)。確保在植入劑下方注射麻醉劑以使其緊貼皮膚表面。
- 壓住植入劑近端(圖11)使之固定;這時皮膚表面可能會有一個鼓起,為植入劑的遠端。從植入劑遠端開始,向肘部做一個2mm的縱向切口。
- 向切口方向輕輕推動植入劑,直到看到尖端。用鉗子(最好為“蚊式”止血鉗)夾住植入劑取出(圖12)。
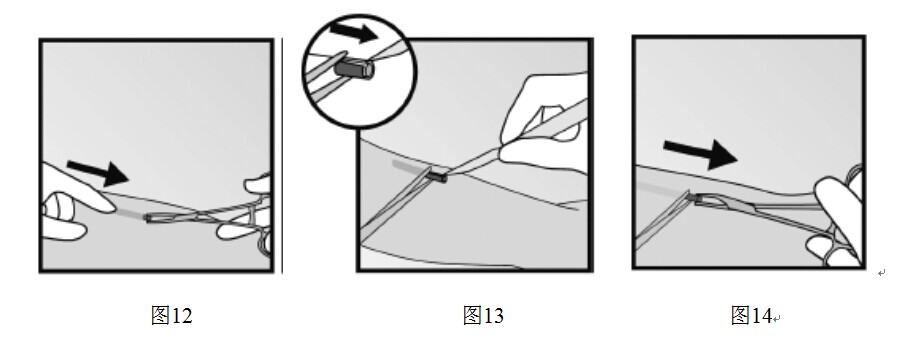
- 如果植入劑被包裹,對纖維組織做一個切口,然後用鉗子夾出植入劑(圖13和圖14)。
- 如果切口處仍然看不到植入劑的尖端,輕輕的將鉗子探入切口內(圖15),夾住植入劑。將鉗子換至另一隻手(圖16)。用另一把鉗子仔細分離植入劑周圍的組織,夾住植入劑(圖17),然後將其取出。
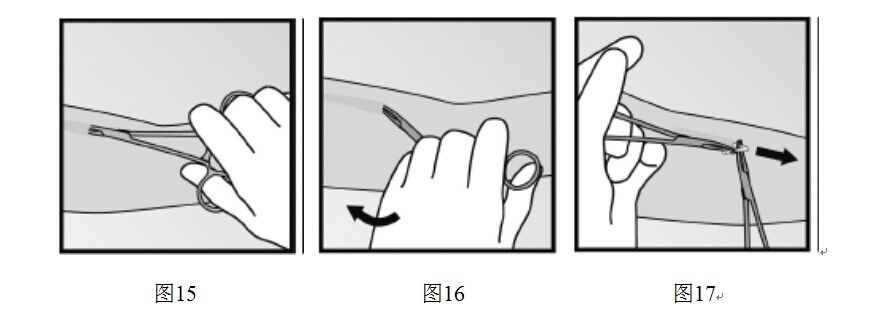
通過測量長度是否是100px,確認已取出整根植入劑。如果取出的僅是部分植入劑(比100px短),應按照“如何取出本品”項下的說明取出剩餘部分。
如果婦女想要繼續使用本品, 新的植入劑可以在舊的被取出來後立即植入。(見“如何替換本品”)
- 取出植入劑後,用免縫膠帶閉合切口並加用一粘性繃帶。
- 用無菌紗布和加壓繃帶包紮以減少淤青。婦女可以在24小時內去除加壓繃帶,然後在第3-5天去除小繃帶。
如何替換本品
取出舊的植入劑後,可立即替換新的植入劑,操作程式與 “如何植入本品” 中描述的植入程式相同。
新的植入劑可以在同一上肢並從舊的植入劑的同一切口處植入。如果採用同一切口植入新植入劑,使用麻醉劑(如2ml 1%的利多卡因)於皮膚切口處下沿著“埋植線”進行局部麻醉,接下的操作按植入說明操作。
不良反應
使用本品期間,婦女的月經出血情況很可能有所改變。這些可能包括出血情況不規律(無月經、月經稀發、更頻繁或持續),出血量(減少或增多)或出血時間延長,有約占1/5的婦女出現閉經;另1/5婦女出血較為頻繁和/或延長。偶爾報告嚴重出血。在臨床試驗中,出血情況的改變是停止使用本品最常見的原因(約11%)。使用本品可能會改善痛經。前3個月的出血情況可以基本預測以後的出血情況。
按MedDRA術語表述的不良反應1 | |||
很常見 >1/10 | 常見 <1/10,≥1/100 | 少見 <1/100,≥1/1000 | |
感染 | 陰道感染 | 咽炎、鼻炎、尿道感染 | |
免疫系統異常 | 過敏反應 | ||
代謝及營養紊亂 | 食慾增加 | ||
精神異常 | 情緒不穩、情緒抑鬱、神經質、性慾減退 | 焦慮、失眠 | |
神經系統異常 | 頭痛 | 眩暈 | 偏頭痛、嗜睡 |
血管疾病 | 潮熱 | ||
胃腸系統紊亂 | 腹痛、噁心、腸胃氣脹 | 嘔吐、便秘、腹瀉 | |
皮膚及皮下組織紊亂 | 痤瘡 | 脫髮 | 多毛症、皮疹、瘙癢症 |
骨骼和結締組織紊亂 | 背痛、關節痛、肌痛、肌肉骨骼痛 | ||
腎及泌尿系統紊亂 | 排尿困難 | ||
生殖系統和乳房紊亂 | 乳房脹痛、乳房痛、月經不規則 | 痛經、卵巢囊腫 | 陰道分泌物異常、陰道不適、溢乳、乳房肥大、外陰瘙癢 |
全身及給藥部位 | 植入部位痛、植入部位反應、疲勞、流感樣症狀、疼痛 | 發熱、水腫 | |
檢查 | 體重增加 | 體重降低 | |
1列出的為表述一定不良反應最合適的MedDRA術語(版本10.1)。未列出同義詞或相關條件,但臨床使用時需同時考慮。
在本品的一項臨床研究中,研究者被要求檢查植入位置,其中有8.6%的女性報導植入位置的反應。紅斑是最常見的植入部位併發症,在植入期間和/或植入後不久,在3.3%的受試者中發生。此外,血腫(3.0%),青紫(2.0%),疼痛(1.0%),腫脹(0.7%)也有報導。
上市後的監測中,觀察到極少數人出現血壓升高。有發生脂溢性皮炎的報告,可能發生過敏反應,蕁麻疹和血管性水腫(加重)和/或遺傳性血管水腫加重。植入或取出本品可能導致淤傷、輕微局部刺激感、疼痛或瘙癢。偶爾在植入部位會形成纖維化、疤痕或潰瘍。可能會出現感覺異常或類似的情況。可能出現本品排出或移動(見“注意事項”)。在取出本品時,有時可能需要小型外科手術。
異位妊娠罕有報告(見 “注意事項”)。
已有報導的使用(複方口服)避孕藥的婦女中發生的(嚴重)不良反應,包括靜脈栓塞、動脈栓塞、激素依賴性腫瘤(如肝臟腫瘤、乳腺癌)和黃褐斑,其中一些在 “注意事項”中進行了詳細描述。
禁忌
- 在以下情況存在時,不應使用單純孕激素避孕。在使用本品期間,如第一次出現以下任何一種情況,應立刻停止使用。
- 已知或可疑妊娠。
- 活動性靜脈血栓栓塞性疾病。
- 現有或曾患有嚴重肝病,肝功能未恢復正常。
- 已知或可疑的對性激素敏感的惡性腫瘤。
- 現患肝腫瘤或有肝腫瘤病史(良性或惡性)
- 不明原因陰道出血。
- 對本品任一成份過敏。
注意事項
警告
如果有下列任何情況/危險因素,要個體化權衡使用孕激素的利弊,在決定使用本品前要與使用者討論。一旦以下任何情況首次出現或情況加重、惡化,應與醫生聯繫,由醫生決定是否停止使用本品。
- 隨著年齡的增長,乳腺癌的患病率增加。在使用(複方)口服避孕藥期間,乳腺癌的風險輕微增加。在停服口服避孕藥10年之內這種風險會逐漸消失,且與使用年限無關,但與婦女服用口服避孕藥時的年齡有關。每10000名使用(複方)口服避孕藥的婦女(停藥超過10年)和同期從未服用過的婦女估計診斷出乳腺癌的數目在各個年齡組計算分別為:4.5/4(16-19歲),17.5/16(20-24歲),48.7/44(25-29歲),110/100(30-34歲),180/160(35-39歲)和260/230(40-44歲)。在避孕方法使用的風險上,只含孕激素的風險與複方避孕藥的風險相似。然而,對於這些避孕方法來說,沒有確定性的結論。與一生中患乳腺癌的風險相比,口服避孕藥相關的乳腺癌增加的風險是很低的。使用口服避孕藥者診斷出的乳腺癌的臨床級別比不用口服避孕藥者低。所觀察到的口服避孕藥使用者乳腺癌風險增加可能與早期診斷、口服避孕藥的生物學作用有關或者二者皆有。
- 出現急性或慢性肝功能受損時,應該諮詢專業醫生進行。
- 流行病學調查發現套用複方口服避孕藥與血栓栓塞疾病發生增加有關(靜脈血栓栓塞、深靜脈血栓栓塞症和肺栓塞)。儘管依託孕烯(去氧孕烯的生物活性代謝物)沒有雌激素成分,也並沒有發現與靜脈血栓有臨床相關性,但是如果確診血栓性疾病應將本品取出。因手術或疾病而長期制動也要考慮將本品取出。儘管本品僅含有孕激素,仍然推薦對已知增加靜脈或動脈栓塞的風險因素進行評估。有血栓栓塞病史的婦女應告知使用本品可能導致復發。
- 上市後,使用不含顯影劑的植入劑的婦女中,已有嚴重動脈和靜脈病例的報導,包括肺栓塞(一些致命),深靜脈栓塞,心肌梗死和卒中。如有栓塞應取出本品。
- 如果在本品使用期間出現持續性高血壓或血壓明顯增高且對抗高血壓治療無反應,應取出本品。
- 儘管使用含孕激素的避孕藥可能對周圍組織胰島素抵抗和糖耐量有影響,但沒有證據提示對糖尿病患者在使用單純孕激素避孕藥時需要改變治療方案。然而,患有糖尿病的婦女使用單純孕激素避孕時要仔細觀察。
- 一直接受高血脂治療的婦女如選擇使用本品,應密切隨訪。一些孕激素可能會使LDL水平升高,並可能導致對高血脂的控制更困難。
- 偶爾可能發生黃褐斑,尤其是那些曾有過妊娠黃褐斑史的婦女。有黃褐斑傾向的婦女在使用本品時,要避免暴露在陽光或紫外線下。
- 本品的避孕效果與依託孕烯的血漿水平有關,與體重成反比,隨植入時間延長而降低。對超重婦女使用本品第3年的臨床經驗有限。所以不能排除體重超重的婦女在第3年的避孕效果有可能較正常體重的婦女低。醫生可考慮提前替換較重體重婦女體內的植入劑。
- 同所有低劑量的激素避孕法一樣,使用本品會發生卵泡生長,偶爾卵泡生長到超過正常周期所達到的大小。通常,這些大卵泡會自然消失。一般無症狀,有時會伴隨有輕微腹痛。一般不需要外科干預。
- 使用傳統單純孕激素避孕藥對異位妊娠的保護不如複方口服避孕藥,這與使用這些避孕方法過程中頻繁的發生排卵有關。儘管本品能持續抑制排卵,如使用者發生閉經或腹痛,在鑑別診斷中,需考慮異位妊娠。
- 在妊娠和使用性激素期間,有報導下述情況,但並沒有確定與使用孕激素有關:與膽汁鬱積有關的黃疸和/或瘙癢;膽石形成;卟啉症;系統性紅斑狼瘡;溶血性尿毒症;Sydenham’s舞蹈病;妊娠皰疹;與耳硬化症相關的聽力損失;遺傳性血管水腫。
- 如果未按照“如何植入本品”的方法正確植入則有可能脫落,或可能導致局部炎症。
- 在極少數的情況下植入劑可能會從植入部位移位,且大部分與最初過深的埋植(見“如何植入本品”)或與外力作用相關(例如埋植操作或接觸運動)。在這些情況中,對植入劑的定位可能更加困難,取出時可能需要更大的切口(見“如何植入本品”)。如果不能取出本品,避孕和孕激素相關的不良反應可能超出預期的時間。
體格檢查/諮詢
在開始或重新開始埋植本品時,要採集完整的病史(包括家族史)並且排除妊娠。要根據禁忌症和注意事項測量血壓,進行體格檢查。建議埋植本品3個月後再進行一次體檢。在這次體檢中,要測量血壓並詢問所有問題、主訴或不良反應的發生。根據臨床判斷為婦女制定個體化的進一步的周期性檢查的頻率和類型。
應告知婦女,本品不能預防HIV(愛滋病)和其它性傳播疾病。
效果降低
當同時使用某些藥物(見“相互作用”)時,本品的效果可能降低。
月經出血模式的變化
使用本品期間,婦女的月經出血情況很可能有所改變。這些可能包括出血情況不規律(無月經,月經稀發、更頻繁或持續),出血量(減少或增多)或出血時間延長,有約占1/5的婦女出現閉經;另1/5婦女出血較為頻繁和/或延長。前3個月的出血情況可以基本預測以後的出血情況。向婦女提供信息和相關諮詢以及出血日誌可能改善對出血模式改變的接受度。應設定對陰道出血的評估,可能包括排除婦科疾病和妊娠的檢查。
對駕駛和操作機器能力的影響
未觀察到有影響。
孕婦及哺乳期婦女用藥
本品不能在懷孕期間使用。如果使用期間發現懷孕應取出本品。動物實驗研究表明高劑量孕激素的攝入可以導致雌性胎兒雄性化。眾多的流行病研究表明對那些在妊娠前曾服用口服避孕藥的婦女既不會增加新生嬰兒出生缺陷,也不會由於妊娠期不經意服用口服避孕藥而對胎兒有致畸作用。儘管這些都適用於口服避孕藥,是否同樣適用於本品尚不明確。
各種含依託孕烯、去氧孕烯(依託孕烯是去氧孕烯的一種代謝物)的產品的藥物安全數據也未表明風險增加。
臨床數據表明,本品不會影響乳汁的產生及質量(蛋白質,乳糖及脂肪)。但是,少量的依託孕烯在乳汁中排泄,根據每日攝入150ml/kg乳汁計算,在釋放一個月後,平均每日嬰兒攝取的依託孕烯量為27ng/kg/日,這相當於母體每日劑量的2.2%(校正體重後),並相當於母體每日絕對劑量的0.2%。隨哺乳時間的推移,依託孕烯的濃度會逐漸減少。
一項長期數據顯示,38名嬰兒的母親在產後4-8周植入本品,母乳餵養時間平均為14個月,隨訪36個月。在生長、生理及心理方面的發展與使用宮內節育器的母親餵養的嬰兒(n=33)進行比較評估,沒有顯示任何差異。根據現有的資料,哺乳期婦女可以使用本品並應在產後第4周后植入。但應密切追蹤注意孩子的生長和發育。
兒童用藥
不適用
老年患者用藥
不適用
藥物相互作用
注意:應諮詢合併用藥的藥物處方信息來判定可能的藥物相互作用。
其他藥品對本品的影響
與激素避孕藥及其他藥物的相互作用可導致出血和/或避孕失敗。本品未進行特定的相互作用研究。文獻報導過的相互作用如下(主要是與複方避孕藥的相互作用,有時也與單純孕激素避孕藥有相互作用):
肝臟代謝:誘導肝酶尤其是細胞色素P450酶的藥物可能與本品發生藥物相互作用,導致性激素的清除率增加(如苯妥英、苯巴比妥、普里米酮、波生坦、卡馬西平、利福平,以及也有可能的奧卡西平、托吡酯、非爾氨酯、灰黃黴素及草藥聖約翰草)。
HIV蛋白酶(例如,利托那韋,奈非那韋),非核苷類逆轉錄酶抑制劑(例如,奈韋拉平,依法韋侖),以及它們的組合,已報告可能會影響肝臟代謝。
服用上述任何一種藥物的婦女應在使用本品之外採用非激素避孕方式。使用肝酶誘導藥物,應同時採取其它非激素避孕方法持續到停藥後28天。
對於長期服用肝酶誘導藥物的婦女,建議取出本品,採用其它非激素避孕法。
共同服用會增加血漿激素的藥物:抑制肝酶(如CYP3A4)的藥物(如酮康唑),可能會增加血漿激素水平。
本品對其他藥物的影響
激素避孕可影響其它藥物的代謝,相應的藥物的血漿及組織濃度可能升高(如環孢黴素)或降低(如拉莫三嗪)。
註:應參考共同服藥的處方信息以鑑定潛在的相互作用。
對實驗室檢查結果的影響
由複方口服避孕藥所得的數據表明避孕類固醇可能影響某些實驗室檢查結果,包括肝、甲狀腺、腎上腺和腎功能的生化參數,血清蛋白(載體)水平如皮質甾體結合球蛋白和脂質/脂蛋白片斷,碳水化合物新陳代謝參數和凝血參數以及纖維蛋白溶解參數。這些參數的變化通常在正常值的範圍之內。此影響在使用單純孕激素避孕時情況未知。
藥物過量
通常在埋植一支新品之前要取出舊的植入劑。沒有關於依託孕烯的過量數據。沒有關於過量使用避孕藥的嚴重毒性報告。
藥理作用
(藥療組:孕激素,ATC-分類G03AC08)
本品是一種含依託孕烯的不能生物降解的放射線下可見的皮下使用植入劑,本品預填充在一個新型的無菌的一次性給藥器中。依託孕烯是去氧孕烯的生物活性代謝物,一種廣泛用於口服避孕藥的孕激素。結構上它衍生自19-去甲睪丸酮,在靶器官與孕酮受體有高度親和力。依託孕烯的避孕效果主要是抑制排卵。使用本品後前2年未觀察到排卵,第3年僅有少量排卵。除抑制排卵外,依託孕烯還可改變宮頸粘液的粘度,從而阻止精子的穿透。臨床實驗在18-40歲的婦女間進行。儘管沒有直接的比較,本品的避孕效力至少與那些已知的複方口服避孕藥相似(大於99%)。取得這種高效的避孕效果亦有其它原因。因為本品的避孕作用並不是靠婦女自己每天、每月或每年的用藥。它的避孕作用是可逆的,取出植入劑後,月經周期可以迅速恢復正常。儘管依託孕烯抑制排卵,但卵巢功能並沒有被完全抑制。平均雌二醇濃度保持在高於早卵泡期的水平。在一個為期2年的研究中,44例本品使用者的骨密度與29例IUD使用者的對照組相比,未發現對骨密度有不良影響。使用本品期間,未觀察到本品對脂代謝有臨床相關影響。含孕激素避孕藥的使用可能對胰島素抵抗和糖耐量有影響。臨床研究進一步表明本品使用者的痛經減輕。
植入物植入和取出特性
在一臨床試驗中,301名婦女接受植入Implanon NXT。平均植入時間(從除去給藥器的保護帽直到從胳膊取出針)為27.9秒(標準偏差(SD)= 29.3,n= 291)。插入後,301支植入劑中有300支(99.7%)可以觸摸到。唯一一支未能觸摸到的植入劑未按照說明書植入。在這301名婦女取出本品時,收集到293個可觸摸數據。有觸摸數據的293名受試者均能觸摸到植入劑。有4名受試者未評價觸摸感,另有4名在取出植入劑前已失訪。
在兩項Implanon NXT的臨床試驗中,共有116名受試者在植入後和/或取出前接受了二維X射線評估。 103名受試者中有101(98.1%)名是在植入時和取出前接受的X射線評估,本品清晰可見;在兩名受試者中在植入劑植入後並非清晰可見,但在取出前是清晰可見的。僅在植入時(n =12)或僅在取出前(N = 1)接受X射線評估的受試者中,植入劑均清晰可見。
臨床前安全性數據
毒理學研究並未發現任何毒性影響,這可以用依託孕烯的激素特性來解釋,與給藥途經無關。
藥代動力學
國外研究
吸收
植入本品後,依託孕烯在循環系統中被迅速吸收。1天之內達到抑制排卵的濃度。1-13天之內達到最大血清藥物濃度(472-1270pg/ml之間)。植入劑的釋放率隨著時間的推移而逐漸降低。因此血清藥物濃度在最初幾個月迅速下降。到第一年末,平均藥物濃度約為200pg/ml(範圍為150-261 pg/ml),第3年末緩慢下降到156pg/ml(範圍為111-202 pg/ml)。所觀察到不同的血清藥物濃度,部分是由於體重差異所引起。
分布
有95.5-99%的依託孕烯與血清蛋白結合, 主要為白蛋白, 其次為性激素球蛋白。分布中位數和總量分別為27 I和220 I,而且在使用本品期間幾乎未發生變化。
代謝
依託孕烯經過羥基化和降解後,代謝物與硫酸鹽和葡萄糖苷酸結合。動物研究表明肝腸循環對依託孕烯中的孕激素活性沒有影響。
排泄
依託孕烯靜脈給藥後,平均消除半衰期約為25小時,血清清除率約7.5 I/小時。用藥期間清除率和消除半衰期保持穩定。依託孕烯的排泄物和代謝產物,或者為游離類固醇,或者為結合狀態,隨尿和糞便排出(比例 1.5:1)。使用植入劑的哺乳期婦女,在前四個月內,乳汁中分泌依託孕烯,其乳汁/血清比率為0.44-0.50。在使用本品的哺乳婦女中,平均母體攝入的依託孕烯的日劑量約0.2%轉移給嬰兒(按平均每公斤體重計約為2.2%)。隨著時間的推移,濃度呈顯著降低趨勢,有統計學意義。
國內研究
RM01研究是在中國進行的藥效和藥代動力學研究。16名受試者參加了本研究,歷時4.5年。放置後2周,依託孕烯的平均血清水平達到627.3±257.8 pg/ml的峰值;隨後降到第6周的364.3±106.5 pg/ml,並持續降到第1年末的198.4±52.3 pg/m。從第70周至研究結束,依託孕烯的血清水平保持相當穩定:第2年為160±43.6 pg/ml至178.5±63.3 pg/ml,第3年為157.6±38.7 pg/ml至169±29.2 pg/ml,第4年為156.3±39.7 pg/ml至180.6±47.9 pg/ml;第5年略微降到145.0±45.8 pg/ml(第208周)和135.8±36.4 pg/ml(第210周),但仍高於90 pg/ml的有效水平。取出本品後,依託孕烯血清水平迅速從139.5±43.5 pg/ml降到23.3±11.8 pg/ml。
研發歷程
- 60年代初:矽橡膠被證實能夠套用於緩釋親脂性藥物。
- 1966年:Segal與Croxatto提出以橡膠為載體加入避孕藥埋植於皮下,作為避孕藥物緩釋系統。
- 1967年:人口理事會避孕研究國際委員會(ICCR)開始進行研究,Croxatto在印度和巴西研究第一個埋植劑所含孕激素為醋酸甲地孕酮。
- 1968年:智利聖地亞哥首次報導使用矽膠釋放孕酮的皮下埋植劑。
- 1974年:開發了6根膠囊的緩釋埋植劑。
- 1975年:ICCR臨床試驗確認LNG埋植劑避孕效果好且長效、續用率高。
- 1983年:Norplant I(6根型)首次在芬蘭上市。
- 1980s:Norplant II/Jadelle(2根型)在歐洲地區上市。
- 1998年:依伴儂(唯一單根型)上市套用至今,已有十幾年經驗。
指南推薦
- 英國國家衛生醫療質量標準署與國家婦女兒童健康合作中心2005年10月《長效可逆避孕方法的效果與正確使用》中提到,依伴儂通過抑制排卵作用,避孕效果出色,失敗率在三年內小於0.1%。 依伴儂不改變體重,不影響心情以及性慾,無頭痛困擾,可能會影響面部痤瘡。
- 美國婦產科學院婦產科醫師臨床管理指南2011年7月《長效可逆指南:植入劑與子宮內避孕器》中提到,依託孕烯68mg皮下植入劑可以抑制排卵作用,失敗率小於0.05%。
- 世界衛生組織(WHO)家庭計畫生育基石2009年第四版《避孕計畫的選擇標準》中與美國疾控中心2010年5月《美國避孕標準》中提到,美國研究中依伴儂®避孕失敗率最低,一年以後持續使用比例僅次於男女絕育手術。
- 世界衛生組織(WHO)生殖健康與家庭和社區衛生的研究2004年日內瓦《避孕建議選擇》中提到,依伴儂避孕時效長達3年。
- 世界衛生組織(WHO)2011更新版《計畫生育》中提到,植入避孕藥中依伴儂相比其他產品僅需植入一根,有效期避孕長達3年。
- 世界衛生組織(WHO)2006年1月《計畫生育用戶及供應商決策工具:技術進展指南》中,將Norplant,Jadelle與Implanon(依伴儂)作為三大植入避孕藥。
- 美國AAFP2011年7月《疾控中心產後避孕臨床指南更新》推薦皮下植入避孕藥作為產後母乳餵養或非母乳餵養母親的避孕方法。
- 國際生殖健康/計畫生育雜誌 2013年7月第32卷第4期《產後和流產後使用長效可逆避孕方法的技術指南》中提到,目前國內可以提供的皮下埋植劑除含左炔諾孕酮(LNG)的6根型和2根型產品。
- 孕烯(ENG)的單根型皮下埋植劑。6根型在中國註冊的使用期限為5年,2根型為4年,單根型為3年。這些產品尤其適用於存在產褥感染、子宮畸形、宮腔變形、IUD頻繁脫落及對做絕育手術有顧慮的婦女。臨床研究的直接證據證實,皮下埋植劑不影響哺乳情況,對產後6周以後經乳汁暴露於皮下埋植劑的嬰兒也無傷害。
- 中國計畫生育與婦產科2012年第4卷第6期《產後避孕的國內外指南》中,單純孕激素避孕方法左炔諾孕酮埋植劑和依託孕烯埋植劑,臨床觀察已證實不影響哺乳情況,在產後6周以後經乳 汁暴露於哺乳的嬰兒,對嬰兒智力發育的影響目前尚無材料證明其利害關係。
臨床數據研究
國外研究
一項在9個國家的21箇中心進行的多中心開放臨床研究考察了本品避孕的可靠性、安全性和可接受性。納入了635名18-40歲健康育齡婦女,觀察期為3年。研究期間禁止服用誘導肝酶的藥物。研究結果顯示,3年期間未出現妊娠。第6、12、24和36月時停用率分別為10%、10%、11%和6%。2年後因出血不規則而導致17.2%婦女停用。有97%痛經婦女的症狀得到改善。12.8%婦女的痤瘡改善,12.6%婦女的痤瘡加重。分別有0.8%和1.1%婦女的收縮壓和舒張壓明顯升高(即分別增加20 mm Hg以上和10 mm Hg以上)。平均血壓降低。20%婦女的體重指數增加10%以上,為此有2.4%婦女停用本品。開始研究時體重>75 kg婦女中報告了50起嚴重不良事件。僅6起(包括子宮纖維瘤、卵巢囊腫、導管內乳頭狀瘤、頭痛、一過性缺血發作、心動過速伴胸悶)可能與藥物有關。體格和盆腔檢查無明顯發現。植入和取出平均時間分別為2.2和5.4分鐘。與植入和取出有關的併發症罕見(1.3–3.0%)。96.2%婦女未報告埋植部位紅、腫、痛或血腫。90.9%婦女在3個月內恢復正常月經。
另一項多中心臨床研究考察了本品的安全性和有效性。330名月經正常的美國婦女使用本品2年。所有婦女在日記中每日記錄出血和/或點狀出血情況。通過不良事件、實驗室檢查以及體格和婦科檢查評價安全性。研究結果顯示,總暴露為474婦女-年(6186個周期),68%婦女至少暴露一年。未發生妊娠。最常見的出血方式是月經稀發。最少見的出血方式是出血過頻。月經稀發、出血期延長和出血過頻在研究早期最常見,此後減少。在第4-24月時,閉經發生率為14%-20%。43名(13%)婦女因出血方式改變而退出研究,76名(23%)因其他不良事件退出研究。導致停止研究的其他常見的不良事件(除出血不規則外)為情緒不穩定(6.1%)、體重增加(3.3%)、抑鬱(2.4%)、痤瘡(1.5%)。使用本品2年,未發現對實驗室參數、體格和盆腔檢查、生命體徵或體重指數方面有臨床意義的影響。本品插入和取出所需的平均時間分別為0.5和3.5分鐘。取出後迅速恢復正常月經周期和生育能力。
國內研究
在中國進行的三個臨床試驗,代碼分別為:RM01(見藥代動力學部分),RM02,RM04。
RM02研究是在中國四個中心進行的開放試驗,目的為評價本品在中國的避孕效果、不良反應、可接受性和出血情況。200名受試者參加了本研究,歷時4年。婦女-年為644.6,每位受試者的平均使用月為38.7。研究發現,4年研究期間未發生妊娠。本品第1、2、3和4年的累積續用率分別為92.5%、87%、77.8%和73.7%。出血量多是終止的主要原因,4年累積停用率為11.8%;閉經和點滴性出血不是停止使用本品的主要原因。本品的取出操作平均時間為2.9±3.0分。87.1%受試者在取出後3個月內恢復正常月經。各中心間取出後的疤痕形成情況各異。疤痕為輕度,平均長度為2.4±15px。4年研究期間除報告有0.54%受試者出現出血量多外,未見與本品有關的明顯的其他不良反應。
RM04研究是在中國的4箇中心進行的隨機試驗,目的是比較本品和左炔諾孕酮植入劑(Norplant)的避孕效果、不良反應、可接受性和出血情況。200名受試者參加了本研究,隨機分成兩組(1:1),歷時4年。兩組均未發生妊娠。本品在第1、2、3和4年的累積續用率分別為96.0%、90.0%、82.7%、77.1%,與左炔諾孕酮植入劑組相比未見明顯差異。本品與左炔諾孕酮植入劑在第3和4年因出血相關問題的終止率分別為8.4%和15.0%,統計上無明顯差異。研究期間兩組都未發生嚴重不良反應,但報告有2例發生延長且大量出血的不良事件(二組各1例)。兩組間無不良主訴的受試者百分數相似,但本品組中閉經的不良主訴比例稍高。研究期間,兩組都有體重輕微增加的現象。兩組產品取出後的疤痕形成在各中心不同,疤痕為輕度,平均大小為:本品組為2.7±0.4 mm,左炔諾孕酮植入劑組為3.0±0.4 mm。