專利背景
肝素是一類由糖醛酸和氨基葡萄糖以1-4糖苷鍵連線起來的重複二糖單元組成的線性粘多糖,其廣泛分布於哺乳動物的組織中,由結締組織型肥大細胞表達產生。肝素同大多數粘多糖一樣,其在動物體內多以肝素鈉-蛋白複合物的形式存在,提取過程中由於肝素鈉解離不完全,使得肝素鈉中殘留一定數量以共價鍵結合的蛋白質和以靜電結合的帶正電蛋白質,需要進一步精製才能套用於臨床。
因為肝素在生物體內是以肝素蛋白聚糖的形式進行生物合成的,其合成的第一步是形成由規則交替的絲氨酸和甘氨酸殘基組成的serglycine蛋白核心,然後通過連續地增加糖胺和糖醛酸,得到一個四糖連線區,並從四糖發生肝素鏈的延長。因此也可以說肝素蛋白聚糖是由交替的葡糖醛酸和N-乙醯半乳糖胺二糖單位組成的糖鏈通過四糖連線區連線到serglycine核心蛋白的絲氨酸殘基上。其中,連線區包含以O-糖苷方式連線絲氨酸的木糖,然後依次是兩個乳糖和一個葡萄糖醛酸殘基。因為O-糖肽鍵比較穩定,在肝素精製過程中不會完全斷裂,因此市場上的精品肝素都不同程度(0.5%~1.5%)的含有絲氨酸殘基,表現在核磁碳譜的56ppm左右處會有一個吸收峰。絲氨酸殘基的存在將使肝素在儲存過程中容易變色,影響藥物的質量。同時由精品肝素作為起始原料製備的低分子和超低分子肝素(如亭扎肝素)也會殘留一定量的絲氨酸殘基。
截至2013年12月,中國國內外發表了許多去除肝素中的絲氨酸的方法,其中Keiichi Takagaki(2002)報導了採用具有β-內切木糖苷酶活性的纖維素酶去除肝素絲氨酸的方法;Yu-ki Matsuno(2007)報導了鹼性條件下的β-消除反應去除肝素絲氨酸的方法,但是這兩種方法均存在局限性,即需要首先分離出特定分子量的肝素片段,然後去除此特定肝素片段的絲氨酸殘基,因此不具備工業化生產的條件。Viskov等(2008)發表的專利(US2008/0318328A1)報導了用高錳酸鉀去除肝素絲氨酸的方法,但是此方法不可避免會對肝素的四糖連線區造成破壞,對工業化生產存在不利影響。
發明內容
專利目的
《一種肝素鈉的製備方法》的目的是提供一種肝素鈉的製備方法,該製備方法有效地去除了肝素鈉中的絲氨酸,改進了2013年之前的技術生產的肝素鈉不適宜藥物工業化生產要求的狀況,而且其工藝操作簡單,製得的產品的肝素結構完整、效價更高。
技術方案
《一種肝素鈉的製備方法》該製備方法包括以下步驟:
(1)將粗品肝素鈉水溶液升溫至45~50℃,調節pH至8.0~9.0,加入胰酶反應,再加入氯化鈣,溶解後升溫至80~85℃,再降溫至40℃以下,加入碳酸鈉,離心取上清液;
(2)將步驟(1)得到的上清液升溫至45~50℃,調節pH至4.5~5.5,加入纖維素酶反應,再加入氯化鈣,溶解後升溫至80~85℃,再降溫至40℃以下,加入碳酸鈉,離心取上清液;
(3)向步驟(2)得到的上清液加入乙醇或乙醇水溶液,降溫至0~5℃,調節pH至1.0~2.0,離心取上清液並調節pH至6.0~7.0;
(4)向步驟(3)得到的上清液加入乙醇或乙醇水溶液,至20℃下的乙醇濃度為40~45°,靜置得到濕沉澱;
(5)將步驟(4)得到的濕沉澱溶解在水中,加入次氯酸水溶液,調節pH至4.5~5.0,20~30℃下靜置,調節pH至6.0~7.0,加入氯化鈉,加入乙醇或乙醇水溶液至20℃下的乙醇濃度為40~45°,靜置得到濕沉澱;
(6)將步驟(5)得到的濕沉澱溶解在水中,調節pH至10.0~10.5,加入過氧化氫水溶液,25~30℃下靜置,調節pH至6~7,過濾。
在上述步驟(1)中,優選地,所述粗品肝素鈉水溶液為除去雜質的粗品肝素鈉的水溶液;更優選地,所述除去雜質包括以下步驟:在25~35℃下,將粗品肝素鈉溶解於水中,加入氯化鈉,調節pH至10.0~10.5,攪拌3.5~4.0小時,然後升溫至80~85℃,調節pH至9.5~10.0,靜置10分鐘,迅速降溫至20℃以下,靜置4-5小時後過濾,取濾液。進一步優選地,所述粗品肝素鈉的效價≥50IU/毫克,其0.01%(克/毫升)的溶液在波長為260納米時,光吸收值≤1.0。優選地,粗品肝素鈉的濃度為20%(克/毫升);優選地,所述氯化鈉的濃度為4-5%(克/毫升)。
在上述步驟(1)中,優選地,所述胰酶與粗品肝素鈉的重量比為0.4~0.8%;所述氯化鈣的濃度為2%(克/毫升);所述碳酸鈉的濃度為2%(克/毫升);
在上述步驟(2)中,優選地,所述纖維素酶與粗品肝素鈉的重量比為0.2~0.6%;所述氯化鈣的濃度為2%(克/毫升);所述氯化鈣的濃度為2%(克/毫升);
在上述步驟(3)中,優選地,向步驟(2)得到的上清液加入95%(體積比)的乙醇水溶液;所述步驟(2)得到的上清液與95%(體積比)的乙醇水溶液的體積比為10%;
在上述步驟(4)中,優選地,向步驟(3)得到的上清液加入95%(體積比)的乙醇水溶液;
在上述步驟(5)中,優選地,所述濕沉澱的濃度為30~35%(克/毫升);優選地,所述次氯酸水溶液與濕沉澱水溶液的體積比為0.5~1.5%;優選地,所述氯化鈉的濃度為1.5%(克/毫升);
在上述步驟(6)中,優選地,所述濕沉澱的濃度為30~35%(克/毫升);優選地,所述過氧化氫水溶液與濕沉澱水溶液的體積比為0.5~1.5%。
在一個《一種肝素鈉的製備方法》的優選實施方案中,上述製備方法包括以下步驟:
(1)在25~35℃下,以20%(克/毫升)濃度將粗品肝素鈉溶解於純化水中,以4~5%(克/毫升)的濃度加入氯化鈉,待溶解後調節pH至10.0~10.5,攪拌3.5~4.0小時,然後升溫至80~85℃,調節pH至9.5~10.0,靜置10分鐘,迅速降溫至20℃以下,靜置4~5小時後過濾,取濾液;其中,粗品肝素鈉的效價≥50IU/毫克,其0.01%(克/毫升)的溶液在波長為260納米時,光吸收值≤1.0;
(2)將步驟(1)得到的濾液升溫至45~50℃,用18%(克/毫升)的鹽酸水溶液或20%(克/毫升)的氫氧化鈉水溶液調節pH至8.0~9.0,加入胰酶反應4~5小時,再以2%(克/毫升)的濃度加入氯化鈣,攪拌溶解後升溫至80~85℃,繼續攪拌10分鐘再降溫至40℃以下,以2%(克/毫升)的濃度加入碳酸鈉,持續攪拌30分鐘,離心取上清液;其中,所述胰酶與粗品肝素鈉的重量比為0.4~0.8%;
(3)向步驟(2)得到的上清液補加純水至步驟(1)中的粗品肝素鈉水溶液的初始體積,升溫至45~50℃,用18%(克/毫升)鹽酸水溶液調節pH至4.5~5.5,加入纖維素酶攪拌下反應6~8小時,加入氯化鈣,攪拌溶解後升溫至80~85℃,攪拌10分鐘,再降溫至40℃以下,以2%(克/毫升)的濃度加入碳酸鈉,持續攪拌30分鐘後離心取上清液;其中,所述纖維素酶與粗品肝素鈉的重量比為0.2~0.6%;
(4)向步驟(3)得到的上清液加入95%(體積比)乙醇水溶液,攪拌均勻,降溫至0~5℃,調節pH至1.0~2.0,離心取上清液並迅速調節pH至6.0~7.0;其中,所述步驟(3)得到的上清液與95%(體積比)的乙醇水溶液的體積比為10%;
(5)向步驟(4)得到的上清液加入95%(體積比)乙醇水溶液,至20℃下的乙醇濃度為40~45°,靜置12~24小時,抽去上層乙醇得到濕沉澱;
(6)以30~35%(克/毫升)的濃度將步驟(5)得到的濕沉澱溶解在純化水中,加入25%(克/毫升)的次氯酸水溶液,用18%(克/毫升)的鹽酸水溶液調節pH至4.5~5.0,20~30℃下靜置6~8小時,調節pH至6.0~7.0,以1.5%(克/毫升)的濃度加入氯化鈉,攪拌溶解後加入95%(體積比)乙醇水溶液至20℃下的乙醇濃度為40~45°,靜置6~8小時,抽去上層乙醇得到濕沉澱;其中,所述次氯酸水溶液與濕沉澱水溶液的體積比為0.5~1.5%;
(7)以30~35%(克/毫升)的濃度將步驟(6)得到的濕沉澱溶解在純化水中,用20%(克/毫升)的氫氧化鈉水溶液調節pH至10.0~10.5,25~30℃下加入30%(克/毫升)的過氧化氫水溶液靜置4小時,再加入30%(克/毫升)的過氧化氫水溶液靜置8小時,再加入30%(克/毫升)的過氧化氫水溶液靜置12小時,調節pH至6~7,過濾;其中,每次加入的過氧化氫水溶液與濕沉澱水溶液的體積比為0.5~1.5%;
(8)將濾液凍乾,粉碎。
《一種肝素鈉的製備方法》還提供了上述製備方法製備的肝素鈉。
《一種肝素鈉的製備方法》採用粗品肝素鈉為原料,首先去除部分雜質,然後採用兩步酶解方法去除部分絲氨酸,然後進一步採用較溫和的氧化條件去除酶解條件下不能完全除去的絲氨酸殘基,從而達到完全去除絲氨酸的目的,得到的精品肝素鈉完全符合USP和EP的檢測標準。
具體來說,《一種肝素鈉的製備方法》的製備方法中的酶解步驟是依次採用胰酶一次酶解去除和肝素相連線的較大蛋白及肽鏈,亦可用其它的酶代替(如鏈霉蛋白酶)、纖維素酶二次酶解去除和肝素四糖連線區中木糖相連線的絲氨酸殘基。採用二次氧化是因為大量實驗表明前期的酶解不能完全去除肝素中的絲氨酸殘基,需要進一步進行氧化,去除殘餘的絲氨酸殘基。
改善效果
《一種肝素鈉的製備方法》提供的肝素鈉的製備方法具有如下特點:
(1)改進了2013年之前的技術中肝素鈉不適宜醫藥工業化生產的狀況,工藝操作簡單,適合工業化大生產;
(2)產品中肝素結構完整,不含絲氨酸殘基,所得效價更高;
(3)產品中肝素性質穩定,儲存過程不易變色;
(4)完全符合USP和EP的檢測標準。
附圖說明
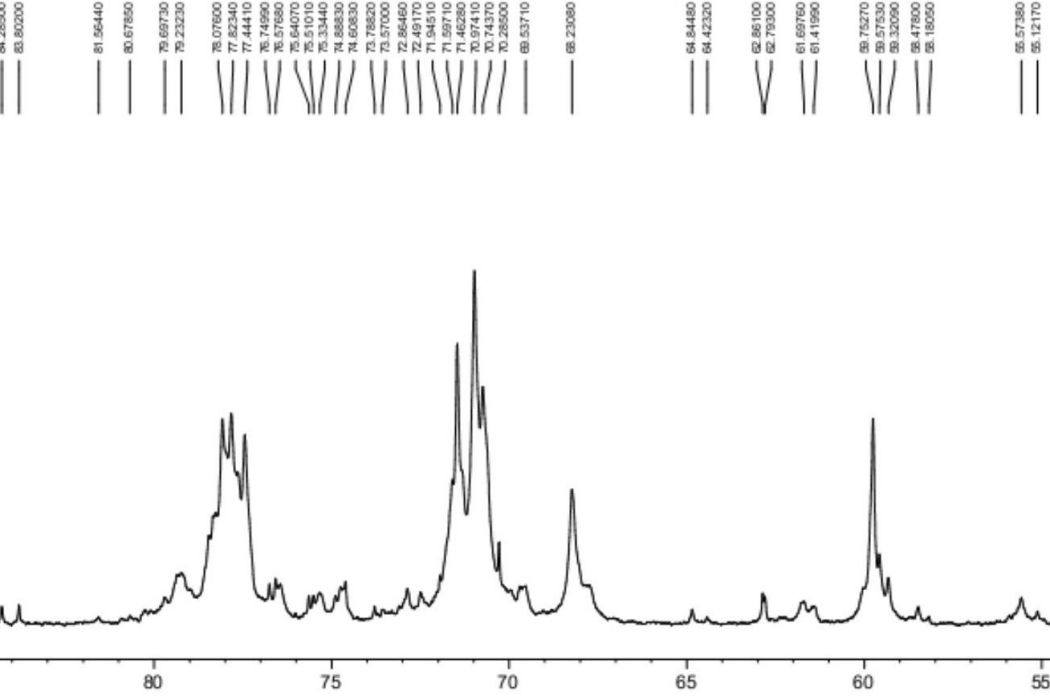
圖1為2013年之前的技術生產的含有絲氨酸殘基的肝素鈉原料,其中56.44ppm處有絲氨酸吸收峰。
圖2為使用《一種肝素鈉的製備方法》製備方法製得的除去絲氨酸殘基的肝素鈉產品,其中56.44ppm處沒有絲氨酸吸收峰。
技術領域
《一種肝素鈉的製備方法》屬於生化藥物領域,涉及一種肝素鈉的製備方法,具體涉及一種包括去除肝素鈉中的絲氨酸步驟的肝素鈉的製備方法以及該製備方法製得的肝素鈉。
權利要求
1.一種肝素鈉的製備方法,其特徵在於,該製備方法包括以下步驟:
(1)將粗品肝素鈉水溶液升溫至45~50℃,調節pH至8.0~9.0,加入胰酶反應,再加入氯化鈣,溶解後升溫至80~85℃,再降溫至40℃以下,加入碳酸鈉,離心取上清液;
(2)將步驟(1)得到的上清液升溫至45~50℃,調節pH至4.5~5.5,加入纖維素酶反應,再加入氯化鈣,溶解後升溫至80~85℃,再降溫至40℃以下,加入碳酸鈉,離心取上清液;
(3)向步驟(2)得到的上清液加入乙醇或乙醇水溶液,降溫至0~5℃,調節pH至1.0~2.0,離心取上清液並調節pH至6.0~7.0;
(4)向步驟(3)得到的上清液加入乙醇或乙醇水溶液,至20℃下的乙醇濃度為40-45°,靜置得到濕沉澱;
(5)將步驟(4)得到的濕沉澱溶解在水中,加入次氯酸水溶液,調節pH至4.5~5.0,20~30℃下靜置,調節pH至6.0~7.0,加入氯化鈉,加入乙醇或乙醇水溶液至20℃下的乙醇濃度為40~45°,靜置得到濕沉澱;
(6)將步驟(5)得到的濕沉澱溶解在水中,調節pH至10.0~10.5,加入過氧化氫水溶液,25~30℃下靜置,調節pH至6~7,過濾。
2.根據權利要求1所述的製備方法,其特徵在於,在所述步驟(1)中,所述粗品肝素鈉水溶液為除去雜質的粗品肝素鈉的水溶液;優選地,所述除去雜質包括以下步驟:在25~35℃下,將粗品肝素鈉溶解於水中,加入氯化鈉,調節pH至10.0~10.5,攪拌3.5-4.0小時,然後升溫至80~85℃,調節pH至9.5~10.0,靜置10分鐘,迅速降溫至20℃以下,靜置4~5小時後過濾,取濾液;優選地,所述粗品肝素鈉的效價≥50IU/毫克,其0.01%(克/毫升)的溶液在波長為260納米時,光吸收值≤1.0;優選地,所述粗品肝素鈉的濃度為20%(克/毫升);優選地,所述氯化鈉的濃度為4-5%(克/毫升)。
3.根據權利要求1或2所述的製備方法,其特徵在於,在所述步驟(1)中,所述胰酶與粗品肝素鈉的重量比為0.4-0.8%;優選地,所述氯化鈣的濃度為2%(克/毫升);優選地,所述碳酸鈉的濃度為2%(克/毫升)。
4.根據權利要求1至3中任一項所述的製備方法,其特徵在於,在所述步驟(2)中,所述纖維素酶與粗品肝素鈉的重量比為0.2-0.6%;優選地,所述氯化鈣的濃度為2%(克/毫升);優選地,所述碳酸鈉的濃度為2%(克/毫升)。
5.根據權利要求1至4中任一項所述的製備方法,其特徵在於,在所述步驟(3)中,向步驟(2)得到的上清液加入95%(體積比)的乙醇水溶液;優選地,所述步驟(2)得到的上清液與95%(體積比)的乙醇水溶液的體積比為10%。
6.根據權利要求1至5中任一項所述的製備方法,其特徵在於,在所述步驟(4)中,向步驟(3)得到的上清液加入95%(體積比)的乙醇水溶液。
7.根據權利要求1至6中任一項所述的製備方法,其特徵在於,在所述步驟(5)中,所述濕沉澱的濃度為30~35%(克/毫升);優選地,所述次氯酸水溶液與濕沉澱水溶液的體積比為0.5-1.5%;優選地,所述氯化鈉的濃度為1.5%(克/毫升)。
8.根據權利要求1至7中任一項所述的製備方法,其特徵在於,在所述步驟(6)中,所述濕沉澱的濃度為30~35%(克/毫升);優選地,所述過氧化氫水溶液與濕沉澱水溶液的體積比為0.5-1.5%。
9.根據權利要求1至8中任一項所述的製備方法,其特徵在於,所述製備方法包括以下步驟:
(1)在25~35℃下,以20%(克/毫升)濃度將粗品肝素鈉溶解於純化水中,以4~5%(克/毫升)的濃度加入氯化鈉,待溶解後調節pH至10.0~10.5,攪拌3.5~4.0小時,然後升溫至80~85℃,調節pH至9.5~10.0,靜置10分鐘,迅速降溫至20℃以下,靜置4~5小時後過濾,取濾液;其中,粗品肝素鈉的效價≥50IU/毫克,其0.01%(克/毫升)的溶液在波長為260納米時,光吸收值≤1.0;
(2)將步驟(1)得到的濾液升溫至45~50℃,用18%(克/毫升)的鹽酸水溶液或20%(克/毫升)的氫氧化鈉水溶液調節pH至8.0~9.0,加入胰酶反應4~5小時,再以2%(克/毫升)的濃度加入氯化鈣,攪拌溶解後升溫至80~85℃,繼續攪拌10分鐘再降溫至40℃以下,以2%(克/毫升)的濃度加入碳酸鈉,持續攪拌30分鐘,離心取上清液;其中,所述胰酶與粗品肝素鈉的重量比為0.4~0.8%;
(3)向步驟(2)得到的上清液補加純水至步驟(1)中的粗品肝素鈉水溶液的初始體積,升溫至45~50℃,用18%(克/毫升)的鹽酸水溶液調節pH至4.5~5.5,加入纖維素酶攪拌下反應6~8小時,加入氯化鈣,攪拌溶解後升溫至80~85℃,攪拌10分鐘,再降溫至40℃以下,以2%(克/毫升)的濃度加入碳酸鈉,持續攪拌30分鐘後離心取上清液;其中,所述纖維素酶與粗品肝素鈉的重量比為0.2~0.6%;
(4)向步驟(3)得到的上清液加入95%(體積比)乙醇水溶液,攪拌均勻,降溫至0~5℃,調節pH至1.0~2.0,離心取上清液並迅速調節pH至6.0~7.0;其中,所述步驟(3)得到的上清液與95%(體積比)的乙醇水溶液的體積比為10%;
(5)向步驟(4)得到的上清液加入95%(體積比)乙醇水溶液,至20℃下的乙醇濃度為40~45°,靜置12~24小時,抽去上層乙醇得到濕沉澱;
(6)以30~35%(克/毫升)的濃度將步驟(5)得到的濕沉澱溶解在純化水中,加入25%(克/毫升)的次氯酸水溶液,用18%(克/毫升)的鹽酸水溶液調節pH至4.5~5.0,20~30℃下靜置6~8小時,調節pH至6.0~7.0,以1.5%(克/毫升)的濃度加入氯化鈉,攪拌溶解後加入95%(體積比)乙醇水溶液至20℃下的乙醇濃度為40~45°,靜置6~8小時,抽去上層乙醇得到濕沉澱;其中,所述次氯酸水溶液與濕沉澱水溶液的體積比為0.5~1.5%;
(7)以30~35%(克/毫升)的濃度將步驟(6)得到的濕沉澱溶解在純化水中,用20%(克/毫升)的氫氧化鈉水溶液調節pH至10.0~10.5,25~30℃下加入30%(克/毫升)的過氧化氫水溶液靜置4小時,再加入30%(克/毫升)的過氧化氫水溶液靜置8小時,再加入30%(克/毫升)的過氧化氫水溶液靜置12小時,調節pH至6~7,過濾;其中,每次加入的過氧化氫水溶液與濕沉澱水溶液的體積比為0.5-1.5%;
(8)將濾液凍乾,粉碎。
10.根據權利要求1至9中任一項所述的製備方法製備的肝素鈉。
實施方式
絲氨酸殘基的檢測方法參考M.Iacomini等人1999年於Anal.Biochem.上發表的文獻:“Linkage Region”Sequences of Heparins and Heparan Sulfates:Detection and Quantification by Nuclear Magnetic Resonance Spectroscopy。
實施例1
(1)除雜:將粗品肝素鈉(效價≥50IU/毫克,其0.01%(克/毫升)水溶液在波長為260納米時,光吸收值≤1.0)按照20%(克/毫升)的量添加於純化水中,升溫至30℃,攪拌至完全溶解。然後按照5%(克/毫升)的量加入氯化鈉,待氯化鈉完全溶解後調整溶液pH為10.0~10.5,恆溫攪拌4.0小時,然後升溫至85℃,維持料液pH在9.5~10.0之間,保持10分鐘,然後迅速冷卻料液至15℃,靜置5小時後用澄清板過濾至料液澄清,取濾液;
(2)一次酶解:將上述料液升溫至50℃,然後用18%(克/毫升)的鹽酸水溶液或20%(克/毫升)的氫氧化鈉水溶液調整pH至9.0,加入粗品肝素鈉重量0.7%(w/w)的胰酶,維持溫度和pH反應5小時,反應結束後向料液加入2%(克/毫升)的氯化鈣,攪拌溶解後升溫至85℃,繼續攪拌10分鐘後迅速將料液溫度降至40℃以下,再加入2%(克/毫升)碳酸鈉,然後持續攪拌30分鐘後離心,收集上清液備用;
(3)二次酶解:將一次酶解得到的上清液補加純化水至步驟(1)中除雜過程開始溶解粗品肝素鈉時的溶液體積,升溫至50℃後用18%(克/毫升)的鹽酸水溶液調整料液pH為5.0,加入粗品肝素鈉重量0.5%(w/w)的纖維素酶,維持溫度和pH攪拌8小時,反應結束後加入2%(克/毫升)的氯化鈣,攪拌溶解後升溫至85℃,攪拌10分鐘;繼續攪拌10分鐘後迅速將料液溫度降至40℃以下,再加入2%(克/毫升)碳酸鈉,持續攪拌料液30分鐘後離心,收集上清液備用;
(4)酸性條件除雜:向二次酶解的上清液加入10%(v/v)的95%乙醇水溶液,混合均勻,降溫至0~5℃,然後調整料液pH為1.5,離心,收集上清液,迅速調整溶液pH至6.0~7.0;
(5)乙醇分級:向料液中加入95%乙醇水溶液,分級至乙醇濃度為42°(溫度為20℃),靜置24小時,抽乾上層乙醇,得到濕沉澱;
(6)氧化:將上述濕沉澱按照30%(克/毫升)的濃度用純化水溶解,然後加入0.75%(v/v)的次氯酸水溶液,用18%(克/毫升)的鹽酸水溶液調整料液pH為4.5,控制溫度為25℃,靜置反應8小時,反應結束後調整料液pH為6.0~7.0,加入1.5%(w/v)氯化鈉,攪拌溶解後加入95%乙醇水溶液,分級沉澱至乙醇濃度為43°(溫度為20℃),靜置6~8小時,抽乾上層乙醇,得到濕沉澱;
(7)二次氧化:將上述濕沉澱按照30%(克/毫升)溶解於純化水中,用20%(克/毫升)的氫氧化鈉水溶液調整pH至10.0~10.5,維持溫度為25℃,然後加入該溶液體積的0.5%(v/v)的30%(克/毫升)過氧化氫水溶液,靜置氧化4小時,待反應結束後補加1.0%(v/v)的30%(克/毫升)過氧化氫水溶液靜置氧化8小時,待反應結束後再次補加1.5%(v/v)的30%(克/毫升)過氧化氫水溶液靜置12小時,將料液調整pH至6~7後,用澄清板濾過;
(8)將上述料液凍乾、粉碎,得到肝素鈉精品原料,所得產品除不含絲氨酸殘基外,其餘指標均符合USP及EP的檢測標準。
該實施例製備的肝素效價(EP7.0方法檢測)大於190IU/毫克,且不含絲氨酸殘基,適用於做肝素類藥物製劑及低分子和超低分子肝素的原料藥,其主要技術指標符合有關標準的要求。
榮譽表彰