專利背景
1969年在美國黃石國家森林公園火山溫泉中分離得到一種水生棲熱菌(Thermusaquaticus)YT-1,它生長在70攝氏度-75攝氏度極富含礦物質的環境中。1976年,A.Chien從中分離純化到了耐熱的TaqDNA聚合酶(簡稱,Taq酶)。隨著PCR技術的推廣和套用,對TaqDNA聚合酶性質的研究日漸重要。RandallK.Saiki首度將其套用於PCR技術,使得PCR過程實現了自動連續循環。
TaqDNA聚合酶是一種耐熱的DNA聚合酶,屬於DNA聚合酶I家族。酶基因全長2496個鹼基,編碼832個胺基酸,分子量為94kD。在70-75攝氏度時具有最高的生物學活性。在92.5攝氏度酶活性可持續130分鐘,95攝氏度持續40分鐘,97.5攝氏度5-6分鐘可保持約50%的酶活性。
然而截至2012年6月,隨著醫藥科技的發展,對聚合酶性能的要求不斷提高,原有的野生型TaqDNA聚合酶已經不能滿足特殊PCR技術的要求了,如用於功能基因的定點突變技術要求聚合酶具有較高的熱穩定性等等。由於原有TaqDNA全酶結構上的缺陷,使其在許多套用領域受到限制。因此需要對天然Taq進行進一步的改造來改善TaqDNA聚合酶的耐熱性等,以適應工業生產及科研套用需求。
發明內容
專利目的
《一種突變型Taq酶及其製備方法》的目的在於提供一種突變型Taq酶,此外該發明還提供該突變型Taq酶的製備方法。
技術方案
《一種突變型Taq酶及其製備方法》提供一種突變型Taq酶,其胺基酸序列為SEQNO.2所示。
該發明還進一步公開了可編碼上述突變型Taq酶的核苷酸序列。具體的,上述核苷酸序列可為SEQIDNO.1所示核苷酸序列。上述核苷酸序列還可為SEQIDNO.1所示核苷酸序列進行1個或幾個核苷酸取代而得到的密碼子同義突變的核苷酸序列。
該發明提供了一種載體,該載體包含可編碼上述突變型Taq酶的核苷酸序列。具體的,上述載體包含SEQIDNO.1所示核苷酸序列。該載體可進一步由可編碼上述突變型Taq酶的核苷酸序列與表達載體經重組得到。所述表達載體為含有轉錄和翻譯插入的編碼序列所需的元件的空載體。上述表達載體可為pET-32a等。具體的,上述載體可由SEQIDNO.1所示的核苷酸序列插入pET-32a等表達載體經重組得到。
該發明還進一步提供了一種重組細胞,該重組細胞可包含編碼上述突變型Taq酶的核苷酸序列。具體的,該重組細胞包含SEQIDNO.1所示的核苷酸序列。該重組細胞可包含載體,該載體包含編碼上述突變型Taq酶的核苷酸序列。具體的,該重組細胞包含載體,該載體包含SEQIDNO.1所示的核苷酸序列。該重組細胞可包含載體,該載體可由編碼上述突變型Taq酶的核苷酸序列與表達載體經重組得到。具體的,該重組細胞可包含載體,該載體可由SEQIDNO.1所示的核苷酸序列與表達載體經重組得到。具體的,所述表達載體可為pET-32a等。進一步具體的,該重組細胞包含的載體為:SEQIDNO.1所示的核苷酸序列插入pET-32a等表達載體經重組得到的載體。上述重組細胞的宿主細胞可為BL21等。
該發明還提供了上述突變型Taq酶的製備方法,其包括:(1)構建含有可編碼上述突變型Taq酶的核苷酸序列的載體;(2)將步驟(1)的載體轉化宿主細胞獲得重組細胞;(3)培養並收集重組細胞,純化提取突變型Taq酶。
該發明還公開了一種聚合酶試劑,所述聚合酶試劑中含有上述突變型Taq酶。
該發明同時公開了上述突變型Taq酶在PCR中的套用。
有益效果
《一種突變型Taq酶及其製備方法》得到的突變型Taq酶其酶學性能表現經過驗證,與未經改造的野生型Taq酶相比,熱穩定性有明顯的提高。且在低濃度模板的檢測中,突變型Taq酶的活性明顯高於未經改造的野生型Taq酶。該發明提供的突變型Taq酶可極大程度滿足不斷提高的工業及研究套用需求。
附圖說明
圖1為《一種突變型Taq酶及其製備方法》實施例3中檢測Taq酶蛋白的大小和純度的SDS-PAGE蛋白電泳圖;
圖2為《一種突變型Taq酶及其製備方法》實施例4中螢光定量PCR檢測突變型Taq酶和野生型Taq酶活性的對比圖;
圖3為《一種突變型Taq酶及其製備方法》實施例4中螢光定量PCR檢測突變型Taq酶和野生型Taq酶在37攝氏度恆溫條件下存放0天和7天的穩定性的對比圖。
技術領域
《一種突變型Taq酶及其製備方法》涉及生物技術領域,具體地,涉及一種突變型Taq酶及其製備方法。
權利要求
1.一種突變型Taq酶,其特徵在於,所述突變型Taq酶的胺基酸序列為SEQNO.2所示。
2.編碼權利要求1所述的突變型Taq酶的核苷酸序列。
3.如權利要求2所述的核苷酸序列,其特徵在於:所述核苷酸序列為SEQIDNO.1;或所述核苷酸序列為SEQIDNO.1所示序列進行1個或幾個核苷酸取代而得到的密碼子同義突變的核苷酸序列。
4.一種載體,其特徵在於,所述載體包含權利要求2或權利要求3所述的核苷酸序列。
5.如權利要求4的載體,其特徵在於,所述載體由權利要求2或3所述的核苷酸序列與表達載體經重組得到。
6.如權利要求4的載體,其特徵在於,所述表達載體為pET-32a。
7.一種重組細胞,其特徵在於,所述重組細胞包含:權利要求2或3所述的核苷酸序列;或權利要求4或5或6所述的載體。
8.如權利要求7所述的重組細胞,其特徵在於,構建所述重組細胞所使用的宿主細胞為BL21。
9.製備權利要求1所述的突變型Taq酶的方法,所述方法包括:(1)構建含有權利要求2或3所述的核苷酸序列的載體;(2)將步驟(1)的載體轉化宿主細胞獲得重組細胞;(3)培養並收集重組細胞,純化提取突變型Taq酶。
10.一種聚合酶試劑,其特徵在於,所述試劑中含有權利要求1所述的突變型Taq酶。
11.權利要求1所述的突變型Taq酶在PCR中的套用。
實施方式
操作內容
《一種突變型Taq酶及其製備方法》採用現代基因工程技術,將天然Taq酶胺基酸序列中的多個位點的胺基酸進行同時突變,並經重組表達後得到突變型Taq酶。該突變型Taq酶與未經改造的野生型Taq酶相比,上述定點突變使得酶的活性和熱穩定性均有較大的提高,使其可更加適應工業生產及科研套用需求。
《一種突變型Taq酶及其製備方法》中,上述突變涉及天然Taq酶的以下位點:E626、A661、I665、F667和I707。在《一種突變型Taq酶及其製備方法》的一種實施方式中,其突變型Taq酶的胺基酸序列如SEQIDNO.2所示,包括了上述5個位點的突變,具體為將天然Taq酶的第626位由谷氨酸突變為賴氨酸,第661位由丙氨酸突變為谷氨酸,第665位由異亮氨酸突變為蘇氨酸,第667位由苯丙氨酸突變為亮氨酸,第707位由異亮氨酸突變為亮氨酸。
《一種突變型Taq酶及其製備方法》還進一步提供了可編碼上述突變型Taq酶的核苷酸序列。具體的,在《一種突變型Taq酶及其製備方法》的一個實施例中,公開了SEQIDNO.1所示核苷酸序列。該領域技術人員可根據分子生物學技術,採用cDNA克隆和定點突變的方法或其他適合的方法獲得《一種突變型Taq酶及其製備方法》的突變型Taq酶的核苷酸序列。這裡還需說明的是,編碼上述突變型Taq酶的核苷酸序列並不僅限於SEQIDNO.1所示的核苷酸序列。該領域技術人員熟知,同一胺基酸可由幾種不同的密碼子來決定,故同一胺基酸可對應不同的核苷酸序列。因此《一種突變型Taq酶及其製備方法》中的突變型Taq酶的胺基酸序列,即SEQIDNO.2所示的胺基酸序列,除可由SEQIDNO.1所示的核苷酸序列所編碼,也可由SEQIDNO.1所示核苷酸序列進行1個或幾個核苷酸取代而得到的密碼子同義突變的核苷酸序列所編碼。
《一種突變型Taq酶及其製備方法》同時公開了製備上述突變型Taq酶的方法。其製備方法包括以下步驟:(1)構建含有可編碼上述突變型Taq酶的核苷酸序列的載體;(2)將步驟(1)的載體轉化宿主細胞獲得重組細胞;(3)培養並收集重組細胞,純化提取突變型Taq酶。其中構建載體這一步驟可以採用先合成可編碼上述突變型Taq酶的核苷酸序列,再將該核苷酸序列插入到適當的表達載體中。也可通過PCR直接得到包含突變型Taq酶的質粒,在《一種突變型Taq酶及其製備方法》的一個實施例中,用包含天然Taq酶(野生型Taq酶)基因的質粒做模板,進行PCR擴增。合成的擴增引物(即突變引物)包含了需要突變的位點,且已經替換了所需要突變的鹼基。擴增後消化原來的母板,再將PCR的產物即為含有突變後的Taq酶基因的質粒轉化到感受態細胞中,通過挑克隆後提取即可得到大量含突變型Taq酶基因的質粒。此外,在適當條件下,培養含有上述突變型Taq酶核苷酸序列的宿主細胞,並可採用該領域熟知的方法,從工程改造的宿主細胞中分離《一種突變型Taq酶及其製備方法》的突變型Taq酶,使其與宿主細胞的其他組分,如蛋白質、糖或脂質分開。這類方法包括但不限於:分子大小排阻層析、硫酸銨分級、離子交換層析、親和層析和製備型凝膠電泳等。
《一種突變型Taq酶及其製備方法》還進一步公開了上述突變型Taq酶在PCR中的套用。例如,可將上述突變型Taq酶作為聚合酶試劑中的成分。
實施案例
將含有天然Taq酶基因的質粒,進行PCR擴增。合成的擴增引物即突變引物,包含了需要突變的位點,且已經替換了所需要突變的鹼基。擴增後,利用酶消化原來的母板,即消化作為初始模板的未突變的Taq酶基因模板。將PCR的產物,即含有突變後的Taq酶基因的質粒轉化到感受態細胞中。挑克隆即可得到含突變型酶基因的質粒。
50微升PCR反應體系:10×buffer(100毫摩爾/升KCl,100毫摩爾/升(NH4)2SO4,200毫摩爾/升Tris-HClpH8.8,20毫摩爾/升MgSO4,1%TritonX-100,1毫克/毫升BSA)5微升,10毫摩爾/升dNTP0.5微升,突變引物各125納克,1Upfu酶,含50納克質粒模板1微升,加ddH2O至50微升。反應條件:95攝氏度變性30秒,循環周期為95攝氏度30秒,55攝氏度1分鐘,68攝氏度14分鐘,25個循環。PCR反應結束後立即將反應管放在冰上使其溫度≤37攝氏度。然後加入1微升的限制性內切酶DpnI放置在37攝氏度的恆溫箱中酶解1小時,消化掉原來未突變的模板,最後將消化後的PCR產物轉化到感受態細胞中。引物設計規則:引物中必須包含突變的位點,其它序列和原基因序列完全互補,且設計時引物長度控制在25-45鹼基對,儘量使得退火溫度≥78攝氏度。使得引物可以很好的和Taq酶基因結合,並且可以減少引物二聚體的形成。
按以上方法依次突變E626K、A661E、I665T、F667L、I707L。
將50微升菌種接於5毫升LB液體培養基中搖培6-8小時,然後轉接於250毫升LB液體培養基中,搖培4-6小時後加入IPTG至終濃度為50毫摩爾/升後繼續培搖過夜。250毫升菌液於50毫升離心管中5000轉/分鐘離心10分鐘收集菌體,每100毫升培養物加入5毫升Bindingbuffer,加入溶菌酶至終濃度為1毫克/毫升,冰上放置1小時,4攝氏度振盪10分鐘,加入TritonX-100至終濃度為1%,劇烈振盪混勻,4攝氏度振盪10分鐘,5000轉/分鐘離心30分鐘,取上清(留樣20微升菌體破碎產物),75攝氏度水浴1小時,不時振盪,5000轉/分鐘離心30分鐘,取上清(留樣20微升粗酶液)。將Ni-凝膠輕輕混勻,取1毫升至柱中,1毫升ddH2O洗滌兩次,用1毫升Bindingbuffer(50毫摩爾/升NaH2PO4、300毫摩爾/升NaCl、pH8.0)平衡柱子,將多餘的Bindingbuffer除去,將平衡好的Ni-凝膠加入到粗酶液中,於4攝氏度輕搖1小時,上柱,收集的流出液重複上柱2次,收集流出液(收集每次留出液20微升)。用1毫升Washingbuffer(50毫摩爾/升NaH2PO4、300毫摩爾/升NaCl、10毫摩爾/升咪唑,pH8.0)洗滌(每次都使介質懸浮起來)5-10次,直到洗出液的A280小於0.01。加入0.5毫升Elutionbuffer(50毫摩爾/升NaH2PO4、300毫摩爾/升NaCl、250毫摩爾/升咪唑),當液體流盡後關閉流液口,然後加入1毫升Elutionbuffer浸泡5分鐘,打開流液口收集洗脫液,重複數次洗脫,分管收集。洗脫至OD值最小為止(收集最後一次洗滌液20微升)。收集的酶液中加入兩倍體積的飽和硫酸銨,4攝氏度振盪15分鐘,5000轉/分鐘,4攝氏度離心30分鐘使突變改造Taq酶沉澱,去上清,保留沉澱。加入1毫升酶溶解液溶解,置於Taqstorebuffer中透析12小時,每6小時換一次液。收集終產品。
將上述得到的突變型Taq酶和野生型Taq酶進行SDS-PAGE蛋白電泳檢測,鑑定突變改造Taq酶蛋白的大小和純度。
方法:取各樣品40微升加5×LoadingBuffer10微升,沸水浴10分鐘,上樣5微升。濃縮膠恆壓100伏,分離膠恆壓180伏。考馬氏亮藍染色。
結果:請參考圖1,其中,1為野生型Taq酶,2和3均為突變型Taq酶,各電泳條帶在濃縮膠中被壓成一條直線;從圖中可知,突變型Taq酶與野生型Taq酶條帶大小一致;膠面背景乾淨,樣品條帶清晰,無肉眼可視雜帶。
(1)酶活性比較
將已標定的突變型Taq酶和野生型Taq酶用螢光定量PCR方法進行酶活比較,即將突變型Taq酶與野生型Taq酶在同一實驗條件下進行檢測,具體的,將兩種酶各自在同一高濃度模板和同一低濃度模板條件下進行檢測,在該例中,將兩種酶分別在高濃度模板和低濃度模板下各進行了2次重複檢測。
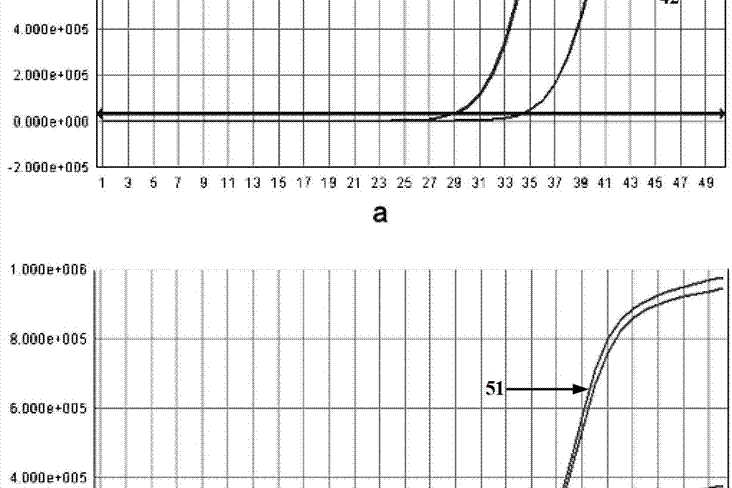
結果:請參考圖2,圖2a為突變型Taq酶的活性檢測結果,圖2b為野生型Taq酶的活性檢測結果。圖中每條曲線代表一個PCR反應,圖中的橫坐標表示PCR的循環次數,縱坐標表示螢光值。其中,圖2a中,41為突變型Taq酶在高濃度模板下的一組曲線,42為突變型Taq酶在低濃度模板下的一組曲線;圖2b中,51為野生型Taq酶在高濃度模板下的一組曲線,52為野生型Taq酶在低濃度模板下的一組曲線。圖中每組曲線中所含有的曲線條數代表該酶在同一個濃度模板進行重複檢測的次數,每條曲線的高度則代表檢測時在該濃度下該酶的PCR的擴增效率。該例中,同一濃度模板下重複2次檢測,故每組曲線中含有兩條曲線。對比圖2a和圖2b可知,在高濃度模板的檢測中,41組曲線的高度高於51組曲線;在低濃度模板的檢測中,42組與52組曲線的高度存在明顯的差異,42組曲線的高度明顯高於52組曲線,即突變型Taq酶的擴增效率遠大於野生型Taq酶。由此可得,在低濃度模板的檢測中突變型Taq酶的活性較野生型Taq酶的活性有明顯的提高。
(2)酶熱穩定性比較
將突變型Taq酶和野生型Taq酶在37攝氏度恆溫條件下存放0和7天后進行檢測,該例中,存放0天后分別將兩種酶在同一中等濃度模板下進行重複檢測;存放7天后分別將兩種酶在同一低濃度模板下進行重複檢測。
結果:請參考圖3,其中,圖3a為螢光定量PCR檢測突變型Taq酶的熱穩定性檢測結果,圖3b為螢光定量PCR檢測野生型Taq酶的熱穩定性檢測結果。同上,圖中每條曲線代表一個PCR反應,圖中的橫坐標表示PCR的循環次數,縱坐標表示螢光值。其中,圖3a中,43為突變型Taq酶存放0天后在同一中等濃度模板下檢測得到的一組曲線,44為突變型Taq酶在存放7天后在同一低濃度模板下檢測得到的一組曲線;圖3b中,53為野生型Taq酶在存放0天后在同一中等濃度模板下檢測得到的一組曲線,54為野生型Taq酶在存放7天后在同一低濃度模板下檢測得到的一組曲線。該例中,突變型Taq酶和野生型Taq酶在存放0天后分別重複檢測了2次,故43組和53組曲線分別包括2條曲線。突變型Taq酶和野生型Taq酶在存放7天后分別重複檢測了24次,故44組和54組曲線分別包括24條曲線。對比圖3a和圖3b可知,在37攝氏度恆溫條件下存放0天后,檢測中等濃度模板時,43組與53組曲線的高度相差不大,即該條件下突變型Taq酶與野生型Taq酶的PCR擴增效率相差不大。在37攝氏度恆溫條件下存放7天后,檢測低濃度模板時,44組曲線中的24條曲線的高度均高於某一螢光值,即24次重複檢測均能檢出;而54組曲線中,僅13條曲線的高度高於某一螢光值,其餘11條曲線的螢光值約為0,即在該組重複檢測中僅部分檢測能檢出,即該條件下突變型Taq酶的檢出率較野生型Taq酶的檢出率高。由此可得,在熱穩定性方面,突變型Taq酶較野生型Taq酶有明顯改善。
專利榮譽
2021年6月24日,《一種突變型Taq酶及其製備方法》獲得第二十二屆中國專利優秀獎。