《一種穩定的抗TNF-α抗體製劑及其用途》是信達生物製藥(蘇州)有限公司於2013年11月26日申請的專利,該專利的公布號為CN104666242A,授權公布日為2015年6月3日,發明人是王音爵、邱建亮、黃小樂、孫左宇。
《一種穩定的抗TNF-α抗體製劑及其用途》涉及一種穩定的抗TNF-α抗體製劑及其用途,具體地所述製劑包括:(i)治療有效量的抗TNF-α抗體;(ii)含0.8-6.2毫克/毫升組氨酸的緩衝體系;(iii)滲透壓調節劑;以及(iv)表面活性劑,其中,所述製劑的pH為5.5-6.5。該發明的製劑不僅能有效降低抗TNF-α單克隆抗體的化學降解反應速率,提高抗體的化學穩定性,延長產品的貨架期,而且可消除或減輕患者的注射部位副反應,提高病人的用藥舒適度。此外,該發明還公開了一種穩定抗體的方法以及該製劑的用途。
2020年7月14日,《一種穩定的抗TNF-α抗體製劑及其用途》獲得第二十一屆中國專利獎優秀獎。
基本介紹
- 中文名:一種穩定的抗TNF-α抗體製劑及其用途
- 申請人:信達生物製藥(蘇州)有限公司
- 申請日:2013年11月26日
- 申請號:2013106112881
- 公布號:CN104666242A
- 公布日:2015年6月3日
- 發明人:王音爵、邱建亮、黃小樂、孫左宇
- 地址:江蘇省蘇州市蘇州工業園區星湖街218號生物納米園C14棟二樓
- Int. Cl.:A61K9/08(2006.01)I、A61K39/395(2006.01)I、A61K47/18(2006.01)I、A61K47/34(2006.01)I等;
- 代理機構:上海一平智慧財產權代理有限公司
- 代理人:祝蓮君、劉真真
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,技術領域,權利要求,實施方式,操作內容,實施案例,榮譽表彰,
專利背景
類風濕性關節炎(RA)是一種以慢性侵蝕性關節炎為特徵的全身性自身免疫病,病變特點為滑膜炎,2013年前類風濕性關節炎已成為一種嚴重影響人類健康和生活質量的疾病,也是已開發國家導致患者殘疾的主要疾病之一。
近10年來,用於治療RA的製劑已從廣泛的免疫調節劑轉變為僅針對涉及RA發病機制的特定的分子靶向細胞因子和細胞,阻斷RA發病過程中的不同階段,達到治療RA的目的。有多種炎性細胞和因子參與了RA的發病,其中腫瘤壞死因子(TNF-α)處於支配地位。2013年前研究最深入、開發最成功的是TNF-α拮抗劑,如全球第一個上市的全人源抗TNF-α抗體藥物阿達木單抗。
由於抗體為生物大分子,其結構非常複雜,因此在生產過程中,表達的抗體分子會發生各種翻譯後修飾和降解反應,如N末端環化,糖基化,脫醯胺,異構化,氧化,片段化,二硫鍵錯配等等。這些質量屬性可能會對最終產品安全性和有效性產生影響,因此,控制產品質量的正確性和一致性非常重要。
2013年前已知的多數抗TNF-α抗體製劑的穩定性不高,儲存中易發生化學變化(例如脫醯胺和某些氧化),導致電荷異構體的增多,使得產品的質量一致性受到潛在影響。此外,用藥時常引起病人皮下注射部位疼痛、癢、紅腫等副反應。因此有必要開發一種新型抗TNF-α抗體製劑以提高抗體的穩定性,從而提高產品質量的均一性和一致性,以及提高臨床使用穩定性。
發明內容
專利目的
《一種穩定的抗TNF-α抗體製劑及其用途》的目的在於提供一種穩定的抗TNF-α抗體製劑及其用途。
技術方案
《一種穩定的抗TNF-α抗體製劑及其用途》第一方面提供了一種抗體液體製劑,所述製劑包括:
(i)治療有效量的抗TNF-α抗體;
(ii)含0.8-6.2毫克/毫升組氨酸的緩衝體系;
(iii)滲透壓調節劑;
(iv)表面活性劑。
其中,所述製劑的pH為5.5-6.5。
在另一優選例中,所述抗TNF-α抗體的濃度為40-60毫克/毫升。
在另一優選例中,所述抗TNF-α抗體的濃度為45-55毫克/毫升,優選為48-52毫克/毫升,最優選為50毫克/毫升。
在另一優選例中,所述組氨酸的濃度為1.6-5.0毫克/毫升,優選為3.0-3.8毫克/毫升。
在另一優選例中,所述組氨酸的pH為5.5-6.5,優選為5.8-6.2。
在另一優選例中,所述抗TNF-α抗體為單克隆抗體。
在另一優選例中,所述單克隆抗體為全長抗體。
在另一優選例中,所述單克隆抗體為IgG1抗體。
在另一優選例中,所述單克隆抗體為人源化抗體。
在另一優選例中,所述單克隆抗體為包含抗原結合區的抗體片段。
在另一優選例中,所述抗體片段為Fab或F(ab′)2片段。
在另一優選例中,所述單克隆抗體結合TNF-α。
在另一優選例中,所述抗TNF-α抗體選自:阿達木單抗(adalimumab)、英夫利昔單抗(infliximab)、戈利木單抗(Golimumab)。
在另一優選例中,所述製劑的pH為5.8-6.2,優選為5.9-6.1,最優選為6.0。
在另一優選例中,所述滲透壓調節劑包括多元醇和氯化鈉。
在另一優選例中,所述多元醇為甘露醇或山梨醇。
在另一優選例中,所述多元醇的濃度為8-20毫克/毫升,優選為10-15毫克/毫升。
在另一優選例中,所述NaCl的濃度為2-10毫克/毫升,優選為4-8毫克/毫升,更優選為5.5-6.5毫克/毫升。
在另一優選例中,所述表面活性劑的濃度為0.6-1.0毫克/毫升,優選為0.8-1.0毫克/毫升。
在另一優選例中,所述表面活性劑為聚山梨酯。
在另一優選例中,所述聚山梨酯為聚山梨酯80。
在另一優選例中,所述製劑具有下組的一種或多種特徵:
(a)所述製劑在2-8℃可保存至少2年;
(b)所述製劑適合皮下注射。
在另一優選例中,所述製劑包括:
(a)40-60/毫升抗TNF-α單克隆抗體;
(b)0.8-6.2毫克/毫升組氨酸;
(c)8-20毫克/毫升多元醇;
(d)2-10毫克/毫升NaCl;
(e)0.6-1.0毫克/毫升聚山梨酯,
並且所述製劑的pH為5.5-6.5。
《一種穩定的抗TNF-α抗體製劑及其用途》第二方面提供了一種試劑盒,所述試劑盒包括:
第一方面所述的抗體液體製劑;以及用於盛裝所述液體製劑的容器。
在另一優選例中,所述試劑盒還包括使用說明書。
《一種穩定的抗TNF-α抗體製劑及其用途》第三方面提供了一種第一方面所述製劑的用途,所述製劑用於製備治療TNF-α表達過多或有害的病症的藥物。
《一種穩定的抗TNF-α抗體製劑及其用途》第四方面提供了一種用於穩定抗體的方法,所述方法通過將治療有效量的抗TNF-α抗體、含0.8-6.2毫克/毫升組氨酸的緩衝體系、滲透壓調節劑以及表面活性劑進行組合,並控制該組合的pH為5.5-6.5來進行。
改善效果
1.《一種穩定的抗TNF-α抗體製劑及其用途》的製劑能有效降低抗TNF-α單克隆抗體的化學降解反應速率,提高抗體的化學穩定性,延長產品的貨架期。
2.通過控制《一種穩定的抗TNF-α抗體製劑及其用途》製劑的pH值和去除潛在的引起不良反應的組分(如檸檬酸),可消除或減輕患者的注射部位不良反應,提高病人的用藥舒適度。
技術領域
《一種穩定的抗TNF-α抗體製劑及其用途》涉及生物技術領域,具體地涉及一種穩定的抗TNF-α抗體製劑及其用途。
權利要求
1.一種抗體液體製劑,其特徵在於,所述製劑包括:
(i)治療有效量的抗TNF-α抗體;
(ii)含0.8-6.2毫克/毫升組氨酸的緩衝體系;
(iii)滲透壓調節劑;以及
(iv)表面活性劑,
其中,所述製劑的pH為5.5-6.5。
2.如權利要求1所述的製劑,其特徵在於,所述抗TNF-α抗體的濃度為40-60毫克/毫升。
3.如權利要求1所述的製劑,其特徵在於,所述組氨酸的濃度為1.6-5.0毫克/毫升。
4.如權利要求1所述的製劑,其特徵在於,所述製劑的pH為5.8-6.2。
5.如權利要求1所述的製劑,其特徵在於,所述滲透壓調節劑包括多元醇和氯化鈉。
6.如權利要求5所述的製劑,其特徵在於,所述多元醇的濃度為8-20毫克/毫升。
7.如權利要求5所述的製劑,其特徵在於,所述NaCl的濃度為2-10毫克/毫升。
8.如權利要求1所述的製劑,其特徵在於,所述表面活性劑的濃度為0.6-1.0毫克/毫升。
9.如權利要求1所述的製劑,其特徵在於,所述製劑具有下組的一種或多種特徵:
(a)所述製劑在2-8℃可保存至少2年;
(b)所述製劑適合單次皮下注射。
10.一種權利要求1所述製劑的用途,其特徵在於,所述製劑用於製備治療TNF-α表達過多或有害的病症的藥物。
11.一種用於穩定抗體的方法,其特徵在於,所述方法通過將治療有效量的抗TNF-α抗體、含0.8-6.2毫克/毫升組氨酸的緩衝體系、滲透壓調節劑以及表面活性劑進行組合,並控制該組合的pH為5.5-6.5來進行。
實施方式
操作內容
該發明人經過廣泛深入的研究發現,抗TNF-α抗體與特定濃度的含組氨酸的緩衝體系、多元醇(如甘露醇或山梨醇)、氯化鈉以及表面活性劑(如聚山梨酯)組成的液體製劑在pH為5.5-6.5的條件下,不僅在外觀、蛋白濃度、濁度、純度等方面保持優異的穩定性,而且製劑的化學穩定性得到顯著地提高,製劑中電荷異構體的生成速率明顯降低,製劑的存放時間得到有效延長。在此基礎上完成了該發明。
如該文所用,所述“液體製劑”是指如下形式的製備物,使得容許活性組分的生物學活性有效,且不含別的對會施用該製劑的受試者有不可接受的毒性的成分。受試者包括哺乳動物,優選為人。
如該文所用,所述“抗體穩定性”是指一種抗體在貯藏後基本上保留其物理穩定性和/或化學穩定性和/或生物學活性。貯藏期一般基於製劑的預定貨架期來選擇。多種用於測量抗體穩定性的分析技術是該領域所公知的。
可以在選定溫度下用選定時間測定穩定性。優選的是,所述製劑在室溫或30℃至40℃下能穩定至少1個月和/或在大約2-8℃下穩定至少2年。
如果在通過對顏色和/或透明度進行肉眼檢查,或通過UV光散射或通過大小排阻層析測定時基本沒有表現出明顯的聚集,沉澱和/或變性的跡象,則製劑中的抗體保持它的物理穩定性。
如果在特定時間化學穩定性使得抗體被認為仍然保留了下面所定義的生物學活性,則在製劑中,所述抗體保持它的化學穩定性。可以通過檢測和定量所述抗體的化學改變形式評估化學穩定性。化學改變可能涉及大小改變(例如,剪下),例如,可以通過採用大小排阻層析,SDS-PAGE和/或矩陣輔助的雷射解析離子化/飛行時間質譜分析(MALDI/TOF MS)進行評估。其他類型的化學改變包括電荷改變(例如,因為脫醯胺導致的改變),例如,可以通過離子交換層析對它進行評估。
如果一種製劑中的抗體具有它預期用途的生物學活性,則所述抗體在製劑中保持它的生物學活性。例如,如果所述製劑中的抗體的生物學活性為在製備所述製劑時所表現出的生物學活性的大約70%~130%(在測定的誤差範圍內)內,就認為保持了它的生物學活性(例如,通過抗原結合測定確定)。
如該文所用,所述“治療有效量”或“有效量”表示在藥理學含義上,在該發明的範圍內,在預防或治療疾病方面的有效量。對於所述疾病的治療來說,所述抗體是有效的。“治療”表示治療性治療和預防性或防禦性措施。需要治療的受試者包括業已患有有關病症的受試者,以及需要預防有關疾病的受試者。
如該文所用,所述“TNF-α”是指人TNF-α(該文簡稱為hTNF-α),表示人細胞因子,它是以17kD的分泌形式和26kD膜締合形式存在的,它的生物學活性形式包括非共價結合的17kD分子的三聚體。hTNF-α的結構進一步披露於以下文獻中:例如,Pennica,D.,等(1984)Nature312:724-729;Davis,J.M.,等(1987)Biochemistry26:1322-1326;和Jones,E.Y.,等(1989)Nature338:225-228。術語人TNF-α意在包括重組人TNF-α(rhTNF-α),它可以是通過標準重組表達方法製備的或通過商業渠道購買的(如R&D Systems,Catalog No.210-TA,Minneapolis,MN)。
如該文所用,所述“抗TNF-α抗體”是指以足夠親和力和特異性結合TNF-α的抗體。在某些實施方案中,所選擇的抗體通常會具有足夠的對TNF-α的結合親和力。抗體親和力可通過例如基於表面等離振子共振的測定法;酶聯免疫吸附測定法(ELISA)和競爭測定法(例如RIA)來測定。
抗體液體製劑
《一種穩定的抗TNF-α抗體製劑及其用途》的抗體液體製劑,主要包括:
(i)治療有效量的抗TNF-α抗體;
(ii)含0.8-6.2毫克/毫升組氨酸的緩衝體系;
(iii)滲透壓調節劑;
(iv)表面活性劑。
其中,可用於《一種穩定的抗TNF-α抗體製劑及其用途》製劑中的抗TNF-α抗體包括單克隆抗體,重組抗體,單鏈抗體,雜合抗體,嵌合抗體,人源化抗體,或它們的片段。還可以使用包括一個或兩個用於結合抗原的結合位點和免疫球蛋白的Fc-部分的抗體分子。該發明優選為單克隆抗體,該發明所述的抗TNF-α單克隆抗體可來源以下文獻:Guiding the selection of human antibodies from phage display repertoires to a single epitope of an antigen Biotechnology(N Y).1994,12(9):899-903)和專利:CN1935260B。通過該領域所公知的方法進行製備,也可以選用其它基因工程技術獲得的抗TNF-α單克隆抗體。一類優選的由其它基因工程技術獲得的抗TNF-α單克隆抗體包括阿達木單抗(adalimumab)、英夫利昔單抗(infliximab)、戈利木單抗(Golimumab)等。用於該發明製劑中的優選抗體是人抗體,它是從人細胞或從代表人抗體所有組成成分的基因文庫中克隆的。特別優選的人抗體是針對抗原TNF-α,包括人TNF-α(或hTNFα)的抗體。
存在於《一種穩定的抗TNF-α抗體製劑及其用途》製劑中的抗體的治療有效量是通過考慮需要的劑量體積和施用模式決定的。在該發明中,抗體的濃度為40-60毫克/毫升,優選45-55毫克/毫升,更優選為48-52毫克/毫升,最優選為50毫克/毫升。該發明包括使用上述任意值的組合作為上限和/或下限的值的範圍。
用於《一種穩定的抗TNF-α抗體製劑及其用途》製劑中的緩衝體系為包含組氨酸的緩衝體系,該緩衝體系中組氨酸可以單獨存在,或以以下形式存在,如組氨酸鹽酸鹽、組氨酸乙酸鹽、組氨酸磷酸鹽、組氨酸硫酸鹽等。在一個優選實施方案中,緩衝體系中的組氨酸單獨存在或以組氨酸鹽酸鹽形式存在。
《一種穩定的抗TNF-α抗體製劑及其用途》的滲透壓調節劑主要由多元醇和氯化鈉組成,其中“多元醇”是具有多個羥基的物質,並且包括糖(還原糖和非還原糖),糖醇和糖酸。“還原糖”是包括半縮醛基的糖,它能夠還原金屬離子或與蛋白中的賴氨酸和其他氨基共價反應,而“非還原糖”是不具備還原糖的上述特徵的糖。還原糖的例子包括果糖,甘露糖,麥芽糖,乳糖,阿拉伯糖,木糖。非還原糖包括蔗糖,海藻糖,山梨糖,松三糖和棉子糖。糖醇的例子包括甘露糖醇,木糖醇,赤蘚糖醇,蘇糖醇,山梨糖醇和甘油。至於糖酸,包括L-葡糖酸和它的金屬鹽。如果需要所述製劑是凍-融穩定的,所述多元醇優選是在冷凍溫度(例如,-20℃)下不會結晶的,以便它使所述製劑中的抗體去穩定化。
多元醇的用量可以根據所需要的製劑的等滲性而改變。《一種穩定的抗TNF-α抗體製劑及其用途》的製劑優選是等滲透的。所添加的多元醇的量還可以根據多元醇的分子量而改變。該發明優選的多元醇為糖醇。在該發明的優選實施方案中,多元醇為甘露醇或山梨醇,甘露醇或山梨醇的濃度為8-20毫克/毫升,更優選為10-15毫克/毫升,更優選為11-13毫克/毫升,該發明包括使用上述任意值的組合作為上限和/或下限的值的範圍。
氯化鈉的濃度為2-10毫克/毫升,優選為4-8毫克/毫升,更優選為5.5-6.5毫克/毫升。
《一種穩定的抗TNF-α抗體製劑及其用途》製劑中的表面活性劑優選非離子表面活性劑,如失水山梨醇聚氧乙烯醚脂肪酸酯(例如失水山梨醇聚氧乙烯(20)醚月桂酸酯,失水山梨醇聚氧乙烯(20)醚油酸酯等)或泊洛沙姆(例如泊洛沙姆188)。所添加的表面活性劑的量使其能減少製劑中的抗體的聚集和/或減少顆粒在製劑中的形成和/或減少吸附。在該發明的優選的表面活性劑為聚山梨酯,如吐溫80。在一優選的實施方案中,聚山梨酯的濃度為0.6-1.0毫克/毫升,優選為0.8-1.0毫克/毫升,更優選為0.9-1.0毫克/毫升。該發明包括使用上述任意值的組合作為上限和/或下限的值的範圍。
《一種穩定的抗TNF-α抗體製劑及其用途》通過緩衝體系來調節製劑的pH值,以控制pH在5.5-6.5的範圍內,在某些實施方案中,製劑的pH處於5.5至6.4、5.6至6.3、5.7至6.2、5.8至6.1、5.9至6.0之間,該發明包括使用上述任意值的組合作為上限和/或下限的值的範圍。在一些優選的實施方案中,製劑pH為5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4或6.5。
應理解,《一種穩定的抗TNF-α抗體製劑及其用途》的緩衝體系除包括組氨酸以外,還可進一步包括一種或多種其他緩衝組分,通過與其他緩衝組分的組合將製劑的pH值控制在上述範圍。適合的其他緩衝組分包括檸檬酸鹽、磷酸鹽、乙酸鹽(例如乙酸鈉),琥珀酸鹽(例如琥珀酸鈉)等。
《一種穩定的抗TNF-α抗體製劑及其用途》優選的實施方案中,緩衝體系為組氨酸—鹽酸,其中組氨酸濃度為0.8-6.2毫克/毫升,優選為1.6-5.0毫克/毫升,更優選為3.0-3.8毫克/毫升。該發明包括使用上述任意值的組合作為上限和/或下限的值的範圍。在另一種實施方案中,所述製劑的pH是用檸檬酸、乙酸或磷酸等無機酸調節的。
發明人經過大量的實驗和數據篩選發現,當該發明製劑中組氨酸的濃度低於0.8毫克/毫升時,緩衝體系的緩衝能力將受到明顯的限制,當組氨酸的濃度高於6.2毫克/毫升時,對製劑穩定性並無提高作用,並且可能引起不良反應。
此外,發明人經過反覆的試驗,對各類緩衝體系的組分及含量進行了大量的篩選,並最終從大量的緩衝體系中篩選得到了該發明的組氨酸體系,並且發現在該體系中,抗體蛋白的穩定性明顯提高。
《一種穩定的抗TNF-α抗體製劑及其用途》的製劑中可包括一種或多種其它藥學可接受載體、賦形劑或穩定劑,諸如那些在Remington's Pharmaceutica1Sciences16th edition,Osol,A.Ed.(1980)中記載的,只要它們對製劑的期望特徵沒有不利影響。可接受載體、賦形劑或穩定劑在所採用的劑量和濃度對接受者是無毒的,而且包括別的共溶劑;抗氧化劑,包括抗壞血酸和甲硫氨酸;整合劑,諸如EDTA;金屬複合物(例如Zn一蛋白質複合物);生物可降解聚合物,諸如聚醋;和/或成鹽反荷離子。
《一種穩定的抗TNF-α抗體製劑及其用途》的製劑可採用該領域公知的方法將各種組分按一定的濃度進行組合製備。
一類優選的方法主要包括以下步驟:
用Ultracel-30K超濾離心管將抗TNF-α單克隆抗體通過離心(4500轉,4-10℃)濃縮換液至不同製劑緩衝液中,用製劑緩衝液將蛋白濃度調整到所需濃度。採用0.22微米 Millex針頭濾器將製劑過濾除菌。對所製備的製劑進行包裝以方便使用,選用的包材可以是玻璃瓶、預填充注射器或筆式注射器。
《一種穩定的抗TNF-α抗體製劑及其用途》提到的上述特徵,或實施例提到的特徵可以任意組合。該案說明書所揭示的所有特徵可與任何組合物形式並用,說明書中所揭示的各個特徵,可以被任何提供相同、均等或相似目的的替代性特徵取代。因此除有特別說明,所揭示的特徵僅為均等或相似特徵的一般性例子。
實施案例
SEC測試方法
按照《中華人民共和國藥典》(2010年版,三部)附錄ⅢB進行測定,用親水矽膠體積排阻色譜柱TSKG3000SWxl,上樣量100微克,流動相為20mMNa2HPO4+300mM NaCl pH6.8,流速0.5毫升/分鐘,檢測波長280納米,柱溫25℃,用面積歸一化法計算。
設備:美國安捷倫1260高效液相色譜分析儀
IEC測試方法
按照《中華人民共和國藥典》(2010年版,三部)附錄ⅢB進行測定,用弱陽離子交換柱Thermo WCX-104.0×250毫米色譜柱,保護柱為Thermo WCX-10G4.0×50毫米,流動相A、B進行梯度洗脫(A:10mM NaH2PO4·2H2O pH7.5;B:10mM NaH2PO4·2H2O+500mM NaCl pH7.5)。流速1.0毫升/分鐘,檢測波長280納米,柱溫35℃,連續進樣2次,進樣量100微克。
設備:美國安捷倫1260高效液相色譜分析儀
《一種穩定的抗TNF-α抗體製劑及其用途》以下實施例、對比例中的液體抗體製劑通過常規方法,將各組分進行混合來製備。
以下實施例中的抗TNF-α單克隆抗體的分子來源參見文獻:Guiding the selection of human antibodies from phage display repertoires to a single epitope of an antigen Biotechnology(N Y).1994,12(9):899-903)和專利:CN1935260B。採用該領域公知的抗體製備工藝,經過基因工程細胞培養,Protein A層析及其它分離純化步驟精製而成。
實施例1
製劑中各組分與含量如表1所示:

表1
實施例2
製劑中各組分與含量如表2所示:
表2

表2
對比例1
製劑中各組分與含量如表3所示:
表3

表3
通過高效陽離子交換色譜(IEC-HPLC)表征抗TNF-α單克隆抗體的化學穩定性,以IEC-HPLC主峰下降和酸性組分上升百分比作為判定手段,測試結果見表4和表5。
表4 37℃±2℃蛋白電荷異構變化結果(IEC主峰下降百分比)
表5 37℃±2℃蛋白電荷異構變化結果(IEC酸性組分上升百分比)

表5
從表4可以看出,與對比例1相比,《一種穩定的抗TNF-α抗體製劑及其用途》製劑(實施例1和2)中抗體電荷異構變化分別在14天和1個月的IEC主峰下降百分比和IEC主峰上升百分比均顯著降低,上述結果表明,製劑中抗體的化學降解反應速率明顯降低,抗體的化學穩定性得到了明顯提高,因此提高了產品質量的均一性和一致性,有助於延長抗TNF-α單克隆抗體的貨架期。
通過對實施例1、實施例2和對比例1的製劑分別進行SEC檢測,判斷製劑中抗體純度的變化,測試結果如表6所示:
表637℃±2℃蛋白純度變化結果(SEC主峰百分比)
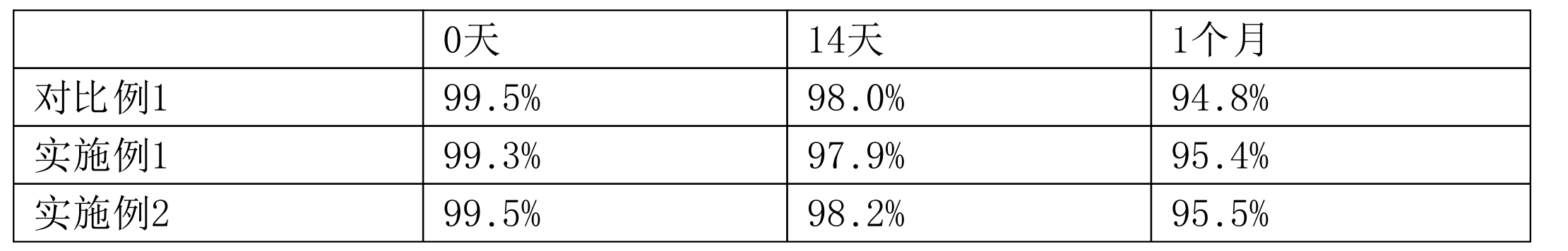
表6
從表6可以看出,《一種穩定的抗TNF-α抗體製劑及其用途》製劑(實施例1和2)中抗體分別在0天、14天和1個月的SEC主峰百分比與對比例的SEC主峰百分比相當,該結果表明,《一種穩定的抗TNF-α抗體製劑及其用途》製劑中的抗體任具有較高的蛋白純度,保持優異的穩定性。
發明人還分別對實施例1、實施例2和對比例1的製劑的其它穩定性指標,包括外觀、蛋白濃度、濁度均進行了測試比較,結果發現上述的穩定性指標均與對比例1中製劑的指標相當,該結果表明,《一種穩定的抗TNF-α抗體製劑及其用途》的製劑保持優異的穩定性。
此外,《一種穩定的抗TNF-α抗體製劑及其用途》中的製劑由於不含檸檬酸組分,因此可減輕或消除由其引起的病人注射部位的不良反應,提高病人的用藥舒適度。
對比例2
該對比例中的製劑各組分和含量均與實施例1相同,不同之處在於對比例2中製劑pH為5.0。
對比例3
該對比例中的製劑各組分和含量均與實施例1相同,不同之處在於對比例3中製劑pH為7.0。
通過高效陽離子交換色譜(IEC-HPLC)表征《一種穩定的抗TNF-α抗體製劑及其用途》的製劑(實施例1)和對比例2和3製劑中抗TNF-α單克隆抗體的化學穩定性,以IEC-HPLC主峰下降和酸性組分上升百分比作為判定手段,測試結果見表7。
表7 37℃±2℃下12天的蛋白電荷異構變化結果

表7
從表7可以看出,與對比例2和3相比,《一種穩定的抗TNF-α抗體製劑及其用途》製劑中抗體的IEC主峰下降百分比和IEC主峰上升百分比均顯著降低,上述結果表明,《一種穩定的抗TNF-α抗體製劑及其用途》製劑中抗體的化學降解反應速率明顯降低,抗體的化學穩定性得到了明顯提高。
通過對實施例1、對比例2和對比例3的製劑分別進行SEC檢測,判斷製劑中抗體純度的變化,測試結果如表8所示:
表8 37℃±2℃下的蛋白純度變化(SEC)
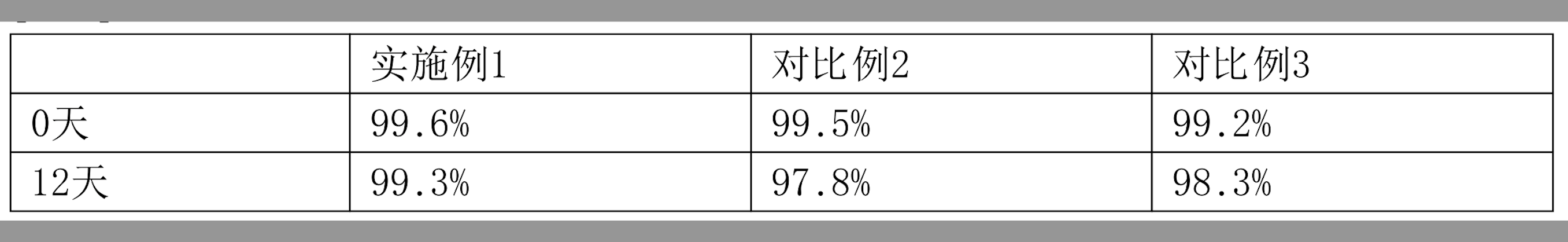
表8
表8顯示了抗體在35-39℃下放置12天后蛋白純度的變化結果,從上表可以看出,《一種穩定的抗TNF-α抗體製劑及其用途》的製劑在放置12天后,其抗體純度的下降程度明顯低於對比例2和3中的抗體純度的下降值。
榮譽表彰
2020年7月14日,《一種穩定的抗TNF-α抗體製劑及其用途》獲得第二十一屆中國專利獎優秀獎。

