專利背景
免疫吸附一種新技術,用於治療一些傳統方法難以奏效的疾病。它將
抗原、
抗體或某些具有特定物理化學親和力的物質作為配體與載體結合,製成吸附柱,利用其特異性吸附性能,選擇性或特異性地去除患者血液中內源性致病因子,從而達到淨化血液、緩解病情的目的。2019年前臨床上套用免疫吸附能夠通過特異性地去除自身抗體,治療多種自身免疫性疾病和器官移植排斥反應,以及通過吸附低密度脂蛋白治療高膽固醇血症及其併發症。這項技術與血漿交換相比,能迅速有效選擇性去除多種自身抗體,具有治療劑量大,不丟失血漿有用成分,不需置換血漿,可避免傳播疾病的可能等優點,而且治療效果顯著。同時由於配體和抗體之間專一而可逆的結合,免疫吸附材料能反覆洗脫重複使用,降低了患者的治療成本。2001年,在英國倫敦召開了歐洲第一屆免疫吸附研討會,來自17個國家的200多位專家學者參加了會議,重點討論了免疫吸附在風濕病、腎臟病、神經系統疾病、血液病和心血管疾病中套用的經驗,免疫吸附治療已逐漸成為血液淨化技術的一個重要分支,日益受到醫學界的廣泛關注。
截至2019年4月,研究合成出來的免疫吸附材料雖然不少,但主要都還是用於分離和純化抗原(或抗體),用於臨床治療疾病的並不多,實際療效相對肯定且已被患者廣泛接受的僅有蛋白A免疫吸附柱。這主要是因為用於血液淨化的免疫吸附產品要求非常高,它必需符合如下要求才能進入人體治療:(1)安全性:連線上去的配體牢固不易脫落進入血液,無毒性、無菌、無熱源等;(2)有效性:因為人體內要被吸附去除的物質含量大,要通過吸附降到一定的水平才能達到治療效果;(3)較高的選擇性,即非特異吸附要小,以減少其治療的副作用;(4)良好的生物相容性:即無毒、不溶解、不激活補體和凝血系統、不致敏等;(5)穩定性好,便於反覆再生、儲存和消毒;(6)成本不能太高:因為是套用於臨床治療,而且用量大,病人必須能承受該治療的費用,因此成本要低,最好能重複使用以降低成本等。2019年前,臨床上使用的商品化的蛋白A免疫吸附柱(瑞典GABRO公司)採用的載體是Sepharose CL-4B瓊脂糖凝膠,與蛋白A通過溴化氰活化偶聯。由於溴化氰是劇毒物質,合成過程對人體和環境危害較大;另外,用溴化氰方法偶聯的蛋白A基團容易脫落進入人體,對病人產生較大的副作用,因而這一合成工藝不甚理想。
夏列波等人發明了一種蛋白A-瓊脂糖免疫吸附材料的製備方法,他們採用環氧氯丙烷(申請號:01103114.X,公開號:CN1365853A)作為偶聯試劑活化瓊脂糖載體後與氨水反應。由於氨水分子較小,得到的免疫吸附材料間隔臂不夠長,另外我們在實驗中發現氨水反應活性低,偶聯蛋白A少,合成得到的蛋白A免疫吸附材料對抗體的吸附效率低。
在前期研究中,曾發明一種瓊脂糖偶聯蛋白A的方法(申請號:200610123707.7,公開號:CN101185878A),該方法使用環氧溴丙烷活化後,用多胺類試劑作為間隔臂,接與戊二醛反應,然後與蛋白A偶聯。使用該方法的合成步驟較多,而且二胺、二醛反應都會有交聯副反應發生,同時由於胺與醛反應生成席夫鹼(Schiff base),即有碳氮雙鍵生成,使得材料具有顏色,因此需要使用大量的還原劑,將材料還原成白色狀態,未還原的碳氮雙鍵具有比較明顯的非特異性吸附,存放過程中顏色會進一步加深。為此我們又發明了一種使用高碘酸鹽氧化活化瓊脂糖的方法偶聯蛋白A(申請號:201010512308.8,公開號:CN102000550A),該方法使用高碘酸鹽氧化瓊脂糖,製備含有醛基的瓊脂糖凝膠,再與蛋白A偶聯,製備的蛋白A吸附材料顏色與瓊脂糖顏色基本一致,且顏色不會隨使用過程而變深,但是用該方法蛋白A的脫落量較高,且偶聯間隔臂較短,吸附量較低。
發明內容
專利目的
《一種用於靶向吸附的蛋白A吸附材料及其製備方法》的目的在於克服上述2019年4月之前技術的不足之處而提供一種用於靶向吸附的蛋白A吸附材料,其結構穩定、脫落量低、安全性高、吸附效率高。
技術方案
《一種用於靶向吸附的蛋白A吸附材料及其製備方法》採取的技術方案包括以下幾個方面:
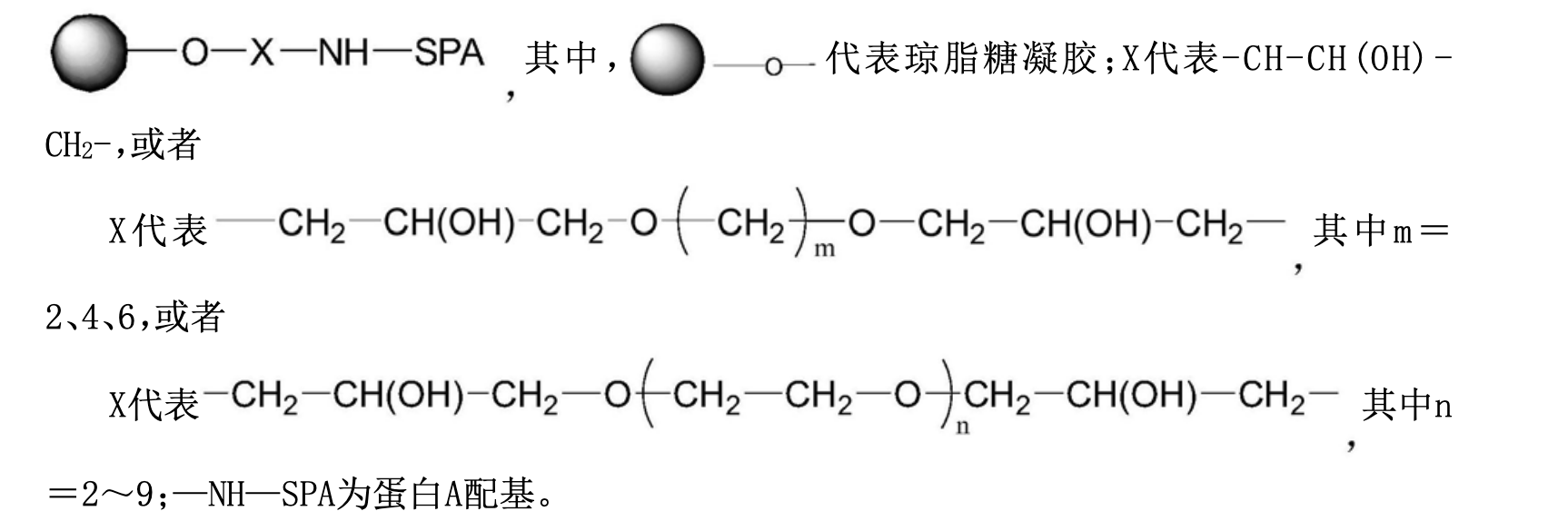
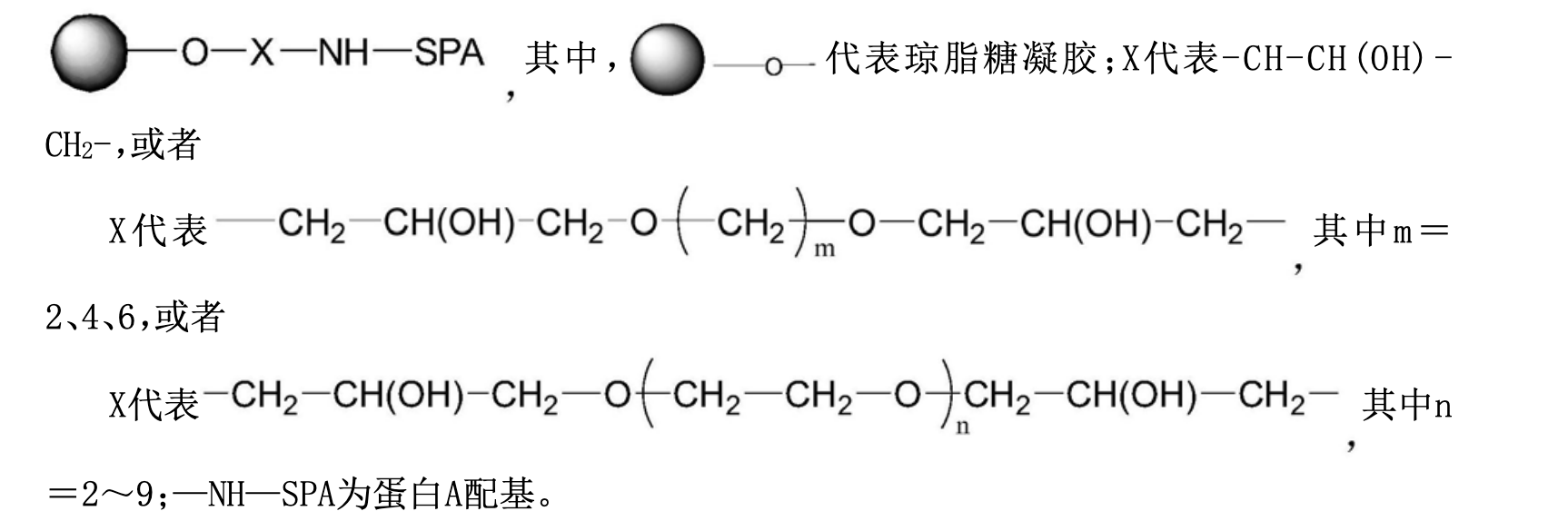
在第一個方面,該發明提供了一種用於靶向吸附的蛋白A吸附材料,所述吸附材料是將蛋白A通過共價偶聯在瓊脂糖凝膠微球載體上的高分子材料,其化學結構為:
作為該發明的另一個方面,該發明提供了上述的吸附材料的製備方法,包括步驟:以瓊脂糖凝膠微球為載體,將瓊脂糖凝膠與偶聯試劑反應形成帶有環氧基的活化瓊脂糖凝膠微球,然後與蛋白A的氨基偶聯,製備瓊脂糖凝膠-蛋白A的吸附材料,即得,其中,偶聯試劑為鹵代環氧化合物和/或雙縮水甘油醚類試劑。
優選地,所述瓊脂糖凝膠微球經化學交聯劑交聯製備,其耐壓>0.3兆帕、流速≥150厘米/小時(條件是:柱床50厘米*25厘米,100千帕,25℃),且瓊脂糖凝膠微球的粒徑分布範圍為20~200微米,優選分布範圍為45~165微米。
優選地,所述蛋白A為基因工程重組蛋白A。優選地,所述鹵代環氧化合物為環氧氯丙烷或環氧溴丙烷。優選地,所述雙縮水甘油醚類試劑為乙二醇雙縮水甘油醚、1,4-丁二醇雙縮水甘油醚、1,6-己二醇雙縮水甘油醚或聚乙二醇雙縮水甘油醚。
優選地,包括如下步驟:
(1)偶聯試劑與瓊脂糖凝膠微球在0.4~1.0摩爾/升的鹼性水溶液中,於20~45℃下反應活化,其中,瓊脂糖凝膠在反應體系中的體積比為30%~50%;
(2)步驟(1)反應結束後,過濾瓊脂糖凝膠微球,用水清洗乾淨;
(3)將步驟(2)所製備的活化後的瓊脂糖凝膠微球置於pH為7.0~10.0的緩衝液中,加入蛋白A,於0~40℃下反應6~24小時;
(4)步驟(3)所得產物與封端試劑進行端基封閉反應;
(5)步驟(4)所得產物用水沖洗乾淨,即得蛋白A吸附材料。
更優選地,所述步驟(1)中活化反應溫度為30℃~40℃,反應時間優選為1~3小時。
優選地,所述步驟(3)中緩衝液為磷酸鹽緩衝液、碳酸鹽緩衝液或硼酸緩衝液。更優選為硼酸緩衝液,pH值優選8.0~9.0。更優選地,所述鹼性水溶液為金屬氫氧化物,優選為氫氧化鈉或氫氧化鉀水溶液,濃度為0.4~1.0摩爾/升,優選0.6~0.8摩爾/升。
優選地,所述步驟(1)偶聯試劑中,鹵代環氧化合物和雙縮水甘油醚類試劑的體積比為0.0~1.0:1.0~0。由此,當偶聯試劑中某一種化合物的體積為0時,偶聯試劑即為單一種類的化合物。更優選地,所述步驟(3)中反應溫度為4~25℃,反應時間為8~12小時。
優選地,所述步驟(4)中封端試劑為甘氨酸乙酯鹽酸鹽和/或乙醇胺,甘氨酸乙酯鹽酸鹽與乙醇胺的質量比為0.0~1.0:1.0~0。由此,甘氨酸乙酯鹽酸鹽或乙醇胺與瓊脂糖凝膠微球上殘留的環氧基團反應,以消除環氧活性基團。更優選地,所述步驟(4)中封端反應時間為10~24小時。
更優選地,所述製備方法包括如下步驟:
(1)取瓊脂糖凝膠,用注射用水沖洗乾淨後,加入0.4~1.0摩爾/升的鹼性水溶液、鹵代環氧化物、雙縮水甘油醚類試劑,攪拌,在20~45℃下反應,反應結束後,使用注射用水將瓊脂糖凝膠沖洗乾淨,得到環氧基活化的瓊脂糖凝膠;
(2)取環氧基活化的瓊脂糖凝膠在pH為7.0~10.0緩衝液體系中與蛋白A偶聯,在0~40℃下攪拌6~24小時,反應結束後用注射用水清洗乾淨;
(3)將步驟(2)合成的瓊脂糖凝膠與含有封端試劑的溶液混合,封閉未反應的環氧基,反應結束後用注射用水沖洗乾淨,製備得蛋白A吸附材料。
在第三個方面,該發明提供了上述用於靶向吸附的蛋白A吸附材料在血液淨化中的套用。
有益效果
《一種用於靶向吸附的蛋白A吸附材料及其製備方法》的有益效果為:
(1)該發明選用鹵代環氧化物和雙縮水甘油醚類組合物為活化試劑,活化後能在瓊脂糖凝膠微球表面形成兩種以上長度的活性間隔臂;兩種以上長度的活性間隔臂進一步與蛋白A反應後能形成長短不一的蛋白A吸附配基,能更好地暴露蛋白A的活性位點,提高吸附材料的吸附性能;
(2)該發明的吸附材料的吸附效率高,再生性能好;
(3)該發明的吸附材料中蛋白A配基與瓊脂糖凝膠微球之間通過穩定的醚鍵連線,結構穩定,吸附劑顏色穩定,脫落量低,安全性高;
(4)以上顯著優勢和效果在臨床治療上表現為能提高臨床治療效果、安全性和可靠性;體外血漿吸附試驗數據表明,該發明的蛋白A免疫吸附材料對人體血漿抗體IgG具有靶向吸附能力。
權利要求
1.一種用於靶向吸附的蛋白A吸附材料,其特徵在於,所述吸附材料是將蛋白A通過共價偶聯在瓊脂糖凝膠微球載體上的高分子材料,其化學結構為:
2.權利要求1所述的吸附材料的製備方法,其特徵在於,包括步驟:以瓊脂糖凝膠微球為載體,將瓊脂糖凝膠與偶聯試劑反應形成帶有環氧基的活化瓊脂糖凝膠微球,然後與蛋白A的氨基偶聯,製備瓊脂糖凝膠-蛋白A的吸附材料,即得,其中,偶聯試劑為鹵代環氧化合物和/或雙縮水甘油醚類試劑。
3.根據權利要求2所述的製備方法,其特徵在於,所述瓊脂糖凝膠微球經化學交聯劑交聯製備,瓊脂糖凝膠微球耐壓>0.3兆帕、流速≥150厘米/小時,且瓊脂糖凝膠微球的粒徑分布範圍為20~200微米,優選分布範圍為45~165微米。
4.根據權利要求2所述的製備方法,其特徵在於,所述蛋白A為基因工程重組蛋白A。
5.根據權利要求2所述的製備方法,其特徵在於,所述鹵代環氧化合物為環氧氯丙烷或環氧溴丙烷。
6.根據權利要求2所述的製備方法,其特徵在於,所述雙縮水甘油醚類試劑為乙二醇雙縮水甘油醚、1,4-丁二醇雙縮水甘油醚、1,6-己二醇雙縮水甘油醚或聚乙二醇雙縮水甘油醚。
7.根據權利要求2所述製備方法,其特徵在於,包括如下步驟:
(1)偶聯試劑與瓊脂糖凝膠微球在0.4~1.0摩爾/升的鹼性水溶液中,於20~45℃下反應活化,其中,瓊脂糖凝膠在反應體系中的體積比為30%~50%;
(2)步驟(1)反應結束後,過濾瓊脂糖凝膠微球,用水清洗乾淨;
(3)將步驟(2)所製備的活化後的瓊脂糖凝膠微球置於pH為7.0~10.0的緩衝液中,加入蛋白A,於0~40℃下反應6~24小時;
(4)步驟(3)所得產物與封端試劑進行端基封閉反應;
(5)步驟(4)所得產物用水沖洗乾淨,即得蛋白A吸附材料。
8.根據權利要求7所述的製備方法,其特徵在於,所述步驟(1)中偶聯試劑中,鹵代環氧化合物和雙縮水甘油醚類試劑的體積比為0.0~1.0:1.0~0。
9.權利要求7所述的製備方法,其特徵在於,所述步驟(4)中封端試劑為甘氨酸乙酯鹽酸鹽和/或乙醇胺,甘氨酸乙酯鹽酸鹽與乙醇胺的質量比為0.0~1.0:1.0~0。
10.權利要求1或權利要求2~9任一項製備的吸附材料在血液淨化中的套用。
實施方式
該發明提供了一種從血漿中去除致病抗體及其複合物的蛋白A吸附材料,它能夠安全、高效和高選擇性地去除患者血漿中的致病抗體,尤其是免疫複合形式的致病抗體。該發明還提供上述蛋白A吸附材料的製備方法,該方法無毒、無害,製備得到的吸附材料對抗體的吸附效率高。該發明還提供上述吸附材料在血液淨化中的套用。
在一些實施例中,該發明以瓊脂糖凝膠微球為載體,將瓊脂糖凝膠與偶聯試劑鹵代環氧化物和雙縮水甘油醚類試劑組合物反應形成帶有環氧基的活化瓊脂糖凝膠微球,然後與蛋白A的氨基偶聯,製備瓊脂糖凝膠-基因工程重組蛋白A吸附材料。該方法在合成過程中不使用二胺、二醛,製備的蛋白A吸附材料與瓊脂糖顏色一致,為純白色,吸附劑顏色穩定,蛋白A配基與瓊脂糖凝膠微球之間通過穩定的醚鍵連線,結構穩定,脫落量低,安全性高,且所偶聯試劑的不同組合配比可以形成長短不一的偶聯間隔臂,能更好地暴露蛋白A的活性位點,提高吸附材料的吸附性能。
在一些實施例中,該發明涉及一種用於靶向吸附的蛋白A吸附材料的製備方法,所述吸附材料由瓊脂糖凝膠微球經活化偶聯試劑或其組合物活化後,通過共價鍵與蛋白A配基偶聯製備而成;吸附材料具有吸附蛋白A的量高,配基脫落量低和安全性高的特點,可用於臨床上各種免疫性疾病和器官排斥反應的免疫吸附治療,靶向清除患者血漿中的致病抗體及以免疫複合形式存在的致病抗體。
實施例1環氧基活化瓊脂糖凝膠的合成
將100克瓊脂糖凝膠(Sepharose 6FF)用10倍體積左右的注射用水沖洗乾淨後,加入100毫升的1M NaOH溶液、30毫升環氧溴丙烷和70毫升、1,4-丁二醇二縮水甘油醚和0.2克硼氫化鈉,攪拌,30℃下反應1.5小時,反應結束後用大量的注射用水沖洗乾淨,得到環氧活化的瓊脂糖凝膠。
實施例2蛋白A吸附材料的合成
在500毫升的反應容器中加入實施例1合成的環氧活化瓊脂糖凝膠100毫升,0.1摩爾/升的硼酸鹽緩衝液150毫升,控制體系pH值為7.5到8.5,加入14克基因工程重組蛋白A,在37℃恆溫體系里反應20小時,停止反應,用大約10倍體積的注射用水沖洗填料,沖洗乾淨後,加入200毫升0.2M的乙醇胺溶液封閉未反應的環氧基,20℃反應10小時。反應完之後,用大量注射用水沖洗,最後將其保存在含有防腐劑的溶液中保存。
實施例3吸附性能對比
分別取實施例2合成的蛋白A吸附材料、使用二胺和二醛(與實施例2的唯一區別)為間隔臂合成的蛋白A吸附材料、使用高碘酸鹽(與實施例2的唯一區別)氧化活化瓊脂糖偶聯蛋白A製備的蛋白A吸附材料各1毫升,分別裝於Ф0.8×5厘米的柱中,使用生理鹽水充分沖洗柱子,將10毫升血漿以1毫升/分鐘流速過柱,是抗體I給G、吸附在吸附材料上。然後用30毫升的生理鹽水沖洗乾淨血漿,使用pH=2.8的0.01M的檸檬酸-磷酸氫二鈉緩衝液作為洗脫劑將媳婦在吸附材料上的人體免疫球蛋白IgG洗脫下來,收集洗脫液,將洗脫液定容到100毫升,使用紫外-可見光分光光度計檢測洗脫液在280納米附近的吸收峰吸收值,IgG在洗脫液中的濃度於280納米附近的吸收峰吸收值成正比關係,檢測結果參見表1。
從表1的數據可知,採用該發明的製備方法合成的蛋白A吸附材料的吸附量比上述其他兩種方法製備的吸附材料的吸附量分別提高了33.3%和40.5%。
實施例4蛋白A脫落量對比
分別取實施例2合成的蛋白A吸附材料、使用二胺和二醛(與實施例2的唯一區別)為間隔臂合成的蛋白A吸附材料、使用高碘酸鹽(與實施例2的唯一區別)氧化活化瓊脂糖偶聯蛋白A製備的蛋白A吸附材料各50毫升,裝在Ф4×10厘米的層析柱中,使用3L生理鹽水沖洗柱子,取最後100毫升作為檢驗液,取檢驗液用蛋白A ELISA試劑盒及酶聯免疫檢測儀進行檢測,檢測結果如下表2所示。
從表2的結果可知,採用該發明的方法製備的蛋白A吸附材料相比上述其他兩種方法製備的吸附材料,蛋白A脫落量分別減少了67.8%和79.5%。
榮譽表彰
2021年11月,《一種用於靶向吸附的蛋白A吸附材料及其製備方法》獲得第八屆廣東專利獎優秀獎。