介紹
噬菌體(bacteriophage, phage)是感染細菌、真菌、藻類 、放線菌或螺旋體等微生物的病毒的總稱,因部分能引起宿主菌的裂解,故稱為噬菌體。本世紀初在葡萄球菌和志賀菌中首先發現。作為病毒的一種,噬菌體具有病毒的一些特性:個體微小;不具有完整細胞結構;只含有單一核酸。可視為一種“捕食”細菌的生物。噬菌體基因組含有許多個基因,但所有已知的噬菌體都是細菌細胞中利用細菌的核糖體、蛋白質合成時所需的各種因子、各種胺基酸和能量產生系統來實現其自身的生長和增殖。一旦離開了宿主細胞,噬菌體既不能生長,也不能複製 。噬菌體是病毒的一種,其特別之處是專以細菌為宿主,較為人知的噬菌體是以大腸桿菌為寄主的T2噬菌體。跟別的病毒一樣,噬菌體只是一團由蛋白質外殼包裹的遺傳物質,大部分噬菌體還長有“尾巴”,用來將遺傳物質注入宿主體內。噬菌體是一種普遍存在的生物體,而且經常都伴隨著細菌。通常在一些充滿細菌群落的地方,如:泥土、動物的內臟里,都可以找到噬菌體的蹤影。世上蘊含最豐富噬菌體的地方就是海水 。
生物學性狀
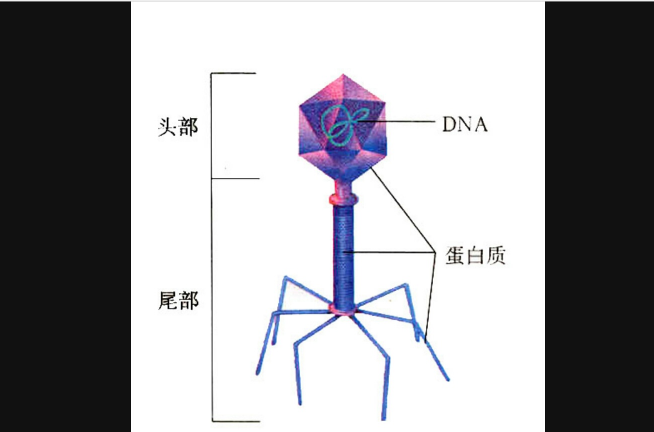
噬菌體的體積小,其形態有蝌蚪形、微球形和細桿形,以蝌蚪形多見。噬菌體是由核酸和蛋白質構成。蛋白質起著保護核酸的作用,並決定噬菌體的外形和表面特徵。其核酸只有一種類型,即DNA或RNA,雙鏈或單鏈,環狀或線狀。
種類
蛋白質結構
無尾部結構的二十面體:這種噬菌體為一個二十面體,外表由規律排列的蛋白亞單位——衣殼組成,核酸則被包裹在內部。
有尾部結構的二十面體:這種噬菌體除了一個二十面體的頭部外,還有由一個中空的針狀結構及外鞘組成的尾部,以及尾絲和尾針組成的基部。
線狀體:這種噬菌體呈線狀,沒有明顯的頭部結構,而是由殼粒組成的盤旋狀結構。
迄今已知的噬菌體大多數是有尾部結構的二十面體,這是因為正多面體是多面體裡最簡單的結構,搭建起來最容易,所以病毒喜歡採用正多面體的結構。而正多面體一共又只有五種,分別是正4, 6, 8, 12, 20面體,其中正20面體是最接近球形的,也就是在體積相同的情況下,需要更少的材料,更為節省。
核酸特點
ss RNA:噬菌體中所含的核酸是單鏈RNA。
ds RNA:噬菌體中所含的核酸是雙鏈RNA。
ss DNA:噬菌體中所含的核酸是單鏈DNA。
ds DNA:噬菌體中所含的核酸是雙鏈DNA。
繁殖特點
1.毒性噬菌體
指在宿主菌體內複製增殖,產生許多子代噬菌體,並最終裂解細菌。毒性噬菌體的增殖方式是複製,其增殖過程經歷吸附穿入、生物合成和成熟釋放3個階段。
進入菌細胞內的噬菌體核酸首先經早期轉錄產生早期蛋白質,並複製子代核酸,再進行晚期轉錄產生噬菌體的結構蛋白。子代噬菌體達到一定數量時,由於噬菌體合成酶類的溶解,菌細胞突然裂解,釋放出的噬菌體再感染其他敏感細菌。
2.溫和噬菌體
感染宿主菌後並不增殖。其基因整合於細菌染色體上,即前噬菌體,隨細菌染色體的複製而複製,並隨細菌分裂而分配至子代細菌的染色體中。溫和噬菌體有溶原性周期和溶茵性周期,可偶爾自發地或在某些理化或生物因素地影響下,整合的前噬菌體脫離宿主菌染色體,進入溶菌性周期導致細菌裂解,並產生新的成熟噬菌體。
發現歷史
初期:1915年-1940年
1915年,弗德里克· 特沃特(Frederick W.Twort)擔任倫敦布朗研究所所長。特沃特在研究中力圖尋找用於天花疫苗的痘苗病毒(vaccina virus)的變異株(variant ) ,這種變異株可能在活細胞外介質中複製。他在一項試驗中將一部分天花疫苗接種給一個含營養瓊脂的培養盤。雖然這種病毒未能複製,但是細菌污染物在瓊脂盤中生長很快。特沃特繼續進行他的培養並注意到,一些細菌菌落顯示出“帶水的樣子”(即變得比較透明)。這樣的菌落做進一步培養時也不再能複製(即細菌被殺死)。特沃特把這種現象稱為透明轉化(glassy transformation)。他接著證明用透明轉化原理感染一個正常的細菌菌落會把這種細菌殺死。這種透明實體很容易通過一個陶瓷過濾器,可被稀釋一百萬倍,當放在新鮮細菌上的時候就會恢復它的實力,或者說滴度。
特沃特發表了一篇描述這種現象的短文,認為對他所觀察的結果的解釋是存在一種細菌病毒。由於服役於第一次世界大戰,特沃特的研究中斷了。返回倫敦後,他沒有繼續進行這項研究因此在這個領域沒有作出進一步的貢獻。
與此同時,加拿大醫學細菌學家費利克斯· 德赫雷爾(Felix d’Herelle)當時正在巴黎的巴斯德研究所工作。1915年8 月,法國的一個騎兵中隊駐紮在巴黎郊外的梅宗-勒菲特(Maisons-Lafitte) ,一場嚴重的志賀氏桿菌引發的痢疾對整個部隊造成了毀滅性的打擊。德赫雷爾對患者的糞便進行過濾,很快從過濾的乳狀液中分離出痢疾桿菌,並且加以培養。細菌不斷生長,復蓋了培養皿的表面。德赫雷爾偶然觀察到清楚的圓點,上面沒有長出任何細菌。他把這些東西稱為乳樣斑(taches vierges),或稱為噬斑(plaques)。德赫雷爾跟蹤觀察一名患者的整個感染過程,觀察何時細菌最多,斑點何時出現。有意思的是,患者的病情在感染後的第四天開始好轉。
德赫雷爾把這些病毒(virus )稱為噬菌體(bateriophage) ,緊接著他發明了病毒學研究領域的方法。他將噬斑進行有限的稀釋,測定病毒的濃度。他的推論是出現斑點表明病毒為顆粒或稱為小體(corpuscular)。德赫雷爾在研究中還證明病毒感染的第一步是病原體附著(吸附)宿主細胞。他通過把病毒與宿主細胞混合後共沉澱證明了這一點。(他還證明,上清中不存在這種病毒)一種病毒的附著只是在細菌對與它混合的病毒敏感時才出現,這表明了一種病毒對宿主細胞的吸附有特定的範圍。他還用很清楚的現代術語描述了細胞溶菌(lysis )的釋放。德赫雷爾在許多方面是現代病毒學原理的創始人之一。
到1921 年,越來越多的溶原性菌株(lysogenic bacterial strain) 被分離,在一些實驗中已經不可能把病毒與它的宿主分開。這使布魯塞爾巴斯德研究所的朱勒斯· 博爾德特(Jules Bordet)認為,德赫雷爾描述的傳染性病原體只不過是一種促進自身繁殖的細菌酶(bacterial enzyme)。雖然這是一種錯誤的結論,但是它相當接近於朊病毒(prion)結構和複製的看法。
在20 世紀20-30 年代,德赫雷爾重點探索他的研究成果在醫學上的套用,但是毫無成果。當時進行的基礎研究常常受該領域個別科學家的強烈個性所產生的解釋的影響。顯然有許多不同的噬菌體,一些為溶菌性(lytic)而另一些則是溶原性(lysogenic ) ,但是它們之間的相互關係仍然定義不明確。這個時期的重要發現是馬克斯· 施萊辛格,他證明純化的噬菌體最大直徑(linear dimension )0.1 微米,質量大約4x10克,它們由蛋白質和DNA 構成,比例大體上相等。1936 年那時沒有任何人清楚地知道如何利用這種觀察結果,但是,它在隨後的20 年裡產生了重大影響。
現代:1938 年-1970 年
馬克斯· 德爾布呂克(Max Delbruck )是吉廷根大學(Gittinge)培養出來的物理學家。他的第一份工作是在柏林威廉化學研究所,在那裡他與一些研究人員積極地討論量子物理與遺傳學的關係。德爾布呂克對這個領域的興趣使他發明了一種基因的量子機械模型(guantum mechanical model of gene )。1937 年,他申請並獲得了在加利福尼亞理工學院學習的獎學金。一到加利福尼亞理工學院他就開始與另一位研究員埃默里· 埃利斯(Emory Ellis)合作。埃利斯當時正在研究一組噬菌體-T2 、T4 、T6 ( T-偶數噬菌體)。德爾布呂克很快認識到這些病毒適合研究病毒複製。這些噬菌體是探索遺傳信息如何決定一種生物體的結構和功能的一個途徑。從一開始,這些病毒就被視為了解癌症病毒,甚至了解精子如何使卵子受精並發育為一種新生物體的典型系統。埃利克和德爾布呂克設計出一步生長曲線試驗。在這項試驗中,一種受感染的細菌經過半個小時的潛伏期(latent period)或稱為隱蔽期(eclipse period )之後釋放了大量噬菌體。這項試驗給潛伏期下了定義,即病毒失去傳染性的時候。這成為這個噬菌體研究小組的試驗範例。
第二次世界大戰爆發後,德爾布呂克留在美國(在范德比爾特大學),見到了義大利難民薩爾瓦多·盧里亞(Salvador E . Luria )。盧里亞逃到美國避難,當時在紐約州哥倫比亞大學研究T1和T2噬菌體。他們是1940 年12 月28 日在費城舉行的一次會議上見面的,並在隨後的兩天裡策劃在哥倫比亞大學的試驗。兩位科學家將招聘和領導越來越多的研究人員重點研究利用細菌病毒作為了解生命進程的一個模型。對他們的成功起關鍵作用的是1941 年夏天他們應邀到冷泉港實驗室做試驗。就這樣一位德國物理學家和一位義大利遺傳學家在二戰期間一直進行合作,週遊美國招聘新一代的生物學家,後來這些人被稱為噬菌體研究小組。
此後不久,新澤西州普林斯頓RCA 實驗室的電子顯微學家湯姆· 安德森(Tom Anderson )見到了德爾布呂克。到1942 年3 月,他們第一次獲得了噬菌體的清晰照片。大約同時,這些噬菌體變異株第一次被分離和鑑定。到1946 年,冷泉港實驗室開設了第一門噬菌體課程,1947 年3 月,第一次噬菌體會議有8 人出席。分子生物學就是從這些緩慢的開端中發展起來的。這門科學的重點是研究細菌宿主及其病毒。
隨後的25 年(1950 年至1975 年)是用噬菌體進行病毒學研究碩果纍纍的時期。數百名病毒學家發表了數千篇論文,主要涉及三個領域:(a)用T-偶數噬菌體進行的大腸桿菌溶菌性感染研究;(b) 利用λ噬菌體進行的溶原性研究,以及(c)幾種獨特噬菌體的複製和特性研究,例如ФX174 (單鏈環狀DNA )、RNA 噬菌體、T7 等。它們為現代分子病毒學和生物學奠定了基礎。本文不可能一一介紹所有這些科學文獻,只能提及一些有選擇的重點。
到1947年至1948年,用生物化學方法研究噬菌體感染細胞在潛伏期發生的變化開始盛行。西摩·科恩(Seymour Cohen )最初曾在哥倫比亞大學與歐文· 查格夫(Erwin Chargaff)一道研究脂質和核酸,隨後又與溫德爾· 斯坦利研究菸草花葉病毒RNA ,1946年在冷泉港實驗室主修德爾布呂克的噬菌體課程。他利用比色法(colorimetric analisis )研究被噬菌體感染的細胞中DNA 和RNA 水平的影響。這些研究表明,被噬菌體感染的細胞中大分子合成發生了戲劇性的改變:(a) RNA 的淨積累在這些細胞中停止。[後來,這成為發現多種RNA 的基礎,並且第一次證明了信使RNA 的存在]。(b) DNA 合成停止了7 分鐘,隨後又以5 倍至10 倍的速度恢復DNA 合成。(c)與此同時,蒙諾德(Monod)和沃爾曼(Wollman)的研究表明,噬菌體感染後一種細胞酶——可誘導β-半乳糖苷酶(galactosidase)的合成受到抑制。這些試驗把病毒的潛伏期分為初期(在DNA 合成之前)和晚期兩個階段。更重要的是這些研究結果表明,病毒可能改變受感染細胞的大分子合成過程。
到1952 年底,兩項試驗對這個領域產生了重要影響。首先,赫爾希和蔡斯利用標記病毒蛋白(SO)和核酸(PO)跟蹤噬菌體對細菌的附著。他們能用攪拌機去除病毒的蛋白質衣殼,只保留與受感染細胞有聯繫的DNA 。這使他們能夠證明這種DNA 具有再生大量新病毒所需的全部信息。赫爾希-蔡斯的試驗和沃森與克里克一年後闡述的新DNA 結構共同構成了分子生物學革命的奠基石。
病毒學領域的第二項試驗是1953年由懷亞特(G.R.Wyatt)和科恩(S.S.Cohen)進行的。他們在研究T-偶數噬菌體時發現一個新的鹼基,即5‘羥甲基胞嘧啶(hydroxymethylcytosine)。這個新發現的鹼基似乎取代了細菌DNA 中的胞嘧啶(cytosine )。這使科學家們開始對細菌和受噬菌體感染的細胞中DNA 的合成進行了長達10 年的研究。最關鍵的研究表明,病毒把遺傳信息引入受感染的細胞中。到1964 年,馬修斯(Mathews)等人的研究證明,未受感染的細胞中不存在5‘羥甲基胞嘧啶,並且必須由病毒為之編碼。這些試驗提出了脫氧嘧啶(deoxypyrimidine)生物合成和DNA 複製方面的早期酶學概念,提供的明確的生物化學證據表明可以編碼一種新的信息並在受感染的細胞中表達。對這些噬菌體的詳細遺傳分析後確認了編碼這些噬菌體蛋白質的基因,並繪製了基因圖使概念更完整。實際上,對T-偶數噬菌體的rⅡ 和B 順反子(cistron )的遺傳分析成為研究最充分的“遺傳精細結構”之一。利用噬菌體變異株和提取物體外複製病毒DNA ,對我們當代了解DNA 如何自我複製作出了重要貢獻。最後,通過對噬菌體裝配的詳細遺傳學分析,利用噬菌體突變株體外裝配的互補性闡明了有機體如何利用自我裝配的原理構建複雜結構。對噬菌體溶菌酶的遺傳和生物化學分析有助於闡述突變的分子性質,噬菌體突變(琥珀突變)提供了在分子水平研究第二位點抑制突變(second-site suppressor mutation)的明確方式 。DNA的環形排列、末尾冗餘(引起噬菌體雜合體)結構可以解釋T 偶數噬菌體的環形遺傳圖。
病毒和細胞蛋白質的合成在受噬菌體感染的細胞中發生明顯變化,這一點是在早期研究中使用十二烷基硫酸鈉一聚丙烯醯胺凝膠(sodium dodecyl sulfate (SDS)-polyacrylamide gels)而被戲劇性地發現,結果表明病毒蛋白質的合成有特定順序,分為早期蛋白質和晚期蛋白質。這種一過性的基本調節機制最終發現了調節RNA 聚合酶和授予基因特殊性的∑因子。幾乎每一個級別的基因調節(轉錄、RNA 穩定性、蛋白合成、蛋白處理)的研究均是通過對噬菌體感染性研究得出的原始數據揭示的。
雖然溶菌噬菌體(lytic phage)研究取得如此顯著的進展,但是仍然沒有人能清楚地解釋溶源性噬菌體(lysogenic phage)。這種局面在1949年發生了變化,當時,巴斯德研究所的安德烈· 勒沃夫(Andre Lwoff) 開始對Bacillus megaterium 及其溶源性噬菌體進行研究。通過使用一種顯微操縱器將單一細菌分割多達19 次,從未釋放出任何病毒。當從外部對溶源性細菌進行溶解時,也沒有發現病毒。但是經常出現一個細菌自發地發生溶解並釋放出許多病毒來的現象。紫外線能誘使這些病毒釋放是一項重要的發現,這種觀察可以概述一種病毒與其宿主之間的奇妙關係。到1954 年,巴斯德研究所的雅各布( Jacob)和沃爾曼(Wollman )得出重要的研究結果,即一種溶源性菌株(Hfr ,λ)與非溶源性受體在結合之後的遺傳雜交(genetic cross )導致病毒的誘發。他們把這個過程稱為合子誘導(zygotic induction )。事實上溶源性噬菌體或稱原噬菌體(prophage)在其宿主大腸桿菌的染色體中的位置,可在遺傳雜交之後用標準的中斷交尾實驗繪圖。這是在概念上了解溶源性病毒的最關鍵試驗之一,理由如下:( a )病毒的行為就像一種細菌的染色體上的細菌基因一樣;( b )它表明病毒遺傳物質由於負面的調節而在病毒中保持靜止的試驗結果之一。當染色體從溶源性供體細菌傳遞到非溶源性受體宿主時,該病毒遺傳物質丟失;( c )這有助於解釋雅各布和沃爾曼早在1954 年就認識到的酶合成以及噬菌體生成的誘導是同一現象的表現”。這些試驗為操縱子模型(operon model )和協同基因調控(coordinate gene regulation)的性質奠定了基礎。
雖然在1953 年闡述了DNA 的結構 , 1954 年描述了合子誘導,但是溶源現象中細菌染色體與病毒染色體之間的關係仍被稱為附著部位(attachment site ) ,當時也只能從這些角度考慮。後來,坎貝爾(Campbell)根據噬菌體標記的順序在整合狀態下不同於複製或生長狀態這一事實,提出DNA 與細菌染色體進行λ整合的模型,至此,病毒與其宿主之間的真正密切關係才得到認識。這導致分離出λ噬菌體的負調節基因或稱抑制基因,這是對溶原菌免疫特性的清楚了解,也是對基因如何進行協同調節的早期範例之一。對λ噬菌體生命周期的遺傳分析是微生物遺傳學領域的重大學術探險。它值得所有分子病毒學和生物學學者進行詳細的研究。
諸如鼠傷寒沙門氏菌(Salmonella typhimurium)P22 這樣的溶源性噬菌體是一般性轉導(transduction ) 的第一個例證,而λ噬菌體是特殊轉導的第一個例證。病毒可能攜帶細胞基因,並把這樣的基因從一個細胞轉移到另一個細胞,這不僅提供了精確遺傳繪圖的一種方法,而且也是病毒學中的一個新概念。隨著細菌的遺傳因素被更詳細地研究,可以清楚地看出,從溶源性噬菌體研究發展到附加體( episome)、轉座子(transposon)、反轉錄轉座子(retrotranspon )、插入元件(insertion element )、逆轉錄病毒(retrovirus)、嗜肝DNA 病毒(hepadnovirus )、類病毒(viroid )、擬病毒(virusoid ,又稱類病毒viroid-like指一類包裹在植物病毒顆粒中的病毒,譯者注),以及朊病毒(prion )研究,這一切使得遺傳信息在病毒與其宿主之間的定義和分類的關係開始變得模糊不清。從噬菌體研究中得出的遺傳和生化概念使病毒學的進一步發展成為可能。溶菌和溶源性噬菌體研究的經驗和教訓常常隨著對動物病毒的研究而被人們重新學習和修改。
細菌防禦方法
細菌防禦噬菌體的主要方法是合成能夠降解外來DNA的酶。這些酶被稱為限制性內切酶,它們能夠剪下噬菌體注入細菌細胞的病毒DNA。細菌還含有另一個防禦系統,這一系統利用CRISPR序列來保留其過去曾經遇到過的病毒的基因組片段,從而使得它們能夠通過RNA干擾的方式來阻斷病毒的複製。這種遺傳系統為細菌提供了一個類似於獲得性免疫的機制來對抗病毒感染。
套用
作為分子生物學研究的試驗工具
噬菌體是遺傳調控、複製、轉錄與翻譯等方面的生物學基礎研究和基因工程中的重要材料或工具。遺傳學中的轉導作用就是以噬菌體作為媒介,在2株細菌間傳遞遺傳物質。
用於細菌的鑑定和分型
噬菌體只能侵染相應的細菌,具有高度的特異性,可用於細菌鑑定。同時,噬菌體具有型的特異性,可對細菌進行分型鑑定。可以利用噬菌體對沙門氏菌、大腸桿菌和傷寒菌等進行分型。
噬茵體展示技術和噬菌體抗體庫
噬菌體展示技術是一種強有力的基因表達篩選技術,1985年首次由美國科學家SmithMl在(Science))雜誌進行了闡述。噬菌體展示技術的基本原理是將外源蛋白的基因克隆到噬菌體的基因組DNA中,從而在噬菌體的表面表達特定的外源蛋白。Ellis SEp等指出利用噬菌體展示多肽庫可以篩選和確定線蟲疫苗的抗原,這是疫苗抗原鑑定的一種新方法。近年來隨著流行性病毒引起的疾病逐漸增加,抗病毒多肽被認為是預防和治療疾病極有希望的方法。Castel G等指出噬菌體展示技術特異性表達的重組多肽可以套用到抗病毒研究及藥物開發中。
在噬菌體展示技術及PCR克隆技術基礎上,英國科學家Winter等率先在(Nature))雜誌上發表文章闡述噬菌體抗體庫技術。該技術是將抗體重鏈和輕鏈可變區基因與噬菌體的外殼蛋白基因重組,將抗體片段Fab或scFv與噬菌體外殼蛋白以融合蛋白的形式展示於噬菌體顆粒表面,進而快速高效篩選並富集針對某種抗原的特異性抗體,從根本上改變了傳統的單抗製備流程。Krishnaswamy等利用噬菌體抗體庫技術篩選到抗白色念珠菌HM一1殺傷毒素的scFv—C1陽性噬菌體抗體,該噬菌體抗體比單克隆抗體結合抗原的特異性高60倍。刑佑尚等報導了噬菌體抗體庫技術在生物寄生蟲檢測、病毒檢測、轉基因產品檢測、藥物殘留檢測等領域的套用,指出此技術在檢驗檢疫領域具有天然的契合優勢和光明的前景。噬菌體抗體庫技術必將成為抗體生產的主要技術,將給人類在疾病診斷、腫瘤研究、自身免疫性疾病研究、基因治療、疾病防治和發病機制等方面帶來極為廣闊的前景。
用於檢測和控制致病菌
食品和環境中存在許多致病菌,研究表明噬菌體能夠檢測和控制食品和環境中致病菌及腐敗菌的生長。Bmvko LYu等討論了噬菌體檢測致病菌的優缺點,指出利用噬菌體檢測食品安全及加工製造過程等方面存在的致病菌具有極大的套用前景。姜琴等指出利用噬菌體可以實時、快速而準確地檢測食品中的沙門氏菌,在公共和食品衛生、畜牧獸醫和121岸檢疫中具有重要的意義。劉心妍認為噬菌體不僅可用於檢測食源性致病菌,還可以套用在原料採集環節殺滅病原菌、生產或加工環節對設備等進行消毒、延長食品儲藏期、消毒新鮮水果蔬菜等方面。
噬菌體療法在各領域中的套用
噬菌體在宿主細胞中生長繁殖,能夠引起致病菌的裂解,降低致病菌的密度,從而減少或避免致病菌感染或發病的機會,達到治療和預防疾病的目的,即噬菌體療法¨“。此療法已廣泛套用於獸醫、農業和食品微生物學等領域。
(1)噬菌體療法在畜牧業中的套用
國內養殖業尤其是養雞業常常受到畜禽腸道腹瀉病的困擾,此病主要是由大腸桿菌、沙門氏菌等致病微生物引起。隨著耐藥性細菌的大量出現,用具有專一性強、不易產生抗性等優點的相關噬菌體來治療細菌疾病受到重視。Smith和Barrow等利用噬菌體療法可以降低羊羔、仔豬和雛雞患大腸桿菌腸道疾病的機率。
(2)噬菌體療法在水產養殖中的套用
爆發性疾病的頻繁發生給水產養殖業造成巨大的經濟損失,細菌性疾病噬菌體療法在水產養殖業具有良好的套用前景。Park等在治療Pseudomonas plecoghssicida等病菌引起的細菌性血型腹水感染時,通過餵食含噬菌體的食物可以有效清除致病細菌。
(3)噬菌體療法在治療人類疾病中的套用
噬菌體療法首先在人類疾病治療中得到套用。1921年,Bruynoghe和Maisin率先用噬菌體製劑治療葡萄球菌引起的皮膚感染。此後噬菌體廣泛套用於耳喉科、口腔科、眼科、皮膚科、兒科及肺部疾病等的治療。隨著抗生素的出現,噬菌體療法被漸漸忽視。Kutter 等報導噬菌體療法治療或預防人類疾病具有極大的潛力,指出通過實踐和試驗等方法最終使噬菌體療法商業化是避免此療法被忽視的關鍵。隨著細菌抗生素耐藥性的廣泛存在,在許多領域使用噬菌體控制致病菌的生長和擴增。噬菌體治療能夠避免腸道菌群失衡,保持機體的正常免疫力,被認為是替代抗生素的一種安全、有效和有潛力的微生態製劑忸。