基本介紹
p區元素概述
原子半徑
電子構型
氫化物穩定性
第二周期元素的反常性
第四周期元素性質的異樣性
氟、氯、溴、碘及其化合物

氧、硫及其化合物

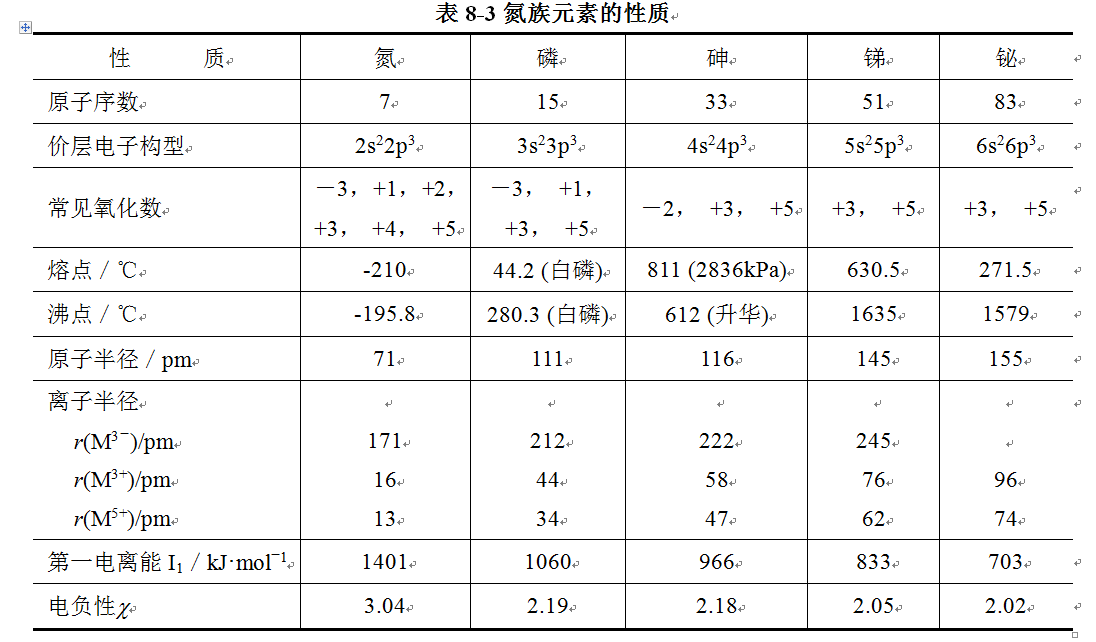
氮、磷、砷、銻、鉍及其化合物




p區元素包括元素周期表中IIIA族元素~0族元素。IIIA族元素又稱為硼族元素,包括硼B、鋁Al、鎵Ga、銦In、鉈Tl等元素IVA族元素又稱作碳族元素,包括碳C、矽Si、...
第14章p區元素19614.1硼族元素19614.1.1硼族元素概述19614.1.2硼及其化合物19714.1.3鋁及其化合物20114.2碳族元素20314.2.1碳族元素概述203...
第十章p區元素(一)215第一節p區元素概述215一、p區元素氧化值的特徵215二、p區元素性質的遞變215第二節鹵素216一、鹵素單質216...
第11章元素化學概論 11.1s區元素 11.1.1s區元素的性質 11.1.2s區元素化合物的性質 11.2p區元素 11.2.1p區元素的氧化還原性 11.2.2p區元素的氧化物...
一般來說,討論的元素為s區或p區元素,即主族元素居多,通常相關元素的族序數滿足A+B=C+D(或A+B=2C)關係的,可考慮將A、B等個數換為C、D(或1A、1B換...
任務二p區元素單質及化合物的性質識用46一、常用酸介紹46二、p區元素性質49三、p區元素化合物50【項目3】非金屬元素的性質驗證57...
目錄全書共九章,主要內容包括:溶液、表面化學與膠體化學、原子結構和元素周期律、...第一節s區元素165一、氫165二、鹼金屬和鹼土金屬167習題174第二節p區元素175...
元素化學篇(7~10章)在元素概述的基礎上,分別選述s區和p區、d區和ds區及f區元素及其重要化合物的性質和用途。知識擴展篇(11、12章)的化學熱點知識簡介和化學...
實驗13p區元素Ⅱ(硼族、碳族和氮族元素)71實驗14主族金屬元素(錫、鉛、銻、鉍)74實驗15d區元素Ⅰ(鉻、錳、鐵、鈷、鎳)77實驗16d區元素Ⅱ(銅、銀、鋅、...
實驗三p區元素錫、鉛、銻、鉍及其化合物的性質20實驗四p區元素氮、磷及其化合物的性質24實驗五p區元素氧、硫及其化合物的性質27...
第八章、第九章介紹元素化學,包括s區、p區、ds區、d區和f區元素。第十章至第十三章以定性分析和定量分析為主線,探討分析過程中的誤差及對分析結果進行正確評價...
11 2p區元素18711 2 1p區元素概述18711 2 2硼族元素18711 2 3碳族元素18811 2 4氮族元素19211 2 5氧族元素19611 2 6鹵素200...
11.2p區元素31011.2.1硼族元素31011.2.2碳族元素31211.2.3氮族元素31511.2.4氧族元素31711.2.5鹵素31811.3d區元素322...
還原反應、電化學基礎、物質結構基礎、原子結構、分子結構、固體結構、配合物結構、元素化學(S區元素、p區元素、p區元素、p區元素、d區元素、d區元素、f區元素)...
共價型氫化物,是由氫與鎂、鈹及p區元素(稀有氣體、銦、鉈除外)化合形成的氫化物。...... 共價型氫化物,是由氫與鎂、鈹及p區元素(稀有氣體、銦、鉈除外)化合...
實驗十三p區元素82實驗十四ds區元素90實驗十五d區元素93實驗十六常見陽離子的分離與鑑定(Ⅰ)97實驗十七常見陽離子的分離和鑑定(Ⅱ)104...
實驗十s區元素化合物的性質60實驗十一p區元素化合物的性質62實驗十二過渡元素(銅、鋅、汞)的性質64實驗十三分析天平稱量練習66實驗十四酸鹼標準溶液的配製和比較滴定...
金屬配位化合物、酸鹼平衡和酸鹼滴定、沉澱溶解平衡和沉澱滴定、條件穩定常數和絡合滴定、條件電勢和氧化還原滴定、S區元素、P區元素、d區元素、f區元素、氫、核...
元素及其化合物的性質實驗、化學原理與物理化學常數的測定、物質的分離與提純、...實驗7p區重要非金屬及其化合物的性質107 實驗8主族重要金屬及其化合物的性質111...
