物理性質
氙在常溫常壓下為無色無臭無毒的
惰性氣體,在放電管中為藍色至綠色的氣體。
 氙的原子光譜
氙的原子光譜原子半徑:4.05Å;
共價半徑:209pm;1.31Å;
沸點:-108.10℃(101.325kpa);
三相點:16.130K;
氣體密度:5.89kg·m-3(273.15K,101.325kpa);
液體密度:3057kg·m-3(-108.10℃,101.325kpa);
氣液體積比:518.9;
介電常數:1.001238(298K,101.325kpa);
磁化率:-43×10-1cgs·mol-1(298K,101.325kpa);
折射率:1.000702(g,273K,101.325KPa,5893A);
比容:0.180m
3·kg
-1(294.3K,101.325kPa);
熔化熱:17.49kJ·kg
-1(161.4K,81.6kPa);
氣化熱:96.30KJ·kg-1(165.1K,101.325kpa);
比熱容:Cp=160.03J/(kg·K)(g,298K,101.325kpa);Cv=96.41J/(kg·K)(g,298K,101.325kpa);
比熱比:Cp/Cv=1.67(g,298K,101.325kpa);
蒸氣壓:2634kPa(253K);4175kPa(273K);5147kPa(283K);
粘度:0.02110mPa·S(g,273K,101.325kPa);0.528mPa·S(l,289.74k);
導熱係數:0.005192W·m-1·K-1(273K,101.325kPa);165.014kh0.07322W·m-1·K-1(l);
化學性質
數據
電子排布:[Kr]5s
25p
6;
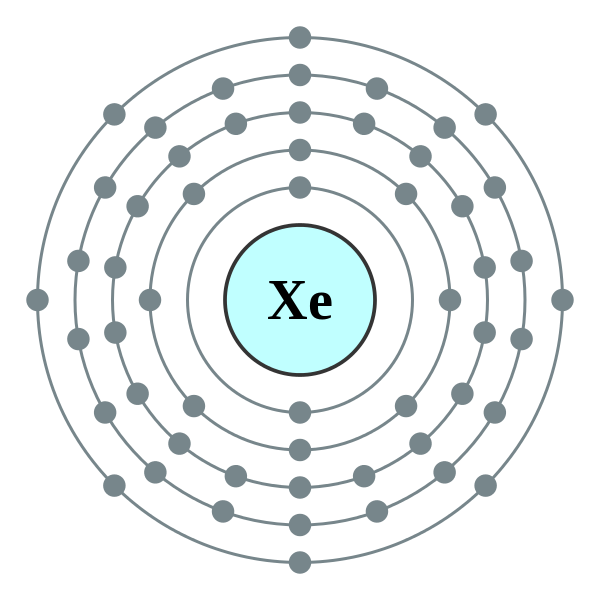 氙的電子排布
氙的電子排布電負性:2.60(泡林標度);
化學鍵能:Xe-O:84kJ ·mol-1;
氧化態:Xe(0), Xe(II), Xe(IV), Xe(VI), Xe(VIII);
電離能(kJ /mol):
I1:1170.4;
I2: 2046;
I3: 3097;
I4: 4300;
I5: 5500;
I6: 6600;
I7: 9300;
I8: 10600;
I9: 19800;
I10: 23000。
氙的電子構型非常穩定,且它的電離能相對較大,因此在化學上顯惰性,只與強的氧化劑反應。
氟化反應與氟化氙
氙氣與氟氣直接混合,可以得到無色的XeF
2,XeF
4與XeF
6晶體,氙與
氟的比例不同,得到的主產物不同:
Xe:F
2=2:1,1273K,1.03×10
5Pa或298K,紫外線光照:
;
Xe:F
2=1:5,873K,6.18×10
5Pa:
;
Xe:F
2=1:20,573K,6.18×10
5Pa:
;
若使用鎳、鈷和鈣的氟化物作為催化劑能顯著提高上述反應速率,使用Ag2O或Ni2O3則可以在零度時引起氟和氙的爆炸反應。一些氟化物則對反應催化具有選擇性,例如在Xe:F2=1:10,溫度為120℃時,使用氟化鎂作為催化劑,產物只有XeF2,若使用二氟化鎳作為催化劑,產物則只有XeF6。
氙的三種氟化物在室溫下都能穩定存在。
若將XeF
2溶於水中,則與水緩慢反應,又得到氙氣:
XeF
4與水反應時,一半發生反應
,另一半則歧化為Xe(0)與Xe(VI):
,反應過程中有疑似XeOF
2的黃色中間產物。
XeF
6與水發生的是水解反應:
,生成的XeOF
4則進一步與水反應,直到完全水解:
。生成的XeO
3可以溶解於水並穩定存在,不會進一步氧化水。鹼性時,XeF
6會歧化為不溶解的高氙酸鹽與氙氣。
氙的氟化物都是強的氧化劑與氟化劑,在工業生產上有實際用途,例如一些有機物的氟化,使用的就是XeF2。
含氧化合物
氙的氧化物有XeO3與XeO4,對應的酸根為氙酸根(HXeO4-)與高氙酸根(XeO64-)。
XeO3可用XeF4或XeF6與水反應製得,XeO3在酸性與中性溶液中穩定,在鹼性溶液中以HXeO4-形式存在,並且不穩定,易分解或歧化。
XeO
4可由高氙酸鋇與硫酸複分解製得:
,XeO
4是一種穩定性差,易爆炸的黃色固體,氧化性極強。
除上邊所述的XeF6歧化製法,高氙酸鹽亦可通過XeO3的鹼溶液與臭氧反應製得。
複合氟化物
在氙的化合物的發現史上,複合氟化物占有重要的地位。氙的第一個真正意義上的化合物正是複合氟化物
氟鉑酸氙(Xe
+PtF
6-),它是用Xe與強氧化劑PtF
6混合產生的:
。隨著Xe與PtF
6的用量的不同,氟鉑酸氙的組成可以在Xe
+:PtF
6-=0.5:1之間變化。氟鉑酸氙是一種發粘的橙黃色固體,在室溫下穩定,遇水分解出氙,氧氣,氟化氫和
二氧化鉑(IV)。其他一些金屬的六氟化物也可以與氙反應生成形如XeMF
6的化合物。
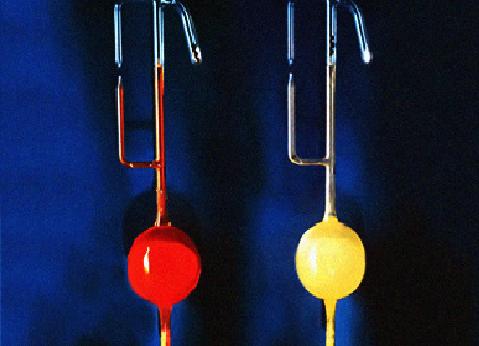 六氟化鉑(左)與六氟合鉑酸氙(右)
六氟化鉑(左)與六氟合鉑酸氙(右)將氙、氟和固態PF
5混合併
輝光放電,可以生成不穩定的XePF
6,同時氙、氟和玻璃儀器反應產生Xe
2SiF
6。將二氟化氙和一些金屬的五氟化物反應也可以生成XeMF
6型的化合物。
其它化合物
含有Xe-N鍵與Xe-C的化合物均被發現,典型代表是FXeN(SO2F)2與[Xe(C6F5)]·[C6F5BF3]。
氙還有氫醌包合物形式的化合物,其中氙被捕集至氫醌的晶格之中。
研究歷史
氙於1898年7月由拉姆齊(
William Ramsay)和特拉維斯(Morris W.Travers)在倫敦大學學院發現。在此之前,他們從液態空氣中提取了氖,氬和氪,並且疑惑它是否包含其它氣體。工業家Ludwig Mond給了他們一台新的液態空氣機,他們用它提取了更多的稀有氣體氪。經過多次蒸餾,他們終於分離出了一種更重的氣體,在真空管中它發出漂亮的藍色光芒。他們意識到它是氣體元素“惰性”組的又一個成員,因為其在化學上是惰性的。他選擇“ξένος(xenos)”這個希臘文命名氙,意為“陌生的”。
在“惰性氣體”中,氙的化合物(含有化學鍵的)是最先被發現的。
巴特列(Neil Bartlett)於1962年將PtF
6蒸汽與Xe混合,得到了橙黃色的XePtF
6晶體,打破了化學界中持續60年之久的“稀有氣體對化學反應完全惰性”的神話。21世紀,超過100種氙的化合物已經被製造出來。
同位素
氙的同位素中,110Xe至147Xe均被實驗室製得,其中能穩定存在的是124Xe,126Xe,128Xe~132Xe,134Xe與136Xe,自然界中豐度最大的是132Xe。
主要用途
氙廣泛用於電子、光電源工業,還用於
氣體雷射器和等離子流中。用氙氣充的燈泡與相同功率的充氬燈泡相比具有發光率高、體積小、壽命長、省電等優點。氙氣燈有極高的發光強度,一盞六萬瓦的氙燈的亮度,相當於九百隻一百瓦的普通燈泡。由於氙具有幾乎連續的光譜,因此可以在高壓電弧放電作用下產生類似日光的明亮白光,這種長弧氙燈俗稱“人造小太陽”,由於透霧能力特彆強,可用作有霧導航燈。氙閃光燈的色彩好,用於拍攝彩色電影。
 高壓氙氣燈的白色
高壓氙氣燈的白色氙燈可以放出紫外線,醫療上對此有所套用。氙的同位素被用於測量腦血流量與研究肺功能、計算胰島素分泌量等。
氙燈凹面聚光後可生成2500℃高溫,可用於焊接或切割難熔金屬,如鈦、
鉬等。
氙還是一種沒有副作用的深度麻醉劑,它能溶於細胞質的油脂中,引起細胞的膨脹和麻醉,從而使神經末梢的作用暫時停止。人們曾試用4/5的氙氣和1/5的氧氣組成
混合氣體,作為麻醉劑,效果很好。只是由於
氙氣很少,所以這種方法不能廣泛套用。
由於可以吸收X射線,氙也被用作X射線的禁止。
此外,氙在原子核反應堆和高能物理方面也有很多用途。
危險性
氙為非腐蝕性氣體,且本身無毒,人吸入後以原形排出,但在高濃度時有窒息作用。氙有麻醉性,它和氧的混合物是對人體的一種麻醉劑。
元素分布
空氣中含量:約90ppm;
地殼中含量:2×10-6ppm;
元素在海水中的含量:1×10-4ppm;
大氣中的Xe主要來自原始生成,岩石圈、小行星、隕石通過風化作用釋放出其中的稀有氣體。宇宙射線和其他高能粒子的核反應也能產生少量Xe。
製備方法
氙在空氣中的儲量達到19.5億噸,因此通過分餾液態空氣是製取氙的良好途徑。氙是空分工業的副產物。首先液化空氣,分餾出液氧,稀有氣體即富集於其中,通過進一步分餾,提純可分離出稀有氣體的混合液。173K時使用活性炭吸附,Ar,Kr與Xe被吸附,通過改變溫度及其他條件,可以獲得氙。
 氙的原子光譜
氙的原子光譜 氙的電子排布
氙的電子排布


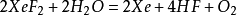

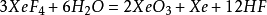




 六氟化鉑(左)與六氟合鉑酸氙(右)
六氟化鉑(左)與六氟合鉑酸氙(右) 高壓氙氣燈的白色
高壓氙氣燈的白色
 氙的原子光譜
氙的原子光譜 氙的電子排布
氙的電子排布


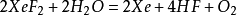

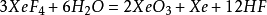




 六氟化鉑(左)與六氟合鉑酸氙(右)
六氟化鉑(左)與六氟合鉑酸氙(右) 高壓氙氣燈的白色
高壓氙氣燈的白色