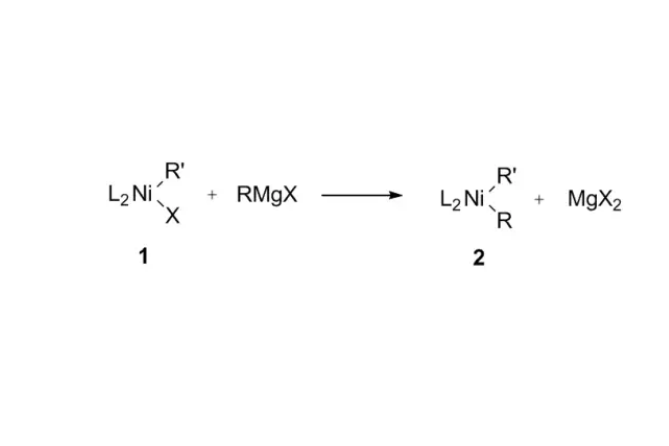
Kumada反應是鎳催化的格氏試劑與鹵代烴的交叉偶聯反應。
1960年,Chat和Shaw等發現,鎳鹵化物與格氏試劑能發生金屬交換反應(Transmetallation),生成二芳基鎳。
作為第一個Pd或Ni催化的交叉偶聯反應,由於可以直接使用簡便、經濟的格氏試劑,Kumada偶聯被用於苯乙烯衍生物的工業規模化生產,也是非對稱聯芳合成經濟、方便的首選方法。
基本介紹
- 中文名:Kumada交叉偶聯反應
- 實質:交叉偶聯反應
- 發現時間:1960年
- 底物:鎳催化的格氏試劑與鹵代烴
- 學科:有機化學
簡介,反應優點,反應原理,套用舉例,
簡介
交叉偶聯反應(Cross-coupling reaction)是在金屬催化劑催化下,RX(X=鹵素、OTf、磷酸酯等離去基團,R=烯基、聯烯基、烯丙基、苄基、炔基等)與金屬試劑形成C-C鍵的反應。從基元反應角度講,是RX與低價過渡金屬催化劑發生氧化加成,使R-X鍵斷裂生成R-M-X,R-M-X再與金屬試劑R'-M'發生金屬交換反應生成RMR',RMR'經還原消除在R與R'間形成一新的鍵,同時再生過渡金屬催化劑的反應過程。
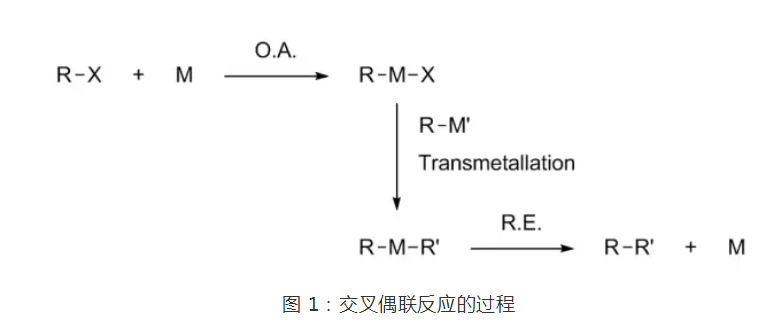
交叉偶聯反應
從20世紀70年代至今已經誕生了許多著名的交叉偶聯人名反應,包括Kumada反應、Suzuki反應、Stille反應、Negeshi反應、Sonogashira反應、Heck反應等。
Kumada反應是鎳催化的格氏試劑與鹵代烴的交叉偶聯反應。1960年,Chat和Shaw等發現,鎳鹵化物與格氏試劑能發生金屬交換反應(Transmetallation),生成二芳基鎳。
10年後的1970年,Uchino等發現,二芳基鎳可與鹵代烴反應生成一芳基鎳鹵化物,而使原來配合物中兩個連在鎳上的芳基間形成C-C鍵,從而生成了R-R'。
構想如果將這兩個反應進行加合,將鎳配合物作為催化劑,鹵代烴與金屬鎂試劑即可發生偶聯反應形成C-C鍵,這就是Kumada反應的設計思想。實驗結果確實證明了此設計思想的合理性。1972年,Corriu等也發表了類似的工作報導。由此揭開了交叉偶聯化學的序幕。這一反應稱為Kumada交叉偶聯或Kumada-Corriu交叉偶聯。此反應的溶劑一般為乙醚或四氫呋喃,但一般來說乙醚比四氫呋喃好,反應溫度從0℃到回流均可,所用催化劑一般為帶有雙齒膦配體的鎳配合物,如Ni(dppb)Cl2。反應通式如圖2。
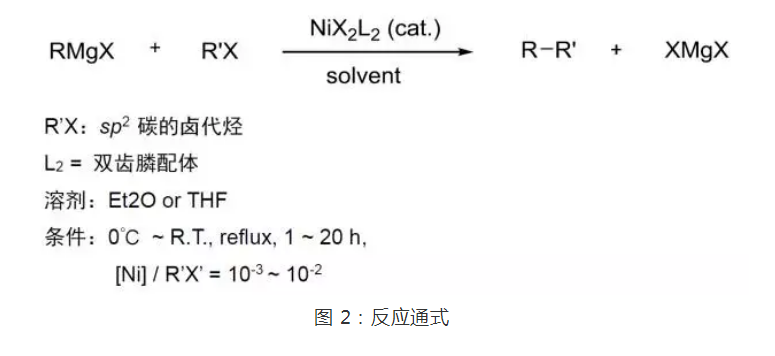
圖2 反應通式
反應優點
一是即使在低溫下反應也容易進行,二是可直接使用格氏試劑,而無需轉化成其他有機金屬試劑。缺點是由於格氏試劑鹼性和親核性強,能與許多官能團反應,因而不適用於在格氏試劑存在下不穩定的鹵代烴。
反應原理
催化循環過程如圖3所示:二價鎳催化劑前體L2NiX2與格氏試劑發生金屬交換反應,生成具有催化活性的物種——二芳(烯)基鎳配合物L2NiR2,此配合物與鹵代烴發生反應,生成一芳(烯)基鎳配合物L2NiR'X進入催化循環,一芳(烯)基鎳配合物與格氏試劑發生金屬交換反應,生成交叉的二芳(烯)基鎳配合物L2NiRR',後者與鹵代烴配位,Ni向C-X鍵反饋,促使二芳(烯)基鎳配合物L2NiRR'發生還原消除,釋放出產物RR',同時氧化加成插入R'-X中,回到一芳(烯)基鎳配合物L2NiR'X,完成催化循環。
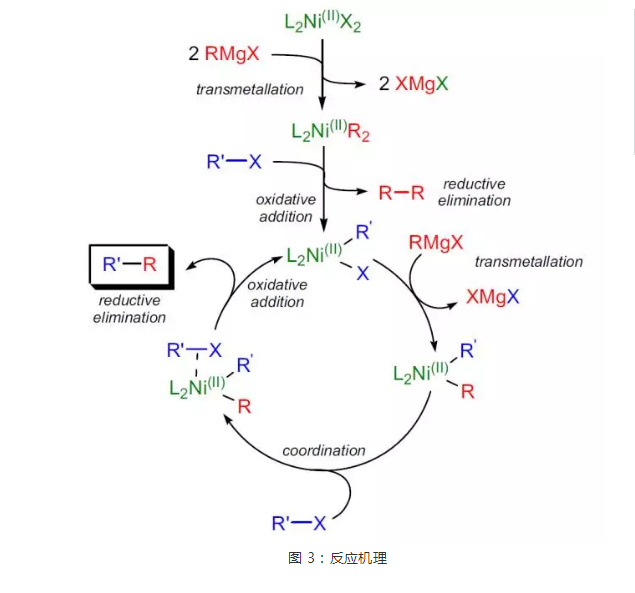
圖3 反應機理
烯基鹵化物的雙鍵在一般情況下其構型不發生變化,是一個立體專一性的反應(Stereospecific reaction)。
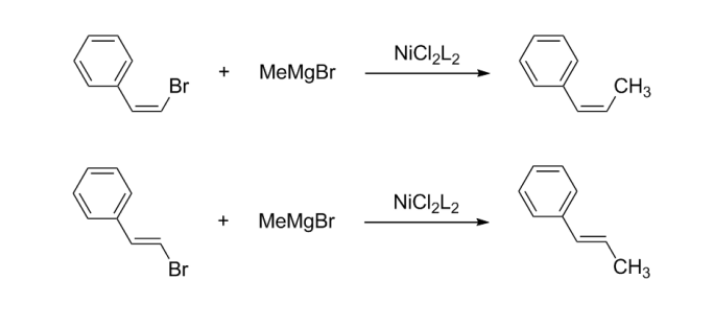
烯基鹵化物的立體專一性反應
但對於格氏試劑中的碳-碳雙鍵情形則不同,如Z式的2-苯乙基溴化鎂在鎳配合物存在下與芳基鹵代烴發生偶聯反應,生成了Z、E異構體的混合物,其原因是格氏試劑中的碳-碳雙鍵與鎳發生作用,導致順式雙鍵異構化為熱力學上更穩定的反式烯基格氏試劑。
套用舉例
作為第一個Pd或Ni催化的交叉偶聯反應,由於可以直接使用簡便、經濟的格氏試劑,Kumada偶聯被用於苯乙烯衍生物的工業規模化生產,也是非對稱聯芳合成經濟、方便的首選方法。
通過改變配體,利用Ni-Mg雙金屬的協同作用,Beller、Nakamura和Althammer分別發展了不活潑的氯代烷、氟代烷和非活化對甲苯磺酸酯參與的Kumada偶聯,拓展了Kumada偶聯的適用範圍。
Buchwald曾報導過在適當膦配體存在下,可實現官能化的Knochel型格氏試劑在低溫下與芳基苯交叉偶聯。
值得一提的是,在空氣中穩定的PinP(O)H可以作為配體的前體使用。
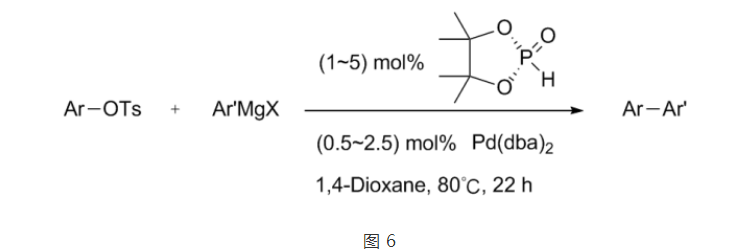
PinP(O)H 可以作為配體的前體使用
Y.Kobayashi等人在進行天然產物四氫大麻酚及其類似物全合成的最後階段套用了Kumada偶聯反應,反應底物是磷酸烯醇酯。
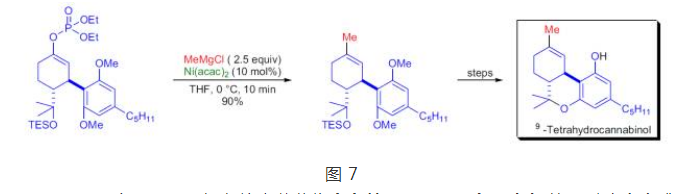
天然產物四氫大麻酚及其類似物全合成
E.N.Jacobsen課題組在抗真菌藥物安布替星的不對稱全合成中套用了Kumada偶聯反應,得到雙鍵構型完全保持的共軛二烯結構。
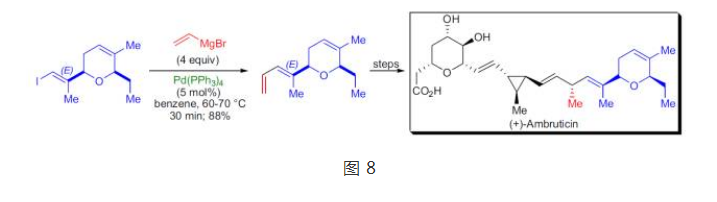
抗真菌藥物安布替星的不對稱全合成