HK2它是糖酵解途徑的第一個酶,也是糖酵解途徑的限速酶。
基本介紹
- 中文名: 己糖激酶
- 外文名:hexokinase2
基因信息,HK2的主要功能,HK2與細胞凋亡,HK2與疾病,
基因信息
基因簡稱:HK2
基因全稱: hexokinase 2 / 己糖激酶 2
基因全稱: hexokinase 2 / 己糖激酶 2
GENENBANK ID: NM_000189
別名:HKⅡ; HXK2
蛋白全稱:hexokinase-2,Hexokinase type II,Muscle form hexokinase
序列長度:917aa
分子量:102380 Da
別名:HKⅡ; HXK2
蛋白全稱:hexokinase-2,Hexokinase type II,Muscle form hexokinase
序列長度:917aa
分子量:102380 Da
HK2的主要功能
己糖激酶是催化己糖使之磷酸化的酶,它是糖酵解途徑的第一個酶,也是糖酵解途徑的限速酶。
己糖 + ATP → 己糖-6-磷酸 + ADP

在哺乳類動物的體內,一共有四種亞型的己糖激酶 (HKⅠ—Ⅳ),它們各自有一定的組織特異性。Ⅰ型在腦組織中表達特別高,Ⅱ型是胰島素敏感型的,主要存在於脂肪及肌組織中。除上述幾種組織外,Ⅰ、Ⅱ型在其他各種組織中亦有少量的表達。Ⅲ型在肝、腎和腸組織中有微量的表達。HKⅣ僅在肝和胰中存在,也就是我們所熟知的葡萄糖激酶,把它稱作HKⅣ有一定的誤解,因為它可使其他的己糖磷酸化。
在某種具體的組織中,HK各型之間的配比也隨著年齡的變化而變化。如在新生鼠的肝組織中,HKⅡ是占優勢的,而在成年鼠的肝組織中,其含量卻是微乎其微的; 而且在新生鼠的肝組織中,基本不表達HKⅣ,但隨著年齡的增長,其含量會逐漸增多。Ⅰ、Ⅱ、Ⅲ型分子量相近約為100 kDa,而Ⅳ型的分子量約為50 kDa。HKⅠ的C端與N端的序列有30%的同源性,這也暗示HKⅠ、Ⅱ和Ⅲ可能是由最初的50kDa的己糖激酶片斷複製、融合而成。
人類HKⅠ、Ⅱ、Ⅲ和Ⅳ的同源性較低,但是HKⅡ在哺乳動物中是高度保守的。
HK2與細胞凋亡
除了酶的催化活性,HKⅡ還可拮抗線粒體途徑的細胞凋亡,具體的機制還尚待深入研究。
在細胞凋亡過程中線粒體跨膜電位的耗散主要是由於線粒體內膜的通透性轉變,這是由於生成了動態的由多個蛋白質組成的位於線粒體內膜與外膜接觸位點的通透性轉變孔道(PT孔道) 。PT孔道由線粒體各部分的蛋白質與細胞質中蛋白質聯合構成。這包括細胞液蛋白:己糖激酶;線粒體外膜蛋白:外周苯並二嗪(benzodiazepine)受體與電壓依賴陰離子通道;線粒體膜間間隙蛋白:肌酸激酶;線粒體內膜蛋白:ADP-ATP載體;線粒體基質蛋白:親環蛋白D(cyclophilin D)等。凡是能夠專一作用於線粒體誘導PT孔道生成的物質,例如苯並二嗪受體的配基原卟啉IX等都能引起細胞凋亡。
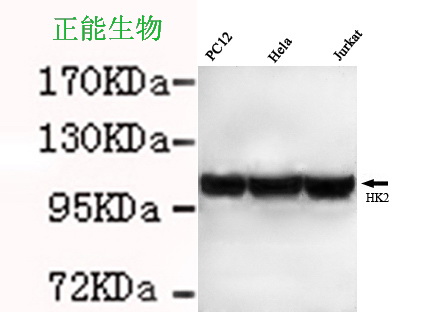
HK2與疾病
- 與Ⅱ型糖尿病(Type 2 Diabete Mellitus, T2DM)相關
T2DM發病機制和病因尚未十分清楚,其中胰島素抵抗(Insulin Resistance, IR)被認為是引發的始發因素。IR是指胰島素敏感的組織和細胞( 肝骨骼肌脂肪等) 對胰島素的敏感性出現不同程度的下降的一種病理生理狀態。 HKⅡ的活性降低所引起的細胞內葡萄糖磷酸化障礙和線粒體氧化磷酸化障礙均會使糖原的合成減少,從而導致IR。
- 與腫瘤相關
70多年前Warburg就發現了腫瘤的高糖代謝的特點。腫瘤細胞中大約60%的ATP來源於糖酵解途徑,在切除的肺、胃腸及乳腺惡性腫瘤的組織中已經證實其HK的含量是增高的,並且在乳腺癌中已經發現,當病灶發生轉移時,HK的活性會更高。也有研究報導,腎腫瘤組織中HK的活性會增加,而且會發生相應亞型的變化。
實驗證實在四種HK的同工酶中,HKⅡ與腫瘤相關性最大。Sebastian和Kenkare通過RT-PCR的方式發現很多腫瘤細胞系中都有HKⅡRNA的誘發和過表達,HKⅠRNA也有不同程度增加。至於HKⅣmRNA,只在肝和胰腺腫瘤中有發現,且親和力低。
HKⅡ對於快速生長的腫瘤的代謝行為來說是至關重要的。HKⅡ表達的增多,從基因水平上而言,首先是其基因轉錄的增多。HKⅡ的啟動子有廣泛的信號轉導級聯激活途徑。鼠肝癌細胞系AS-30D中HKⅡ啟動子可以被胰島素,乏氧環境及佛波酯所激活,這說明腫瘤中HKⅡ啟動子的信號轉導級聯途徑是比較複雜的。HKⅡ的啟動子也可由突變型的p53反式激活。p53亦可以通過突變而減弱對細胞周期的控制,因此而進一步促進HK基因的轉錄。HKⅡ的基因啟動子附近的一個狹小區域中富含各種反應元件,它們可以分別和Sp1、Sp2、Sp3、CREB及NFY等蛋白結合,使啟動子活化。這段序列對於腫瘤中HKⅡ的過表達有著重要的意義。另有一些實驗表明缺氧誘導因子1α(HIF1 alpha)與HKⅡ的水平是密切相關的。
有關腫瘤中己糖激酶的特點和機制,前人已經做了大量的工作,但其詳細的分子生物學機制及潛在的臨床套用價值仍需進一步的探索。儘管如此,現有的資料已充分表明,它為腫瘤的治療提供了契機,很可能成為當今腫瘤研究的一個新熱點。
- HK2研究進展
腫瘤特徵性的糖代謝,使得這些糖代謝的酶類,就像腫瘤中其他的生物行為的調節因子一樣,引起了人們的關注。從理論上而言,一定程度地抑制或影響這類調節因子,可以影響腫瘤的能量代謝,而正常細胞不受影響。因此,針對HK2的治療可能為治療高葡萄糖代謝腫瘤(PET陽性)提供一個新的策略。
目前的研究主要集中在幾個方面:直接抑制HK2的合成.這可以通過RNA干擾技術來沉寂基因表達實現;小分子藥物包括Lonidamine可以直接抑制HK的活性.Bifonazol及Clotrimazole通過干擾HK與線粒體的結合起作用。在動物實驗中,3-bromopyruvic acid可以通過抑制糖酵解及線粒體能量代謝從而高效地抑制進展期的惡性腫瘤而沒有任何不良反應,並且可以消滅進展期的惡性腫瘤而沒有任何復發。HK是唯一的1種和線粒體結合的酵解酶.鋰可以使HK從線粒體上分離出來,從而抑制B16黑色素瘤細胞的增生.亦為藥物治療提供了新的方向。HK在腫瘤診斷及治療中的研究方興未艾,已經成為當今腫瘤研究的一個新熱點.但具體套用價值需要進一步研究。