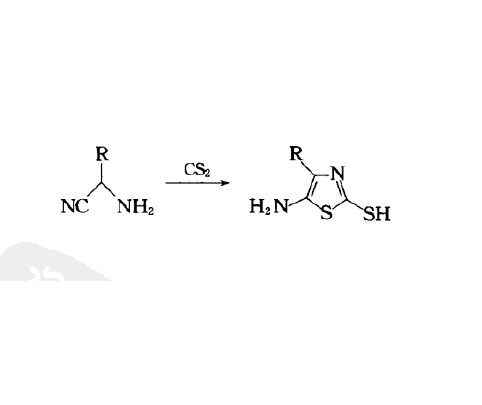
α-氨基腈與二硫化碳或氧硫化碳,或硫氰酸酯與二硫化碳合成5-氨基噻唑。該反應涉及加成反應,閉環等,是一種合成噻唑及衍生物等的經典有機合成方法。
基本介紹
- 中文名:Cook-Heilbron噻唑合成
- 重要底物:二硫化碳或氧硫化碳
- 反應過程:加成,閉環等
- 經典產物:5-氨基噻唑
- 合成意義:噻唑及衍生物
- 領域:有機合成
反應機理,反應舉例,噻唑,理化特性,合成,主要用途,
反應機理
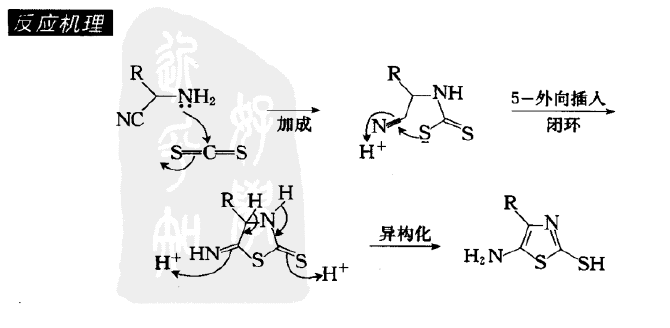 反應機理
反應機理反應舉例
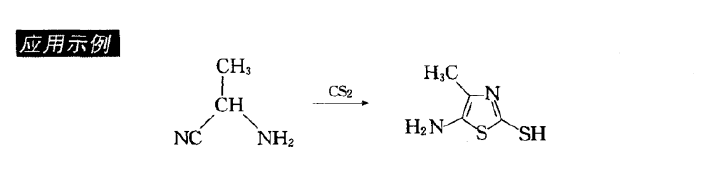 反應舉例
反應舉例噻唑
理化特性
沸點(℃): 116.8~118℃
相對密度(水=1): 1.20
閃點(℃): 26 ℃
折射率:1.5969
溶解性: 微溶於水,溶於乙醇、乙醚等。
健康危害: 吸入、攝入或經皮膚吸收後對身體有害,對眼睛和皮膚有刺激作用。
燃爆危險: 本品易燃,有毒,具刺激性。
危險特性: 易燃,遇明火、高熱或與氧化劑接觸,有引起燃燒爆炸的危險。
噻唑含有一個硫和一個氮雜原子的五元雜環化合物,分子式C3H3NS。唑字由外文字尾azole譯音而來,意為含氮的五元雜環,除吡咯外都稱為某唑。硫和氮占1,3兩位的稱為噻唑;硫和氮占1,2兩位的,稱為異噻唑。噻唑和異噻唑在自然界不存在。
噻唑為淡黃色具有腐敗臭味的液體,沸點 116.8℃,相對密度1.998(17/4℃)。噻唑與吡啶類似,具有弱鹼性;可與苦味酸和鹽酸等形成鹽,與許多金屬氯化物(如氯化金等)形成絡合物,並具有一定的熔點。噻唑的環系具有一定的穩定性,也表現出一定的芳香性。它與吡啶在化學性質上相似,例如,2位上的氫具有活性;也可以與氨基鈉作用,生成2-氨基噻唑;其氨基也可重氮化(見重氮化反應)。噻唑一般不能還原為二氫和四氫化合物。
合成
傳統的噻唑合成方法主要是採用多步合成法,通過官能團之間的轉化實現合成;後來,隨著綠色化學的發展,科研工作者們開始採用一步法合成噻唑類化合物。代表性的例子有銅鹽催化的氧化反應以及二氧化錳作為催化劑和氧化劑的氧化反應。該類方法雖然能夠較好地合成噻唑類化合物,但是需要使用金屬催化劑。
如果藥物合成中採用金屬催化劑,往往難以避免金屬在藥物中的殘留,因此需要採用較複雜的後續步驟來除去金屬藥物殘留。因此,發展一種無金屬催化的合成方法學,通過一步反應構建噻唑類化合物具有較重要的研究意義。
噻唑及其衍生物可通過多種方法合成,常用α-鹵代醛或酮與硫代醯胺反應製備:噻唑的多種衍生物是重要的藥物或生理活性的物質。青黴素分子中含有一個四氫噻唑的環系。維生素B1分子中的噻唑部分是一個四級銨鹽的衍生物。現用的許多硫化加速劑,如2-乙醯基噻唑是噻唑衍生物。重要的抑菌劑磺胺噻唑是 2- 氨基噻唑與對乙醯胺基苯磺醯氯縮合(見縮合反應)後,再經水解反應得到的產物。許多噻唑衍生物是合成胺基酸、嘌呤等的試劑。