理化性質
物理性質
無色透明斜方晶系片狀晶體,易溶於水和
氨水,溶於
乙醚和
甘油,微溶於
無水乙醇,幾乎不溶於濃
硝酸。其
水溶液呈弱酸性。硝酸銀溶液由於含有大量銀離子,故氧化性較強,並有一定腐蝕性,醫學上用於腐蝕增生的肉芽組織,稀溶液用於眼部感染的殺菌劑。熔化後為淺黃色液體,固化後仍為白色。
 硝酸銀
硝酸銀化學性質
硝酸銀遇有機物變灰黑色,分解出銀。純硝酸銀對光穩定,但由於一般的產品純度不夠,其水溶液和固體常被保存在棕色試劑瓶中。硝酸銀加熱至440℃時分解成銀、氮氣、氧氣和
二氧化氮。水溶液和乙醇溶液對
石蕊呈中性反應,pH約為6。沸點 444℃(分解)。有氧化性。在有機物存在下,見光變灰色或灰黑色。硝酸銀能與一系列試劑發生沉澱反應或配位反應(見
配位化合物)。例如,與
硫化氫反應,形成黑色的
硫化銀Ag
2S沉澱;與
鉻酸鉀反應,形成紅棕色的
鉻酸銀Ag
2CrO
4沉澱;與
磷酸氫二鈉反應,形成黃色
磷酸銀Ag
3PO
4沉澱;與鹵素離子反應,形成鹵化銀AgX沉澱。還能與鹼作用,形成棕黑色
氧化銀Ag
2O沉澱;與草酸根離子作用形成白色
草酸銀Ag
2C
2O
4沉澱等。硝酸銀能與NH
3、CN
-、SCN
-等反應,形成各種配位分子。
1.複分解反應
AgNO
3+HCl=AgCl↓+HNO
3(可用於檢驗物質中是否含有
氯離子)
Cl
2+H
2O=HCl+HClO HCl+AgNO
3=AgCl↓+HNO
3(檢驗自來水中含有氯離子)
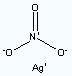 硝酸銀結構式
硝酸銀結構式2AgNO3+2NH3+H2O=Ag2O↓+2NH4NO3
2NaOH+2AgNO3=2NaNO3+Ag2O↓+H2O
NaCl+AgNO3=AgCl↓+NaNO3
2AgNO3+2NH3·H2O=Ag2O↓+H2O+2NH4NO3(少量氨水)
AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O(過量氨水)
HBr+AgNO3=AgBr↓+HNO3(檢驗溴離子)
2.氧化還原反應
硝酸銀是一個中強氧化劑,它可被許多中強或強還原劑還原成單質銀。例如,肼N
2H
4和
亞磷酸等都可以將AgNO
3還原成金屬銀:
N2H4+4AgNO3─→4Ag+N2+4HNO3
H3PO3+2AgNO3+H2O─→2Ag+H3PO4+2HNO3
2AgNO3+Cu=Cu(NO3)2+2Ag(比銀活動性強的金屬可以置換硝酸銀溶液中的銀離子)
(2)分解反應
2AgNO3=△=2Ag+2NO2↑+O2↑
作用用途
分析化學用於沉澱氯離子,工作基準的硝酸銀用於標定氯化鈉溶液。無機工業用於製造其他
銀鹽。電子工業用於製造導電
粘合劑、新型氣體淨化劑、A8x
分子篩、
鍍銀均壓服和帶電作業的手套等。感光工業用於製造
電影膠片、x光照相底片和照相膠片等的
感光材料。
電鍍工業用於
電子元件和其他工藝品的鍍銀,也大量用作鏡子和保溫瓶膽的鍍銀材料。電池工業用於生產銀鋅電池。醫藥上用作殺菌劑、
腐蝕劑。日化工業用於染毛髮等。分析化學中用於測定氯、
溴、碘氰化物和
硫氰酸鹽。
用於無氰鍍銀,如硫代硫酸鍍銀,鹽酸鍍銀,亞氨基二磺酸銨鍍銀,磺基水楊酸鍍銀等做主鹽。是銀離子來源。硝酸銀含量對鍍銀液的導電性、分散性和沉澱速度都有一定的影響。一般用量為25-50g/L。
硝酸銀的氨水溶液能被有機還原劑
醛、糖還原。因此它是檢定醛、糖的試劑。還用於測定氯離子、測定錳的催化劑、
電鍍、攝影、瓷器著色。
危險說明
硝酸銀屬於
強氧化劑、腐蝕品、環境污染物。與部分有機物或硫、磷混合研磨、撞擊可燃燒或爆炸;硝酸銀具有腐蝕性。一旦皮膚沾上硝酸銀溶液,就會出現黑色斑點,這是由於生成了黑色的蛋白銀。硝酸銀有毒,LD
50約50mg/kg,致死量約10克。
 危險品標識
危險品標識圖右為硝酸銀的危險說明圖片:
使用注意事項
毒性
硝酸銀有一定毒性,進入體內對胃腸產生嚴重腐蝕,成年人致死量約10克左右。半數致死量(小鼠,經口)50mg/kg。
誤服硝酸銀可引起劇烈腹痛、嘔吐、血便,甚至發生胃腸道穿孔。可造成皮膚和眼灼傷。長期接觸該品的工人會出現全身性銀質沉著症。表現包括:全身皮膚廣泛的色素沉著,呈灰藍黑色或淺石板色;眼部銀質沉著造成眼損害;呼吸道銀質沉著造成慢性支氣管炎等。
操作注意事項
密閉操作,加強通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴頭罩型電動送風過濾式防塵呼吸器,穿膠布防毒衣,戴氯丁橡膠手套,切忌將其滴在皮膚上。遠離火種、熱源,工作場所嚴禁吸菸。遠離易燃、可燃物。避免產生粉塵。避免與還原劑、鹼類、醇類接觸。搬運時要輕裝輕卸,防止包裝及容器損壞。配備相應品種和數量的消防器材及泄漏應急處理設備。倒空的容器可能殘留有害物。
燃爆危險: 本品助燃,有毒。
皮膚接觸: 脫去污染的衣著,用肥皂水和清水徹底沖洗皮膚。
眼睛接觸: 提起眼瞼,用流動清水或生理鹽水沖洗,並及時就醫。
吸入: 迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入: 用水漱口,給飲牛奶或蛋清, 並及時就醫。
危險特性: 無機氧化劑。遇可燃物著火時,能助長火勢。受高熱分解,產生有毒的氮氧化物。
滅火方法: 採用水、霧狀水、砂土、二氧化碳滅火。
儲存注意事項
儲存於陰涼、通風的庫房;實驗室應儲存於棕色玻璃瓶里。遠離火種、熱源。避免光照。庫溫不超過30℃,相對濕度不超過80%。包裝必須密封,切勿受潮。應與易(可)燃物、還原劑、鹼類、醇類、食用化學品分開存放,切忌混儲。儲區應備有合適的材料收容泄漏物。
化學反應
若遇到
氯離子,溴離子,碘離子等會發生反應生成不溶於水,不溶於
硝酸的
氯化銀(白色沉澱),
溴化銀(淡黃色沉澱),
碘化銀(黃色沉澱)等。因此常被用於檢驗氯離子的存在;
Ag+(aq) + Cl-(aq) → AgCl(s)
氯化銀受光照射生成灰色溶液。 氯化銀可與氨水反應再度溶解,生成無色的二氨銀(I)溶液:
AgCl +2NH3 → Ag(NH3)2++ Cl-
 硝酸銀
硝酸銀 硝酸銀結構式
硝酸銀結構式 銅片與硝酸銀溶液反應
銅片與硝酸銀溶液反應 危險品標識
危險品標識
