鹽酸格拉司瓊葡萄糖注射液,適應症為用於放療、細胞毒類藥物化療引起的噁心和嘔吐的預防與治療。
基本介紹
- 藥品名稱:鹽酸格拉司瓊葡萄糖注射液
- 藥品類型:處方藥、醫保工傷用藥
- 用途分類:5-HT3受體阻斷藥
成份
化學結構式:
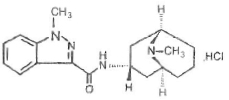
分子式:C18H24N4O·HCl
分子量:348.87
性狀
適應症
規格
用法用量
預防:臨床試驗證明,大部分患者一次使用本品3mg,可在24小時內預防噁心和嘔吐的發生。24小時內最多允許2次追加給藥,每次3mg,即每日最大用量應不超過9mg(3瓶)。與地塞米松合用,可以提高本品的療效。
不良反應
禁忌
2、對本品過敏者。
注意事項
2、由於本品可減緩消化道運動,故消化道運動障礙患者使用本品時應嚴密觀察。
孕婦及哺乳期婦女用藥
兒童用藥
老年用藥
藥物相互作用
對已麻醉患者雖未進行特殊的藥物相互作用的研究,但常規劑量下本品與麻醉劑或止痛劑合用是安全的。此外,對體外人微粒體研究表明本品對細胞色素P450的亞型3A4(參與一些主要的麻醉止痛藥物的代謝)的作用沒有影響。
藥物過量
藥理毒理
本品是一種高選擇性的5-HT3受體拮抗劑,對因放療、化療及手術引起的噁心和嘔吐具有良好的預防和治療作用。放療、化療及外科手術等因素可引起腸嗜鉻細胞釋放5-HT3,5-HT3可激活中樞或迷走神經的5-HT3受體而引起嘔吐反射。本品控制噁心和嘔吐的機理,是通過拮抗中樞化學感受區及外周迷走神經末梢的5-HT3受體,抑制噁心、嘔吐的發生。本品選擇性高,無錐體外系反應、過度鎮靜等副作用。
毒理研究
生殖毒性:本品皮下給藥劑量達6mg/kg/天(以體表面積計算,為臨床靜脈給藥推薦劑量的97倍)時,未表現出對雌、雄大鼠生育力和生殖行為的影響。妊娠的大鼠和家兔靜脈給予本品劑量分別為9mg/kg/天,(54mg/m2/天,按體表面積算,相當於臨床靜脈給藥推薦劑量的146倍)及3mg/kg/天,(35.4mg/m2/天,按體表面積算,相當於臨床靜脈給藥推薦劑量的96倍)的生殖毒性研究中,均未表現出對動物生育力和胎仔發育的影響。但尚無充分和嚴格對照的本品妊娠婦女給藥的臨床研究。因為動物試驗並不總能預防藥品對人體的影響,故只有在確實必需時,才可以在妊娠期間服用本品。
目前尚不清楚本品是否通過乳汁分泌。因為許多藥物可以經乳汁分泌,故哺乳婦女服用本品時應慎重考慮其對後代的影響。
遺傳毒性:本品Ames試驗、小鼠淋巴瘤細胞正向突變試驗、小鼠微核試驗及體內、外大鼠肝細胞UDS試驗結果均未表現出致突變作用。但在HeLa細胞體外試驗中出現UDS明顯增加,體外人淋巴細胞染色體畸變試驗中,多倍體細胞的數量明顯增加。
致癌性:在給藥兩年的致癌性試驗中,大鼠經口給予本品的劑量分別為1、5、50mg/kg/天( 6、30、300mg/m2/天),其中高劑量組在第59周時因毒性反應而將劑量降至25mg/kg/天。結果顯示,5mg/kg/天以上組(包括該劑量組)雄性大鼠和25mg/kg/天組雌性大鼠(以體表面積計算,其劑量分別相當於臨床靜脈給藥推薦劑量的81倍以上和405 倍)的肝細胞癌和腺瘤的發生率顯著增加,而1mg/kg/天組雄性大鼠和5mg/kg/天組雌性大鼠(以體表面積計算,分別為臨床靜脈給藥推薦劑量的16倍以上和81 倍)的肝腫瘤發生率未見增加。在12個月的試驗中,經口給予本品100mg/kg/天組(600mg/m2/天,以體表面積計算,相當於臨床靜脈給藥推薦劑量的1622倍)的雌、雄大鼠均發生肝細胞腺瘤,而空白對照組未出現。本品給藥24個月的小鼠致癌性試驗結果顯示,腫瘤的發生率未見有統計學意義的明顯增加,但該試驗尚未得出最後結論。因為在大鼠致癌性研究中出現腫瘤,故本品只應在說明書中推薦的劑量下和適應症範圍內套用。
藥代動力學
本品在體內分布廣泛,血清蛋白結合率約為65%,大部分迅速代謝,主要代謝途徑為N-去烷基化及芳香環氧化後再被共軛化,本品通過糞便和尿液排泄。
