鹽酸帕洛諾司瓊注射液,預防化療引起的急性噁心、嘔吐。
基本介紹
- 外文名稱:Palonosetron Hydrochloride Injection
- 藥品名稱:鹽酸帕洛諾司瓊注射液
- 藥品類型:處方藥
- 用途分類:5-HT3受體阻斷藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,
成份
主要成份:鹽酸帕洛諾司瓊
化學名稱:(3aS)2-[(3S)-1-氮雜雙環(2.2.2)辛烷基]-2,3,3aS,4,5,6-六氫-1H-苯肼[de]異喹啉酮鹽酸鹽。
結構式:
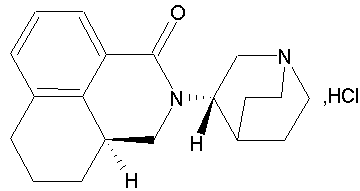
分子式:C19H24N2O·HCl
分子量:332.87
本品為鹽酸帕洛諾司瓊的滅菌水溶液,含有鹽酸帕洛諾司瓊、氯化鈉、枸櫞酸、枸櫞酸鈉、依地酸鈣鈉、甘露醇。
性狀
本品為無色的澄明液體。
適應症
預防中、重度致吐化療引起的急性噁心、嘔吐。
規格
5ml:0.25mg( 以帕洛諾司瓊計)
用法用量
推薦劑量為:化療前約30分鐘,單劑量靜脈注射帕洛諾司瓊0.25mg,注射時間為30秒以上。
不良反應
主要為頭痛、便秘、腹瀉、頭暈、疲勞、腹痛、失眠。少見不良反應詳見藥物說明書。
據國外臨床研究報導:1374名成年患者參加了帕洛諾司瓊預防由中度或重度致吐化療引起的噁心、嘔吐的臨床研究。結果表明,帕洛諾司瓊引起不良反應的發生率及嚴重程度與昂丹司瓊或多拉司瓊相似。發生率≥2%的臨床不良反應列表如下:

在其它臨床研究中,單劑量用帕洛諾司瓊0.75mg時(推薦劑量的三倍),兩名患者產生嚴重的便秘:一例為在抑制術後噁心、嘔吐研究中,患者口服10μg/kg帕洛諾司瓊;另一例為一名健康志願者在藥代動力學研究中,靜脈注射0.75mg帕洛諾司瓊。
臨床研究過程中,化療的成年患者給予帕洛諾司瓊治療時出現一些發生率較低的不良反應,被認為是治療相關性的或因果關係不明的,這些不良反應包括:
心血管系統:
發生率1%:間歇性的心動過速、心動過緩、低血壓;發生率<1%:高血壓、心肌缺血、期外收縮、竇性心動過速、竇性心律失常、室上性期外收縮、QT間期延長。多數病例與帕洛諾司瓊的關係不明確。
皮膚:
發生率<1%:過敏性皮炎、出疹。
視力和聽力:
發生率<1%:運動病、耳鳴、眼刺激和弱視。
胃腸系統:
發生率1%:腹瀉;發生率<1%:消化不良、腹痛、口乾、呃逆和(胃腸)脹氣。
全身:
發生率1%:體弱;發生率<1%:疲勞、發熱、潮熱和流感樣症狀。
肝臟:
發生率<1%:一過性、無症狀的AST和/或ALT、膽紅素升高。主要發生於高催吐化療的患者。
代謝:
發生率1%:高鉀血症;發生率<1%:電解質紊亂、高血糖、代謝性酸中毒、尿糖、食慾減退和厭食。
骨骼肌肉系統:
發生率<1%:關節痛。
神經系統:
發生率1%:頭暈;發生率<1%:睏倦,失眠,情緒亢進,感覺異常。
精神系統:
發生率1%:焦慮;發生率<1%:欣快感。
泌尿系統:
發生率<1%:尿瀦留。
血管系統:
發生率<1%:靜脈變色、靜脈擴張。
禁忌
禁用於已知對該藥物或藥物中任何組份過敏的患者。
注意事項
過敏反應可能發生於對其它選擇性5-HT3受體拮抗劑過敏者。
在國外臨床試驗所研究的劑量水平下,帕洛諾司瓊未觀察到引起有臨床意義的QTc間期延長。在221例健康成年男性和女性志願者中進行的一項雙盲、隨機、平行、安慰劑對照和陽性對照(莫西沙星)的完整的QT/QTc的研究中,評估了帕洛諾司瓊對QTc間期的影響。結果顯示在0.25、0.75、2.25mg劑量下均未觀察到對QTc間期以及其他ECG的影響,也未觀察到對心率、房室傳導和心臟復極化有臨床意義的改變。但是基於其他5-HT3受體拮抗劑使用信息,對於伴隨使用延長QT間期藥物,以及有或可能發展為QR間期延長的病人,應謹慎使用帕洛諾司瓊。這些患者包括:低鉀血症或低鎂血症者、服用利尿藥使用信息而導致電解質異常者、先天性長QT綜合徵患者、服用抗心律失常藥物或其他藥物可導致QT間期延長的患者,和給予累計高劑量蒽環類藥物治療者。
鹽酸帕洛諾司瓊注射液不能與其他藥物混合,故使用帕洛諾司瓊注射液前、後均需套用生理鹽水沖洗輸注管路。
在國外臨床試驗所研究的劑量水平下,帕洛諾司瓊未觀察到引起有臨床意義的QTc間期延長。在221例健康成年男性和女性志願者中進行的一項雙盲、隨機、平行、安慰劑對照和陽性對照(莫西沙星)的完整的QT/QTc的研究中,評估了帕洛諾司瓊對QTc間期的影響。結果顯示在0.25、0.75、2.25mg劑量下均未觀察到對QTc間期以及其他ECG的影響,也未觀察到對心率、房室傳導和心臟復極化有臨床意義的改變。但是基於其他5-HT3受體拮抗劑使用信息,對於伴隨使用延長QT間期藥物,以及有或可能發展為QR間期延長的病人,應謹慎使用帕洛諾司瓊。這些患者包括:低鉀血症或低鎂血症者、服用利尿藥使用信息而導致電解質異常者、先天性長QT綜合徵患者、服用抗心律失常藥物或其他藥物可導致QT間期延長的患者,和給予累計高劑量蒽環類藥物治療者。
鹽酸帕洛諾司瓊注射液不能與其他藥物混合,故使用帕洛諾司瓊注射液前、後均需套用生理鹽水沖洗輸注管路。
孕婦及哺乳期婦女用藥
尚未在妊娠婦女中進行充分的隨機對照臨床試驗,也沒有妊娠期或分娩期婦女使用過帕洛諾司瓊,因此對其對母親及胎兒的影響並不清楚,故懷孕期間應慎用本品。
帕洛諾司瓊是否通過乳汁分泌尚不明確。鑒於多數藥物經人體乳汁排泄,對乳兒有潛在的嚴重不良反應,且在大鼠致癌作用研究發現有潛在致癌作用。因此,應充分考慮使用藥物的必要性之後,來決定是否停止哺乳或停止用藥。
帕洛諾司瓊是否通過乳汁分泌尚不明確。鑒於多數藥物經人體乳汁排泄,對乳兒有潛在的嚴重不良反應,且在大鼠致癌作用研究發現有潛在致癌作用。因此,應充分考慮使用藥物的必要性之後,來決定是否停止哺乳或停止用藥。
兒童用藥
18歲以下的患者用本品的安全性和有效性尚未經研究確定。
老年用藥
據文獻報導:帕洛諾司瓊在1374名成年癌症患者的臨床研究中,其中,316(23%)例≥65歲,71例(5%)≥75歲。除某些老年個體較為敏感以外,帕洛諾司瓊用於老年患者與年輕患者在安全性和有效性方面無差別。因此,老年患者用帕洛諾司瓊無需調整劑量和特殊監護。
藥物相互作用
帕洛諾司瓊的體內消除途徑包括經腎分泌及多種CYP酶參與的。體外進一步研究表明,帕洛諾司瓊既不是CYP1A2、CYP2A6、CYP2B6、CYP2C9、CYP2D6、CYP2E1和CYP3A4/5(CYP2C19未研究)的抑制劑,也不誘導CYP1A2、CYP2D6或CYP3A4/5的活性。因此,與帕洛諾司瓊產生明顯的臨床藥物相互作用的可能性很低。
健康志願者同時靜脈注射0.25mg帕洛諾司瓊和20mg地塞米松後,沒有出現兩種藥物間藥代動力學上的相互作用。另一項在健康志願者上進行的藥物相互作用的臨床試驗表明,第一日靜脈注射0.25mg帕洛諾司瓊,同時連續三天口服(125mg/80mg/80mg)阿瑞匹坦,對帕洛諾司瓊藥代動力學沒有顯著改變(AUC:沒有改變,Cmax:升高15%)
健康志願者單劑量靜脈給予0.75mg的帕洛諾司瓊,穩定期口服胃復安(每天四次,每次10mg)的研究中未發現明顯的藥代動力學影響。
臨床研究表明,帕洛諾司瓊能安全地與皮質類固醇類、鎮痛藥、止吐藥、解痙藥和抗膽鹼能藥物一起使用。
鼠腫瘤模型研究表明,帕洛諾司瓊不會抑制所研究的五種化療藥物(順鉑、環磷醯胺、阿糖胞苷、阿黴素和絲裂黴素C)的抗癌活性。
健康志願者單劑量靜脈給予0.75mg的帕洛諾司瓊,穩定期口服胃復安(每天四次,每次10mg)的研究中未發現明顯的藥代動力學影響。
臨床研究表明,帕洛諾司瓊能安全地與皮質類固醇類、鎮痛藥、止吐藥、解痙藥和抗膽鹼能藥物一起使用。
鼠腫瘤模型研究表明,帕洛諾司瓊不會抑制所研究的五種化療藥物(順鉑、環磷醯胺、阿糖胞苷、阿黴素和絲裂黴素C)的抗癌活性。
藥物過量
尚無已知的帕洛諾司瓊的解毒劑,因此藥物過量時應該用支持療法。在帕洛諾司瓊劑量探索研究中,50名成人癌症患者給予90μg/kg的劑量(相當於6mg的固定劑量),接近推薦劑量0.25mg的25倍。該劑量組產生的不良反應事件與其它劑量組相似,未見劑量依賴性。儘管未進行過透析治療的研究,但是由於帕洛諾司瓊具有較大的分布容積,故透析不可能作為有效的治療藥物過量手段。大鼠和小鼠單劑量靜脈給予帕洛諾司瓊的致死量為30mg/kg(按體表面積換算,大鼠和小鼠的劑量分別相當於人體推薦劑量的947和474倍),主要中毒症狀為驚厥、喘息、膚色蒼白、發紺、虛脫。
臨床試驗
以下數據主要來自於國外研究文獻
在三項III期臨床研究和一個II期臨床研究中,分別評價了帕洛諾司瓊單劑量注射劑預防中度和重度致吐化療導致的急性和延遲性噁心嘔吐的治療效果;在這些雙盲臨床研究中,評價化療後至少120h的完全緩解率(無嘔吐發作和不需藥物治療)和其它療效參數;以及進行重複化療中帕洛諾司瓊的安全性和有效性評價。
中度致吐化療
兩個III期雙盲臨床試驗,臨床研究病例數為1132,在中度致吐化療之前30分鐘,給予單劑量靜脈注射帕洛諾司瓊和單劑量靜脈注射昂丹司瓊(研究1)或多拉司瓊(研究2)。其所用化療藥物包括:卡鉑、順鉑≤50mg/m2,環磷醯胺<1500mg/m2,阿黴素>25mg/m2、表阿黴素、伊立替康、甲氨蝶呤>250mg/m2。研究1中不給予預防性的皮質類固醇。研究2中只有4-6%的病人給予皮質類固醇。該研究中77%的患者為女性,65%為白人,54%為初次化療者。其平均年齡為55歲。
重度致吐化療
II期雙盲臨床試研究中,161例初次化療患者接受高度致吐化療(順鉑≥70mg/m2或環磷醯胺>1100mg/m2)。對其單劑量靜脈注射帕洛諾司瓊0.3-90μg/kg(與<0.1mg-6mg的固定劑量相當)的療效進行了評價。未預防性給予皮質類固醇藥物。試驗數據分析顯示,0.25mg帕洛諾司瓊為抑制重度致吐化療引起的急性噁心嘔吐的最低有效劑量。
在包括667名患者的III期雙盲臨床試驗中,比較了重度致吐化療(順鉑≥60mg/m2、環磷醯胺>1500mg/m2、達卡巴嗪)前30分鐘單次靜脈給予帕洛諾司瓊和昂丹司瓊(研究3)的療效,67%的患者化療前聯合套用皮質類固醇類藥物,51%的病人為女性,60%為白人,初次化療者占59%,平均年齡為52歲。
臨床結果
III期臨床中,帕洛諾司瓊預防急性期(0-24hr)嘔吐的評價結果見表2,預防延遲期(24-120hr)嘔吐的評價結果見表3,總體(0-120hr)預防嘔吐評價結果見表4。
在三項III期臨床研究和一個II期臨床研究中,分別評價了帕洛諾司瓊單劑量注射劑預防中度和重度致吐化療導致的急性和延遲性噁心嘔吐的治療效果;在這些雙盲臨床研究中,評價化療後至少120h的完全緩解率(無嘔吐發作和不需藥物治療)和其它療效參數;以及進行重複化療中帕洛諾司瓊的安全性和有效性評價。
中度致吐化療
兩個III期雙盲臨床試驗,臨床研究病例數為1132,在中度致吐化療之前30分鐘,給予單劑量靜脈注射帕洛諾司瓊和單劑量靜脈注射昂丹司瓊(研究1)或多拉司瓊(研究2)。其所用化療藥物包括:卡鉑、順鉑≤50mg/m2,環磷醯胺<1500mg/m2,阿黴素>25mg/m2、表阿黴素、伊立替康、甲氨蝶呤>250mg/m2。研究1中不給予預防性的皮質類固醇。研究2中只有4-6%的病人給予皮質類固醇。該研究中77%的患者為女性,65%為白人,54%為初次化療者。其平均年齡為55歲。
重度致吐化療
II期雙盲臨床試研究中,161例初次化療患者接受高度致吐化療(順鉑≥70mg/m2或環磷醯胺>1100mg/m2)。對其單劑量靜脈注射帕洛諾司瓊0.3-90μg/kg(與<0.1mg-6mg的固定劑量相當)的療效進行了評價。未預防性給予皮質類固醇藥物。試驗數據分析顯示,0.25mg帕洛諾司瓊為抑制重度致吐化療引起的急性噁心嘔吐的最低有效劑量。
在包括667名患者的III期雙盲臨床試驗中,比較了重度致吐化療(順鉑≥60mg/m2、環磷醯胺>1500mg/m2、達卡巴嗪)前30分鐘單次靜脈給予帕洛諾司瓊和昂丹司瓊(研究3)的療效,67%的患者化療前聯合套用皮質類固醇類藥物,51%的病人為女性,60%為白人,初次化療者占59%,平均年齡為52歲。
臨床結果
III期臨床中,帕洛諾司瓊預防急性期(0-24hr)嘔吐的評價結果見表2,預防延遲期(24-120hr)嘔吐的評價結果見表3,總體(0-120hr)預防嘔吐評價結果見表4。

藥理毒理
藥理作用
帕洛諾司瓊為親和力較強的5-HT3受體選擇性拮抗劑,對其它受體無親和力或親和力較低。5-HT3受體位於延髓最後區的催吐化療感受區中央和周圍的迷走神經末梢。化療藥物通過刺激小腸嗜鉻細胞釋放5-HT,5-HT再激活迷走傳入神經的5-HT3受體,產生嘔吐反射。
毒理研究
致癌性
CD-1小鼠的104周的致癌性研究中,動物經口給予10、30和60mg/kg/d的帕洛諾司瓊治療,結果顯示,帕洛諾司瓊無致癌性。最高試驗劑量產生的帕洛諾司瓊的系統暴露量(血漿AUC)為人類推薦靜脈給予0.25mg帕洛諾司瓊後暴露量(AUC=29.8ng/h/ml)的150-289倍。在SD大鼠104周的致癌性研究中,雄性大鼠和雌性大鼠分別經口給予15、30、和60 mg/kg/d和15、45、90 mg/kg/d的帕洛諾司瓊,最高給藥劑量產生的帕洛諾司瓊系統暴露量(血漿AUC)為人類推薦給藥劑量暴露量的137-308倍。使用帕洛諾司瓊導致雄性大鼠中良性腎上腺嗜鉻細胞瘤和良惡性混合的嗜鉻細胞瘤發病率上升,胰腺胰島細胞腺瘤、混合性腺瘤和肉瘤以及垂體瘤的發病率上升,而在雌性大鼠中,則會導致肝細胞腺瘤和肉瘤的發生,甲狀腺C-細胞腺瘤、混合性腺瘤以及肉瘤的發病率上升。
致突變性
細菌Ames試驗、中國倉鼠卵巢細胞致突變試驗、體外肝細胞無序DNA合成(UDS)試驗或小鼠的微核試驗表明,帕洛諾司瓊無致突變毒性。但是,帕洛諾司瓊對中國倉鼠卵巢細胞染色體有畸變作用。
生殖毒性
大鼠口服給藥劑量為60mg/kg(根據體表面積計算,約為人推薦靜脈注射劑量的1894倍)時,對雌雄大鼠的生育力和生殖力均無影響。
帕洛諾司瓊為親和力較強的5-HT3受體選擇性拮抗劑,對其它受體無親和力或親和力較低。5-HT3受體位於延髓最後區的催吐化療感受區中央和周圍的迷走神經末梢。化療藥物通過刺激小腸嗜鉻細胞釋放5-HT,5-HT再激活迷走傳入神經的5-HT3受體,產生嘔吐反射。
毒理研究
致癌性
CD-1小鼠的104周的致癌性研究中,動物經口給予10、30和60mg/kg/d的帕洛諾司瓊治療,結果顯示,帕洛諾司瓊無致癌性。最高試驗劑量產生的帕洛諾司瓊的系統暴露量(血漿AUC)為人類推薦靜脈給予0.25mg帕洛諾司瓊後暴露量(AUC=29.8ng/h/ml)的150-289倍。在SD大鼠104周的致癌性研究中,雄性大鼠和雌性大鼠分別經口給予15、30、和60 mg/kg/d和15、45、90 mg/kg/d的帕洛諾司瓊,最高給藥劑量產生的帕洛諾司瓊系統暴露量(血漿AUC)為人類推薦給藥劑量暴露量的137-308倍。使用帕洛諾司瓊導致雄性大鼠中良性腎上腺嗜鉻細胞瘤和良惡性混合的嗜鉻細胞瘤發病率上升,胰腺胰島細胞腺瘤、混合性腺瘤和肉瘤以及垂體瘤的發病率上升,而在雌性大鼠中,則會導致肝細胞腺瘤和肉瘤的發生,甲狀腺C-細胞腺瘤、混合性腺瘤以及肉瘤的發病率上升。
致突變性
細菌Ames試驗、中國倉鼠卵巢細胞致突變試驗、體外肝細胞無序DNA合成(UDS)試驗或小鼠的微核試驗表明,帕洛諾司瓊無致突變毒性。但是,帕洛諾司瓊對中國倉鼠卵巢細胞染色體有畸變作用。
生殖毒性
大鼠口服給藥劑量為60mg/kg(根據體表面積計算,約為人推薦靜脈注射劑量的1894倍)時,對雌雄大鼠的生育力和生殖力均無影響。
藥代動力學
以下來自國外研究文獻
健康志願者和癌症患者分別靜脈給予帕洛諾司瓊後,隨著藥物在體內緩慢消除,血藥濃度開始下降。無論是健康志願者還是癌症患者,平均最大血藥濃度(Cmax)和藥時曲線下面積(AUC0→∞),在0.3-90μg/kg的劑量範圍內均呈劑量相關性。六名癌症患者單劑量靜脈給予帕洛諾司瓊3μg/kg(或0.21mg/70kg),其最大血藥濃度為5.6±5.5ng/ml,平均AUC為35.8±20.9ng/hr/ml。
11例癌症患者,靜脈給予帕洛諾司瓊0.25mg,隔天一次,連續3次,1d~5d平均血藥濃度升高了42±34%。12例健康志願者,靜脈給予帕洛諾司瓊0.25mg,每天一次,連續3天,1d~3d平均血藥濃度升高了110±45%。
分布
帕洛諾司瓊的表觀分布容積為8.3±2.5L/kg,血漿蛋白結合率約為62%。
代謝
帕洛諾司瓊通過多種途徑代謝,約50%的主藥代謝為N-去氧帕洛諾司瓊和6-S-羥基帕洛諾司瓊,這兩種代謝產物各自拮抗5-HT3受體的活性不到帕洛諾司瓊的1%。體外代謝研究表明,以CYP2D6為主要代謝酶,其次CYP3A和CYP1A2也參與了帕洛諾司瓊的代謝。但是,CYP2D6的快代謝者和慢代謝者的臨床藥代動力學參數無明顯差別。
排泄
單劑量靜脈給予10μg/kg 14C標記的帕洛諾司瓊,144h後,出現在尿液中的放射標記物約占給藥劑量的80%,其中,帕洛諾司瓊約給藥劑量的40%為。健康志願者中全身清除率為160±35ml/h/kg,腎清除率為66.5±18.2ml/h/kg,平均終末消除半衰期為40h。
老年患者
群體藥代動力學分析及臨床安全性和有效性資料顯示,≥65歲的老年患者與年輕患者(18-64歲)之間無差異。因此,老年患者無需調整劑量。
不同種族
24名日本健康志願者進行了藥代動力學研究,靜脈給予3-90μg/kg劑量範圍的帕洛諾司瓊,其全身清除率比白種人高25%,但不需調整劑量。黑種人帕洛諾司瓊藥代動力學研究尚不充分。
腎損傷患者
輕至中度的腎損傷不會顯著影響帕洛諾司瓊的藥代動力學參數,重度腎損傷患者較健康志願者的系統暴露量增高約28%。因此,不同程度的腎損傷患者均無需調整劑量。
肝損傷患者
與健康志願者相比,肝臟損害對帕洛諾司瓊全身清除率無顯著影響,因此,不同程度的肝損傷患者均無需調整劑量。
健康志願者和癌症患者分別靜脈給予帕洛諾司瓊後,隨著藥物在體內緩慢消除,血藥濃度開始下降。無論是健康志願者還是癌症患者,平均最大血藥濃度(Cmax)和藥時曲線下面積(AUC0→∞),在0.3-90μg/kg的劑量範圍內均呈劑量相關性。六名癌症患者單劑量靜脈給予帕洛諾司瓊3μg/kg(或0.21mg/70kg),其最大血藥濃度為5.6±5.5ng/ml,平均AUC為35.8±20.9ng/hr/ml。
11例癌症患者,靜脈給予帕洛諾司瓊0.25mg,隔天一次,連續3次,1d~5d平均血藥濃度升高了42±34%。12例健康志願者,靜脈給予帕洛諾司瓊0.25mg,每天一次,連續3天,1d~3d平均血藥濃度升高了110±45%。
分布
帕洛諾司瓊的表觀分布容積為8.3±2.5L/kg,血漿蛋白結合率約為62%。
代謝
帕洛諾司瓊通過多種途徑代謝,約50%的主藥代謝為N-去氧帕洛諾司瓊和6-S-羥基帕洛諾司瓊,這兩種代謝產物各自拮抗5-HT3受體的活性不到帕洛諾司瓊的1%。體外代謝研究表明,以CYP2D6為主要代謝酶,其次CYP3A和CYP1A2也參與了帕洛諾司瓊的代謝。但是,CYP2D6的快代謝者和慢代謝者的臨床藥代動力學參數無明顯差別。
排泄
單劑量靜脈給予10μg/kg 14C標記的帕洛諾司瓊,144h後,出現在尿液中的放射標記物約占給藥劑量的80%,其中,帕洛諾司瓊約給藥劑量的40%為。健康志願者中全身清除率為160±35ml/h/kg,腎清除率為66.5±18.2ml/h/kg,平均終末消除半衰期為40h。
老年患者
群體藥代動力學分析及臨床安全性和有效性資料顯示,≥65歲的老年患者與年輕患者(18-64歲)之間無差異。因此,老年患者無需調整劑量。
不同種族
24名日本健康志願者進行了藥代動力學研究,靜脈給予3-90μg/kg劑量範圍的帕洛諾司瓊,其全身清除率比白種人高25%,但不需調整劑量。黑種人帕洛諾司瓊藥代動力學研究尚不充分。
腎損傷患者
輕至中度的腎損傷不會顯著影響帕洛諾司瓊的藥代動力學參數,重度腎損傷患者較健康志願者的系統暴露量增高約28%。因此,不同程度的腎損傷患者均無需調整劑量。
肝損傷患者
與健康志願者相比,肝臟損害對帕洛諾司瓊全身清除率無顯著影響,因此,不同程度的肝損傷患者均無需調整劑量。
貯藏
遮光,密閉,不超過30℃保存。
包裝
注射液0.25mg/5ml×1支,2支,5支
有效期
24個月
執行標準
YBH14262008
