鹽酸伊托必利膠囊,適應症為本品適用於功能性消化不良引起來的各種症狀,如:上腹部不適、餐後飽脹、早飽、食欲不振、噁心、嘔吐等。
基本介紹
- 藥品名稱:鹽酸伊托必利膠囊
- 藥品類型:處方藥、醫保工傷用藥
- 用途分類:胃腸促動藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,
成份
本品主要成分為鹽酸依託必利。
化學名稱:n-[4-[2-(二甲基氨基)乙氧基]芐基]-3-,4-二甲氧基苯甲醯胺鹽酸鹽。
化學式結構:
化學名稱:n-[4-[2-(二甲基氨基)乙氧基]芐基]-3-,4-二甲氧基苯甲醯胺鹽酸鹽。
化學式結構:
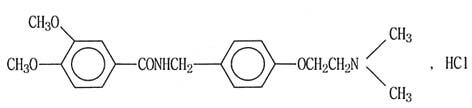
分子式:C20H26N2O4▪HCI
分子量:394.90
性狀
本品為膠囊劑,內容物為白色粉末。
適應症
本品適用於功能性消化不良引起來的各種症狀,如:上腹部不適、餐後飽脹、早飽、食欲不振、噁心、嘔吐等。
規格
50mg
用法用量
成人每次1粒(50mg),每日食3次,飯前20分鐘服用。或遵醫囑。
不良反應
消化系統:腹瀉、腹痛、便秘、唾液分泌增加。
神經精神系統:頭痛,睡眠障礙、眩暈等。
血液系統:白細胞減少(確認應停藥)。
過敏症狀:皮疹發熱,瘙癢等。偶出現血BUN、肌酐值升高。有AST、ALT、催乳素升高(在正常範圍內)的報導。也可見背疼痛、疲乏、手指發麻、手抖等。
神經精神系統:頭痛,睡眠障礙、眩暈等。
血液系統:白細胞減少(確認應停藥)。
過敏症狀:皮疹發熱,瘙癢等。偶出現血BUN、肌酐值升高。有AST、ALT、催乳素升高(在正常範圍內)的報導。也可見背疼痛、疲乏、手指發麻、手抖等。
禁忌
1.對本品成份過敏者禁用。
2.存在胃腸道出血、機械梗阻或穿孔時禁用。
2.存在胃腸道出血、機械梗阻或穿孔時禁用。
注意事項
1.本品可增強乙醯膽鹼的作用,故使用時應當注意。
2.使用本品效果不佳時,應避免長期無目的地使用。
3.嚴重肝、腎功能不全者慎用。
4.用藥中如果出現心電圖QTC間期延長者應停藥。
2.使用本品效果不佳時,應避免長期無目的地使用。
3.嚴重肝、腎功能不全者慎用。
4.用藥中如果出現心電圖QTC間期延長者應停藥。
孕婦及哺乳期婦女用藥
孕婦、哺乳期婦女避免使用。
兒童用藥
兒童應避免服用。
老年用藥
由於老年人的生理功能下降,常易發生不良反應,因此老年人在服用本品後需仔細觀察,一旦出現不良反應,需採取減量或停藥等措施。
藥物相互作用
由於替喹溴胺、丁溴東莨菪鹼、噻哌溴銨等抗膽鹼藥物可能使本品促進胃腸道運動的作用減弱,故本品應避免與上述藥物合用。
藥物過量
目前尚無過量服用鹽酸依託必利的報導。如藥物過量,應對症治療。
藥理毒理
藥理作用:
鹽酸伊托必利通過對多巴胺D2受體的拮抗作用而增加乙醯膽鹼的釋放,同時通過對乙醯膽鹼酶的抑制作用來抑制已釋放的乙醯膽鹼分解,從而增強胃、十二指腸收縮力,加速胃排空,並有抑制哎吐的作用。
毒性研究:
重複給藥毒性:大鼠經口給藥劑量為10、30和100mg/kg/d,持續26周,結果100mg/kg/d組雌鼠的體重增加較快,攝食量和攝水量增多,與對照組相比,雌鼠的白蛋白值顯著性下降,總蛋白量和A/G比值明顯下降,雌鼠乳腺增生的發生率升高,所有大鼠的血清膽固醇、甘油三酯、磷脂明顯降低;30mg/kg/d劑量組雌鼠的體重增加較快,攝食量略有增多,總蛋白量、A/G比值、磷脂值降低、乳腺增生的發生率升高;無毒性反應劑量為10mg/kg/d。犬經口給藥劑量分別為10、30、100mg/kg/d,持續13周,結果100mg/kg/d組動物從給藥第一周開始,給藥1小時後觀察到的自發活動減少、震顫、行為異常等症狀,這些症狀均在給藥24小時後或恢復期消失,100mg/kg/d劑量組一些動物的體重和體重增加幅度輕度降低;30mg/kg/d以上組前列腺重量低於對照組,這與病理組織學檢查所見前列腺組織輕度萎縮結果一致:以上改變均可恢復,無毒性反應劑量為10mg/kg。
生殖毒性:一般生殖毒性試驗中,雌、雄動物經口給藥,劑量為3、30、300mg/kg,結果300mg/kg劑量組給藥初期1/2雄鼠出現流涎體徵,雌鼠給藥和妊娠期間體重增加,在交配前攝食量多;300mg/kg以上劑量組雌鼠性周期延長。大鼠交配率、受孕率、胎仔存活率和胎仔發育未見異常。圍產期生殖毒性試驗中,300mg/kg劑量組幼鼠體重增加緩慢,10、100mg/kg劑量組母鼠人娩、F1代仔鼠發育、生殖能力均未見異常。
遺傳毒性:小鼠微核試驗、微生物回復突變試驗及人血細胞培養色體畸變試驗結果均為陰性。
鹽酸伊托必利通過對多巴胺D2受體的拮抗作用而增加乙醯膽鹼的釋放,同時通過對乙醯膽鹼酶的抑制作用來抑制已釋放的乙醯膽鹼分解,從而增強胃、十二指腸收縮力,加速胃排空,並有抑制哎吐的作用。
毒性研究:
重複給藥毒性:大鼠經口給藥劑量為10、30和100mg/kg/d,持續26周,結果100mg/kg/d組雌鼠的體重增加較快,攝食量和攝水量增多,與對照組相比,雌鼠的白蛋白值顯著性下降,總蛋白量和A/G比值明顯下降,雌鼠乳腺增生的發生率升高,所有大鼠的血清膽固醇、甘油三酯、磷脂明顯降低;30mg/kg/d劑量組雌鼠的體重增加較快,攝食量略有增多,總蛋白量、A/G比值、磷脂值降低、乳腺增生的發生率升高;無毒性反應劑量為10mg/kg/d。犬經口給藥劑量分別為10、30、100mg/kg/d,持續13周,結果100mg/kg/d組動物從給藥第一周開始,給藥1小時後觀察到的自發活動減少、震顫、行為異常等症狀,這些症狀均在給藥24小時後或恢復期消失,100mg/kg/d劑量組一些動物的體重和體重增加幅度輕度降低;30mg/kg/d以上組前列腺重量低於對照組,這與病理組織學檢查所見前列腺組織輕度萎縮結果一致:以上改變均可恢復,無毒性反應劑量為10mg/kg。
生殖毒性:一般生殖毒性試驗中,雌、雄動物經口給藥,劑量為3、30、300mg/kg,結果300mg/kg劑量組給藥初期1/2雄鼠出現流涎體徵,雌鼠給藥和妊娠期間體重增加,在交配前攝食量多;300mg/kg以上劑量組雌鼠性周期延長。大鼠交配率、受孕率、胎仔存活率和胎仔發育未見異常。圍產期生殖毒性試驗中,300mg/kg劑量組幼鼠體重增加緩慢,10、100mg/kg劑量組母鼠人娩、F1代仔鼠發育、生殖能力均未見異常。
遺傳毒性:小鼠微核試驗、微生物回復突變試驗及人血細胞培養色體畸變試驗結果均為陰性。
藥代動力學
本品口服後吸收迅速,給藥後約30分鐘可達峰值血藥濃度,半衰期約為6小時。多次口服給藥時,血清中藥物濃度與單次給藥時相同。本品原形藥物4-5%、其他代謝物約75%從尿中排泄。動物試驗體內主要分布於肝、膽、腎、腦和消化系統,中樞神經系統分布很少。
貯藏
密閉、遮光,在乾燥處(10~30℃)保存。
包裝
鋁塑包裝,每板10粒,每盒1板;每板10粒,每盒2板。
有效期
24個月。
執行標準
YBH08562005
