二氧化矽即白炭黑,又名水合二氧化矽,分子式為SiO2·nH2O,是一種白色、無毒、無定型微細粉狀物,具有多孔性、高分散、質輕、化學穩定性好,耐高溫、不燃燒和電絕緣性好等優異性能。相對密度為2.319~2.653,熔點1750℃。白炭黑微粒直徑很小,在10~1000nm範圍內。根據生產工藝的不同,有沉澱SiO2、發煙SiO2、膠體SiO2和矽膠。除了無孔的膠體SiO2,其餘都是具有高比表面積、高孔隙的顏料。
基本介紹
- 中文名:二氧化矽
- 外文名:Silicon dioxide
- 分子式:SiO2
- 分子量:60.084
- CAS:14808-60-7
- 毒性和危險性:無毒,但長期吸入易得矽肺病
- 管制類型:不管制
- 密度(室溫):2.2 g/cm3
- 熔點:1650(±50)℃
- 沸點:2230℃
- 溶解度:0.012g/100ml(水中)
物質簡介,理化性質,物理性質,化學性質,物質結構,礦物分類,陸源礦物,自生礦物,製備方法,物質用途,食用建議,健康危害,
物質簡介
二氧化矽的化學式為SiO2。二氧化矽有晶態和無定形兩種形態。自然界中存在的二氧化矽如石英、石英砂等統稱矽石。純石英為無色晶體,大而透明的稜柱狀石英晶體叫做水晶,含微量雜質而呈紫色的叫紫水晶,淺黃、金黃和褐色的稱煙水晶。玉髓、瑪瑙和碧玉都是含有雜質的有色石英晶體。沙子是混有雜質的石英細粒。蛋白石、硅藻土則是無定形二氧化矽。二氧化矽用途很廣泛,主要用於制玻璃、水玻璃、陶器、搪瓷、耐火材料、氣凝膠氈、矽鐵、型砂、單質矽、水泥等,在古代,二氧化矽也用來製作瓷器的釉面和胎體。一般的石頭主要由二氧化矽、碳酸鈣構成。
晶態二氧化矽的熔點1723℃,沸點2230℃,不溶於水。除氟氣和氫氟酸外,二氧化矽跟鹵素、鹵化氫和無機酸均不反應,但能溶於熱的濃鹼、熔融的強鹼或碳酸鈉中。此外,高溫時二氧化矽能被焦炭、鎂等還原。常溫時強鹼溶液與SiO2會緩慢反應生成矽酸鹽,故貯存強鹼溶液的玻璃瓶不能用磨口玻璃塞(玻璃中含SiO2),否則會生成有黏性的矽酸鈉Na2SiO3,使瓶塞和瓶口黏結在一起。由於SiO2能與氫氟酸反應,因此不能用玻璃容器盛放氫氟酸。
理化性質
物理性質
比表面積BET | 150~250m2/g |
密度 | (1.9~2.0)  103Kg/m3 |
pH值 | 5~7 |
熱失重量(105℃) | 6%~8% |
揮發性(950℃) | 4%~5% |
吸油性狀 | 200~240mL/100g |
聚集性 | 中等 |
對溶劑的親和性 | 親水性 |
顏色 | 白色 |
透光性 | 大 |
折射率 | 1.45 |
化學性質
化學性質比較穩定。不跟水反應。是酸性氧化物,不跟一般酸反應。氫氟酸跟二氧化矽反應生成氣態四氟化矽。跟熱的濃強鹼溶液或熔化的鹼反應生成矽酸鹽和水。跟多種金屬氧化物在高溫下反應生成矽酸鹽。二氧化矽的性質不活潑,它不與除氟、氟化氫以外的鹵素、鹵化氫以及硫酸、硝酸、高氯酸作用(熱濃磷酸除外)。
常見的濃磷酸(或者說焦磷酸)在高溫下即可腐蝕二氧化矽,生成雜多酸,高溫下熔融硼酸鹽或者硼酐亦可腐蝕二氧化矽,鑒於此性質,硼酸鹽可以用於陶瓷燒制中的助熔劑,除此之外氟化氫也可以可使二氧化矽溶解的酸,生成易溶於水的氟矽酸。
SiO2+4HF=SiF4↑+2H2O
6HF+SiO2=H2SiF6+2H2O
SiO2+2NaOH(濃)=Na2SiO3+H2O
SiO2+Na2CO3=Na2SiO3+CO2↑
SiO2+CaO=CaSiO3
SiO2+2C=2CO+Si
物質結構
矽和碳的性質相似,但它們氧化物的性質卻有很大差異。CO2是分子晶體,而SiO2是原子晶體。SiO2是以矽氧四面體為基本結構形成的立體網狀結構,在晶體結構中,矽原子的4個價電子與4個氧原子形成4個共價鍵,Si原子處在正四面體中心,O原子位於四面體頂點。每個矽原子與四個氧原子相連,每個氧原子與兩個矽原子相連。晶體中最小環由12個原子(6個矽原子和6個氧原子)構成,每個矽被6個環所共用,晶體中矽氧原子個數比為1:2。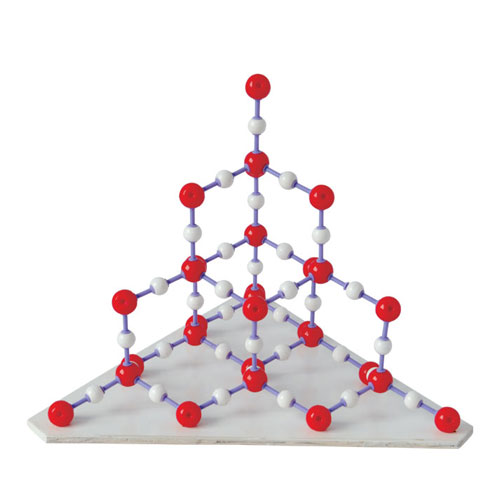 二氧化矽結構
二氧化矽結構
 二氧化矽結構
二氧化矽結構礦物分類
在沉積岩中,二氧化矽礦物主要出現在碎屑岩和矽質岩中。它既可以作為陸源礦物,也可以呈自生礦物出現。這兩種二氧化矽礦物的成因極不相同,必須把它們區分開來。
陸源礦物
陸源礦物即碎屑石英顆粒。有些碎屑石英顆粒含有包裹體,其包裏體可以分為氣液包裏體和礦物包裹體兩類。礦物包裹體又可根據礦物的晶形分為粒狀、針狀和片狀礦物等。包裹體的類型與石英的來源有關。一般地說,氣液包裹體多者(乳狀石英)幾乎都是來自石英脈;片岩及其他高級變質岩中的石英少見氣液包裹體;火山岩中的石英常清澈如水,很少含包裹體;而具金紅石針狀包裹體者多來自花崗岩。但是,由於包裹體在母岩中的產狀比較複雜,顆粒非常細小,鑑定又難,故其套用頗受限制。
根據石英的消光特徵,可以將它分為無波狀消光石英和波狀消光石英兩類。波狀消光是一種應變晶體的簡單的光性表現,大多數岩石無論在結晶過程中或是在晶體形成之後,都會遭受某種變形。據統計,在深成侵入岩和變質岩中,無波狀消光的石英是很少的,一般不到10%;反之,在火山岩中,則很少見到波狀消光的石英,一般也不到10%。而且隨著時代的變老,波狀消光石英的含量也相應增加,因此石英的消光特徵並不是母岩類型的可靠標誌,甚至有人認為,用波狀消光來確定母岩性質是無效的。
根據石英的內部結構,又可將它分為單晶石英和多晶石英(又稱復晶石英)。單晶石英指的是由單個晶體所組成的顆粒,而多晶石英指的是兩個或更多個晶體的集合體,包括來自火成岩、變質岩和沉積岩的顆粒。一般來說,多晶石英的顆粒都比較大,且多晶形式是比較不穩定的。
自生礦物
自生二氧化矽礦物有三種變體,即蛋白石、玉髓和石英。此類礦物既可以單獨組成岩石,又可以呈膠結物產出。
1、蛋白石
蛋白石是直接從水溶液析出SiO2,膠體脫水而成的,因而是非晶質的,含水量很高(可達10%)。在薄片中,蛋白石無色透明,具負高突起。由於色散效應,在蛋白石與樹膠或石英接觸處顯黃色。無解理。正交鏡下全消光。蛋白石易與火山玻璃碎屑相混,但玻屑具特殊外形,其折光率不會低於1.490。蛋白石也容易和方沸石相混,但方沸石具有解理。與螢石的區別是,螢石有晶形且具解理。蛋白石是準穩定礦物,容易重結晶向玉髓轉變。因此,它僅存在於年輕地層中。
2、玉髓
玉髓是隱晶質的SiO2礦物,是由蛋白石結晶而成的,故其是介於蛋白石和石英之間的過渡類型。在薄片中,玉髓無色透明,負低突起。正交鏡下可見纖維狀晶體,呈花瓣或扇狀集合體,轉動物台,玉髓纖維依次達到消光位,消光影呈波浪狀移動,這種消光特點稱扇狀消光。有時玉髓為球狀集合體,十字消光。Ⅰ級灰干涉色,主要為平行消光。福克曾提出要特別注意碳酸鹽岩中一種自生玉髓的類型,它可以用以判斷沉積環境和成岩環境。福克將這類玉髓分為負延性玉髓(負玉髓)、正延性玉髓(正玉髓)、水玉髓和斑狀玉髓。前者為淡水環境沉積或交代的產物,一般玉髓多屬此類。後三種玉髓可能是在蒸發環境中SiO2直接沉澱的,或是SiO2交代蒸發礦物形成的。
3、石英
自生石英多是由蛋白石經玉髓階段重結晶而來,也有從溶液中直接緩慢沉澱而成的。自生石英的主要特徵是外形沒有任何磨蝕痕跡,彼此間常呈鑲嵌狀,有時呈自形晶體,有時外形與其所在空間相適應。自生石英呈次生加大邊產出,次生加大邊光潔透亮,與所圍繞的石英顆粒的成分、光性方位相同,但它們之間常有一圈鐵或黏土的薄膜分隔。
製備方法
二氧化矽生產工藝較多,下面介紹三種製備方法。
1、NaOH溶液直接浸取膨潤土生產二氧化矽
將27g膨潤土與14g氫氧化鈉混合,在三口燒瓶中加熱攪拌製備得產品。鹼性條件下,二氧化矽粒子表面吸附的羥基與Na+形成的擴散雲構成了穩定的溶膠,所以水玻璃(矽溶膠)是非常穩定的。同樣條件下,增加鹼量,二氧化矽的浸出率明顯增加。
2、膨潤土與碳酸鈉的高溫煅燒生產白炭黑
稱取膨潤土與碳酸鈉質量比為10:14的混合物5份,分別在700℃、800℃、850℃煅燒,冷卻到室溫,取2g煅燒物加水50mL,充分溶解,收集濾液,得產品。二氧化矽的浸出率隨溫度升高而增大,850℃時二氧化矽的浸出率在2h以上受溫度影響較小。
3、氣相法生產白炭黑的生產工藝
該法工藝原理是採用四氯化矽在氫氧焰中水解,產生的二氧化矽分子凝集成顆粒。這些顆粒互相碰撞,熔結成一體,形成三維、有分支的鏈狀聚集體。一旦這些聚集體溫度低於二氧化矽熔點,則進一步碰撞,引起鏈的機械纏繞,生成附聚物。由於氣相法物質濃度小,生成的粒子凝聚少,一次粒子為7~20nm。以四氯化矽為原料的氣相法生產工藝為例:將四氯化矽氣體於1800℃下在氫氣、氧氣火焰中水解,製得煙霧狀、顆粒微細、表面光滑的二氧化矽粉體,使其凝結成絮狀,分離脫酸即可得到產品。氣相法生產的二氧化矽是高純度、小粒徑的高品質產品,其產品中二氧化矽的含量>99.8%,比表面積> 300cm2/g,一般用於精細填料。但原料價格高、反應流程長、生產過程能耗大、產品價格高。
物質用途
當二氧化矽結晶完美時就是水晶;二氧化矽膠化脫水後就是瑪瑙;二氧化矽含水的膠體凝固後就成為蛋白石;二氧化矽晶粒小於幾微米時,就組成玉髓、燧石、次生石英岩。物理性質和化學性質均十分穩定的礦產資源,晶體屬三方晶系的氧化物礦物,即低溫石英(α-石英),是石英族礦物中分布最廣的一個礦物種。廣義的石英還包括高溫石英(β-石英)。石英塊又名矽石,主要是生產石英砂(又稱矽砂)的原料,也是石英耐火材料和燒制矽鐵的原料。
除此之外,二氧化矽還可以作為潤滑劑,是一種優良 的流動促進劑,主要作為潤滑劑、抗黏劑、助流劑。特別適宜油類、浸膏類藥物的制粒,製成的顆粒具有很好的流動性和可壓性。還可以在直接壓片中用作助流劑。作為崩解劑可大大改善顆粒流動性,提高松密度,使製得的片劑硬度增加,縮短崩解時限,提高藥物溶出速度。顆粒劑製造中可作內乾燥劑,以增強藥物的穩定性。還可以作助濾劑、澄清劑、消泡劑以及液體製劑的助懸劑、增稠劑。
食用建議
FAO/WHO(2001)規定最大使用量用於乳粉、可可粉、加糖可可粉、食用納脂、可可脂,用量10mg/kg;奶油脂為1g/kg;塗敷用蔗糖粉和葡萄糖粉、湯粉、湯塊15g/kg;美國FDA規定本品作為抗結劑最高限量為2%。GB 2760—2011《食品安全國家標準食品添加劑使用標準》規定將其用於蛋粉、乳粉、可可製品、脫水蛋白製品、糖粉、植脂性粉末、固體飲料、孕產婦配方食品,最大使用量為15g/kg;香辛料類、固體複合調味料最大使用量為20g/kg;豆製品加工最大使用量0.025g/kg。
除以上之外,我國還有磷酸三鈣做抗結劑,常用於乳粉和奶油粉,最大使用量10.0g/kg;小麥粉,最大使用量0.03g/kg;複合調味料,最大使用量20.0g/kg;固體飲料,最大使用量8.0g/kg;油炸小食品,最大使用量2.0g/kg。
健康危害
二氧化矽在日常生活、生產和科研等方面有著重要的用途,但有時也會對人體造成危害。二氧化矽的粉塵極細,比表面積達到100m2/g以上可以懸浮在空氣中,如果人長期吸入含有二氧化矽的粉塵,就會患矽肺病(因矽舊稱為矽,矽肺舊稱為矽肺)。

