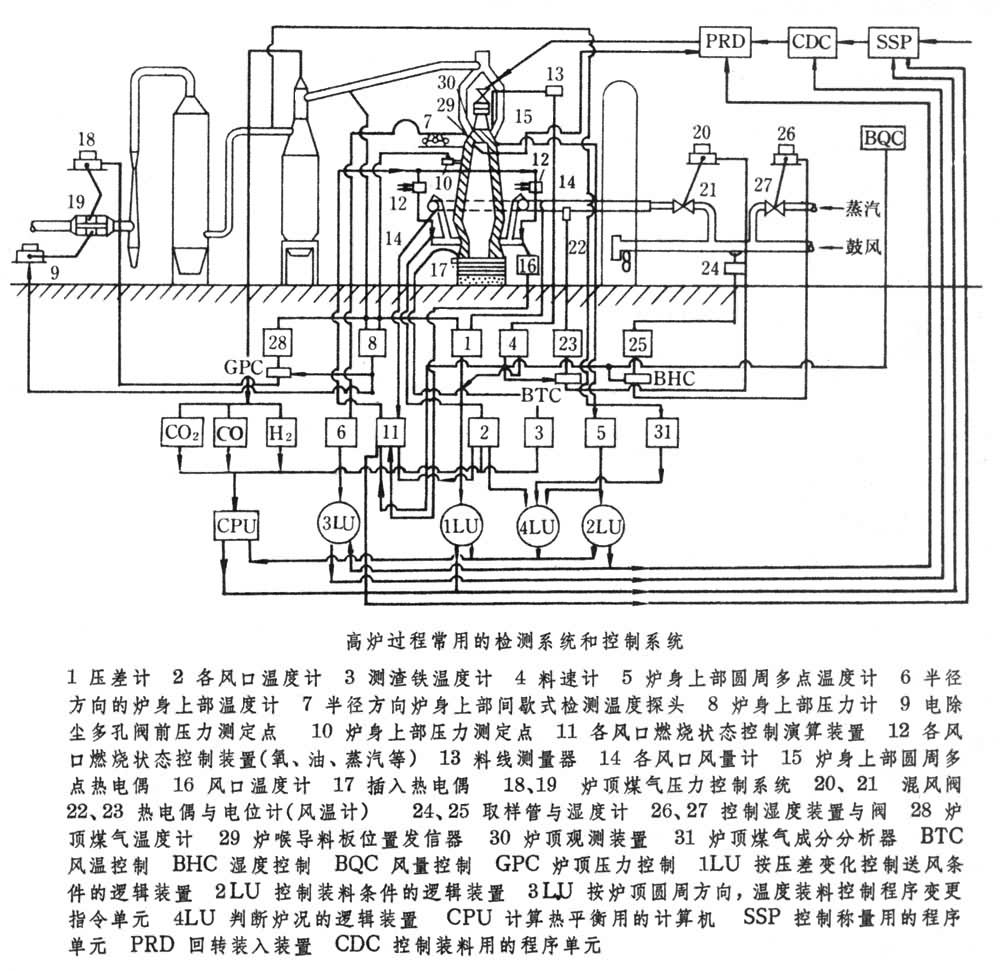
高爐熱平衡測定與計算方法
按照
能量守恆定律,以高爐物料平衡為基礎對高爐連續鑄鋼|煉鐵過程的各項熱收入和熱支出進行計算,然後彙編製成熱平衡表,據此能夠了解高爐內熱量消耗狀況,分析高爐冶煉過程熱消耗的問題,找出進一步改善能量利用,降低燃料消耗的途徑。它還是計算理論焦比及各種因素對焦比之影響的基礎。在高爐採用某些新技術措施時,通過熱平衡計算,高gao並同物料平衡一起可預測冶煉效果,從而可以擬定出最適宜的冶煉製度。根據分析的需要,熱平衡計算可分為兩類:一類是以整個高爐為對象的,稱為全爐熱平衡計算;另一類是以高爐局部區域為對象的,稱為區域熱平衡計算。20世紀60年代前連續鑄鋼|煉鐵工作者大都採用全爐熱平衡計算,其原因在於區域熱平衡的邊界條件,特別是邊界處爐料和煤氣溫變差的確定有較大的任煮性,而這個溫度差的大小又在很大程度上決定著區域熱平衡分析的可靠性。60年代以來,高爐傳輸過程研究和高爐解剖研究的結果幫助了這一溫度差的選定。而且決定高爐冶煉指標的因素又較多地集中在處於高爐下部的高溫區,因此高溫區的區域熱平衡得到普遍重視和廣泛套用。
第一種全爐熱平衡 這種方法出現較早,原理簡單,屬經典性質的。它建立在
蓋斯定律的基礎上,即依據爐料入高爐時的初始狀態和離開高爐時的最終狀態來計算產生的和消耗的熱量,而不考慮它們在高爐內進行的實際過程。例如是按FeO分解為Fe和l/2O2的耗熱和C+1/2O
2結合成CO的放熱計算的,而不是按實際吸熱反應計算的。
熱量的收入項
熱量收入 分為兩類:一類是化學反應熱,它由每kg或m3反應物在反應中放出的熱效應與反應物數量的乘積算出;另一類是物理熱,它由物料量與它們的比熱容(c料)和溫度(t料)的乘積算出。第一種全爐熱平衡的熱收入有5項:
1)碳素氧化熱。在高爐內每1kg氧化成CO放熱9800kJ,氧化成CO2放熱33400kJ,每1m3CO氧化成CO2放熱12600kJ。高爐內碳素氧化分為風口前碳素燃燒成CO和直接還原中C氧化成CO,間接還原中CO氧化成CO2:qc=9800(C風+Cd),qco一co2=12600CO2i,kJ/t。碳素氧化熱是熱收入的主要項,約占熱收入的70%~80%。
(2)熱風物理熱。常將鼓風中濕度分解耗熱在本項收入中扣除,每1m3H2O分解耗熱10800kJ,q風=V 風c風t風—10800V 風Ψ,kJ/t。
(3)氫氧化放熱。這是H2還原氧化物時氧化成H2O放出的熱,每1m3H2氧化成H2O放熱為10800kJ,qH2一2H2O=10800H2O還。
(4)成渣熱。這是熔劑和生礦帶入高爐內的CaO和MgO造渣時放出的熱量,每1kgCaO或MgO成渣放熱1130kJ,q成渣1130(CaO+MgO)kJ/t,式中CaO、MgO為每噸生鐵熔劑和生礦帶入的自由CaO和MgO量,kg/t。在現代高爐生產中已大量使用熔劑性燒結礦、自熔性燒結礦和高鹼度燒結礦或球團礦,加入高爐的熔劑量很少或完全不加入,所以為簡化熱平衡,常將此項微少的熱收入在熱支出項的碳酸鹽分解耗熱中扣除。
(5)爐料物理熱。對使用冷礦的高爐,這項熱量很少,可以忽略不計。在仍使用熱燒結礦的高爐,這項熱量為q料=G料c料t料,kJ/t。
熱量支出項
熱量支出 第一種全爐熱平衡的熱量支出有9項:
(1)氧化物分解耗熱。它包括鐵氧化物和生鐵中少量元素(Si,Mn,P,V,Ti等)氧化物分解耗熱,它們以生鐵中所含數量與該氧化物分解熱的乘積算得;
(2)脫硫。按每噸生鐵進入爐渣的硫量u(S)和硫化物分解熱計算;
(3)碳酸鹽分解耗熱。進入高爐的碳酸鹽有FeCO3(菱鐵礦中的)、MnCO3(菱錳礦中的)、CaCO3(石灰石和白雲石中的)、MgCO3(白雲石中的);有時為了簡化將成渣熱從此項中扣除1130;
(4)風中水分分解。常將此項在鼓風帶入的物理熱中扣除;
(5)噴吹物分解耗熱。每1kg噴入高爐的煤粉的分解熱波動在1050~1250kJ,一般無煙煤用低值,煙煤用高值;
(6)爐料中水分蒸發和加熱耗熱。焦炭,天然生礦及熔劑帶入物理水,尤其是水熄焦帶入3%~5%或更高的水分,它們蒸發並加熱到爐頂溫度,如果使用褐鐵礦生礦或含有結晶水礦物(例如脈石中的高嶺土等)的生礦,這些結晶水也要分解蒸發和加熱到爐頂溫度;
(7)鐵水和爐渣的焓。可根據測定鐵水和爐渣的溫度,按各組分的含量和它們的平均比熱容用加和法算得。也可根據實測溫度和冶煉生鐵品種選取統計出的經驗數據:煉鋼生鐵Qu=(1720~1840)kJ/kg渣,Qe=(1180~1260)kJ/kg生鐵;鑄造生鐵Qu=(1885~2000)kJ/kg渣,Qe=(1260~1380)kJ/kg生鐵。這樣q鐵=1000Qe,q渣=uQu,kJ/t;
(8)爐頂煤氣的焓。它包括乾煤氣、還原生成的H2O和爐塵三者帶走的熱量,用它們數量、比熱容和爐頂溫度的乘積算得;
(9)熱損失。高爐熱損失包括冷卻水帶走的熱量、通過爐殼表面輻射散熱和對流給熱損失熱量以及通過爐底傳給地層的熱量等。除冷卻水帶走熱量可較精確地測得外,其他幾種是難於測得的,通常採用總熱收入減去1~8項熱支出而得出,有時也用統計經驗式估算。
高爐熱損失隨爐子大小,冶煉強度高低和冶煉生鐵品種而不同。一般煉鑄造生鐵時熱損失占全部熱收入的6%~10%,而煉鋼生鐵的熱損失為3%~8%。
第二種全爐熱平衡 是在第一種熱平衡基礎上發展來的,它更能反映高爐冶煉在熱量交換和熱能利用方面的實質。因此在分析高爐熱現象,尋求節能降耗的途徑時被廣泛套用。這兩種熱平衡相同的是物理熱:在熱收入上是熱風、爐料帶入的熱量;在熱支出上是爐料中水分蒸發和加熱,生鐵、爐渣及煤氣的焓。兩種熱平衡不同的是化學反應熱:碳的氧化放熱在第二種熱平衡中只計算風口前碳氧化成CO的放熱qC=9800C風kJ/t;還原耗熱只計算吸熱反應的鐵直接還原和少量元素直接還原耗熱;脫硫耗熱按實際的反應熱計算碳酸鹽分解除計算CaCO一CaO+CO2的分解熱外,還要計算進入高溫區後該反應分解出來的CO2與焦炭的碳發生溶解損失反應的耗熱;結晶水分解出來的H2O進入高溫區也要計算H2O+C—H2+CO反應的吸熱。
高爐高溫區熱平衡的計算
高爐高溫區熱平衡是以高爐下部發生直接還原的高溫區作為研究對象,分析計算其中各種熱量收支情況的。 高爐煉鐵焦比主要取決於高溫區的熱交換,因此,高溫區熱平衡計算,對研究高爐冶煉工藝過程更具有實際意義。
確定高溫區的原則
高溫區熱平衡 在以整個高爐為研究對象的全爐熱平衡中把高爐上部與下部收支的熱量看作是等價的。但實際上,高爐冶煉過程能否順利進行不僅取決於所需要的熱量,而且還取決於過程所在區域的溫度,人們已完全了解清楚,同樣的熱量,在高爐不同部位因溫度不同而具有完全不同的價值,例如熱風帶入的高溫1kJ熱量能使爐缸變熱,促進Si還原而使生鐵含Si量升高;而熱燒結礦帶入爐喉的1kJ熱量只能使爐頂溫度升高,仍然由煤氣帶出爐外,而不能使爐缸變熱。因此,用全爐熱平衡分析高爐的熱現象有片面性。由於高爐記憶體在熱交換空區(見高爐熱交換),邊界上的煤氣和爐料溫度選擇相對較穩定和易於切合生產實際,再加上決定高爐技術經濟指標的過程也較多地集中在爐子下部,所以區域熱平衡常以區域邊界煤氣溫度950~1000℃以上的下部高溫區為對象。
高溫區熱量
高溫區熱平衡類似於第二種全爐熱平衡,它的收入為碳素在風口前氧化為CO的放熱和熱風帶入的有效熱量等兩項;而熱支出為直接還原耗熱、脫硫耗熱、石灰石在高溫區分解耗熱、分解出的CO2。參與溶損反應耗熱,鐵水和爐渣的焓(扣除進入邊界區時的焓)以及煤氣離開高溫區時的焓(扣除生成煤氣的焦炭進入高溫區時的焓),為簡化計算,將它們歸入高溫區熱平衡的熱損失項中;在噴吹燃料時還要計算煤粉分解耗熱和加熱到邊界溫度時的耗熱。高溫區熱損失也是採用總收入扣除上述消耗後的差值來表示。