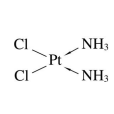
順鉑,又名順式-二氯二氨合鉑,是一種含鉑的抗癌藥物,呈橙黃色或黃色結晶性粉末,微溶於水、易溶於二甲基甲醯胺,在水溶液中可逐漸轉化成反式和水解。臨床上對卵巢癌、前列腺癌、睪丸癌、肺癌、鼻咽癌、食道癌、惡性淋巴瘤、頭頸部鱗癌、甲狀腺癌及成骨肉瘤等多種實體腫瘤均能顯示療效。
2017年10月27日,世界衛生組織國際癌症研究機構公布的致癌物清單初步整理參考,順鉑在2A類致癌物清單中。
基本介紹
- 中文名:順鉑
- 外文名:cisplatin
- 別名:順式-二氯二氨合鉑、順氯氨鉑
- 化學式:PtCl2(NH3)2
- 分子量:298.029
- CAS登錄號:15663-27-1
- EINECS登錄號:239-733-8
- 熔點:270 ℃
- 密度:3.7 g/cm
- 外觀:橙黃色至深黃色結晶性粉末
- 安全性描述:S26;S39;S45;S53
- 危險性符號:T
- 危險性描述:R25;R41;R45
- UN危險貨物編號:1851/3288
化合物簡介,基本信息,理化性質,計算化學數據,用途,藥典信息,來源,性狀,鑑別,檢查,含量測定,類別,貯藏,製劑,藥品簡介,藥理作用,.毒理研究,藥動學,適應症,臨床套用,禁忌,用法用量,不良反應,注意事項,孕婦及哺乳期婦女用藥,藥物相互作用,藥物過量,物質毒性,安全信息,安全術語,風險術語,
化合物簡介
基本信息
化學式:PtCl2(NH3)2
分子量:298.029
CAS號:15663-27-1
MDL號:MFCD00011623
EINECS號:239-733-8
RTECS號:TP2455000
PubChem號:24871609
理化性質
密度:3.7g/cm
熔點:270ºC
外觀:橙黃色至深黃色結晶性粉末
計算化學數據
疏水參數計算參考值(XlogP):無
氫鍵供體數量:2
氫鍵受體數量:4
可旋轉化學鍵數量:0
互變異構體數量:0
拓撲分子極性表面積(TPSA):2
重原子數量:5
表面電荷:0
複雜度:0
同位素原子數量:0
確定原子立構中心數量:0
不確定原子立構中心數量:0
確定化學鍵立構中心數量:0
不確定化學鍵立構中心數量:0
共價鍵單元數量:5
用途
順鉑能與DNA結合,引起交叉聯結,從而破壞DNA的功能,並抑制細胞有絲分裂,為一種細胞非特異性藥物。該品抗瘤譜較廣,用於頭頸部鱗癌、卵巢癌、胚胞性癌、精原性細胞瘤、肺癌、甲狀腺癌、淋巴肉瘤及網狀細胞肉瘤等。
藥典信息
來源
本品為(Z)-二氨二氯鉑。按乾燥品計算,含PtCl2(NH3)2應為98.0%~102.0%。
性狀
本品為亮黃色至橙黃色的結晶性粉末,無臭。
本品在二甲基亞碸中易溶,在N,N-二甲基甲醯胺中略溶,在水中微溶,在乙醇中不溶。
鑑別
1、取本品約5mg,加硫酸1mL後,即顯灰綠色。
2、在含量測定項下記錄的色譜圖中,供試品溶液主峰的保留時間應與對照品溶液主峰的保留時間一致。
3、取本品,加0.9%氯化鈉溶液製成每1mL中約含1mg的溶液,照紫外-可見分光光度法(通則0401)測定,在301nm的波長處有最大吸收,在247nm的波長處有最小吸收。
4、本品的紅外光吸收圖譜應與對照的圖譜(光譜集297圖)一致。
檢查
含鉑量
取本品約0.5g,精密稱定,照熾灼殘渣檢查法(通則0841,但不加硫酸),在400℃熾灼至恆重,所得殘渣重量即為供試量中含有鉑的重量。按乾燥品計算,含鉑量應為64.6%~65.4%。
含氯量
取本品30mg,精密稱定,照氧瓶燃燒法(通則0703)進行有機破壞,用氫氧化鈉試液20mL為吸收液,俟燃燒完畢後,強力振搖數分鐘,用少量水沖洗瓶塞及鉑絲,洗液併入吸收液中,加溴酚藍指示液1滴,滴加稀硝酸至溶液變為黃色,再加稀硝酸1mL、乙醇20mL與1%二苯偕肼的乙醇溶液5滴,用硝酸汞滴定液(0.025mol/L)滴定,近終點時強力振搖,繼續滴定至溶液顯淡玫瑰紅色,並將滴定的結果用空白試驗校正。每1mL硝酸汞滴定液(0.025mol/L)相當於1.773mg的氯(Cl),含氯量應為23.0%~24.3%。
溶液的澄清度
取本品20mg,加0.9%氯化鈉溶液20mL溶解後,溶液應澄清。
酸度
取溶液的澄清度項下的溶液,依法測定(通則0631),pH值應為5.0~7.0。
有關物質
照高效液相色譜法(通則0512)測定,避光操作,臨用新制。
供試品溶液:取本品, 加0.9%氯化鈉溶液溶解並稀釋製成每1mL中約含0.2mg的溶液。
對照溶液:精密量取供試品溶液1mL,置50mL量瓶中,用0.9%氯化鈉溶液稀釋至刻度,搖勻。
色譜條件:用十八烷基矽烷鍵合矽膠為填充劑,以0.003mol/L庚烷磺酸鈉的0.9%氯化鈉溶液為流動相,檢測波長為220nm,進樣體積20µL。
系統適用性要求:理論板數按順鉑峰計算不低於3000,順鉑峰與相鄰雜質峰之間的分離度應符合要求。
測定法:精密量取供試品溶液與對照溶液,分別注入液相色譜儀,記錄色譜圖至主成分峰保留時間的2倍。
限度:供試品溶液色譜圖中如有雜質峰,相對保留時間約為0.87的雜質峰面積乘以0.569後不得大於對照溶液主峰面積的0.5倍(1.0%),相對保留時間約為1.2的雜質峰面積乘以1.356後不得大於對照溶液的主峰面積(2.0%),其他雜質峰面積的和不得大於對照溶液主峰面積的0.25倍(0.5%)。
乾燥失重
取本品約0.1g,在105℃乾燥至恆重,減失重量不得過0.5%(通則0831)。
含量測定
照高效液相色譜法(通則0512)測定,避光操作。
供試品溶液
取本品適量,精密稱定, 加0.9%氯化鈉溶液溶解並定量稀釋製成每1mL中約含40µg的溶液。
對照品溶液
取順鉑對照品,精密稱定,加0.9%氯化鈉溶液溶解並定量稀釋製成每1mL中約含40µg的溶液。
色譜條件與系統適用性要求
見有關物質項下 。
測定法
精密量取供試品溶液與對照品溶液,分別注入液相色譜儀,記錄色譜圖。按外標法以峰面積計算。
類別
抗腫瘤藥。
貯藏
遮光,密封保存。
製劑
注射用順鉑。
藥品簡介
藥理作用
順鉑,是目前常用的金屬鉑類絡合物,在分子中鉑原子對其抗腫瘤作用有重要意義。但只有順式才有意義,反式無效。可與DNA鏈交叉連線,顯示出細胞毒作用。溶解後在體內無需載體轉運,即可通過帶電的細胞膜。由於細胞內氯離子濃度低 (4mmol/L),氯離子為水所取代,電荷呈陽性,具有類似烷化劑雙功能基團的作用,可與細胞核內DNA的鹼基結合,形成三種形式的交聯,造成DNA損傷,破壞DNA複製和轉錄,高濃度時也抑制RNA及蛋白質的合成。順鉑具有抗癌譜廣、乏氧細胞有效、作用性強等優點,已普遍用於治療睪丸癌、卵巢癌、子宮癌、膀胱癌、頸部癌、前列腺癌、腦癌等,療效顯著。但順鉑用於治療癌有一定的毒性,會引起副作用,因此需要不斷尋找毒性較小而臨床效果與順鉑相近的類似物。迄今各國科學家已合成並檢驗了數千種與順鉑相關的金屬配合物,研製出以碳鉑為代表的第二代抗癌鉑配合物。第三代抗癌金屬配合物也已發現,以二氯茂鈦為代表。這些化合物從化學角度上與順鉑無關,但它們對順鉑治療效果不大的某些癌變有較好的效果,且不傷害腎功能。現在這一領域仍在繼續進行大量研究,著重在分子水平上探索金屬配合物抗癌活性的機理。中國已生產商品順鉑和開展這方面的研究工作。
順鉑屬於細胞周期的非特異性藥物,具有細胞毒性,由於癌細胞較正常細胞的增殖和合成更為迅速,癌細胞對本品的細胞毒性作用就更為敏感,可抑制癌細胞DNA複製過程,並損傷其細胞膜上的結構,有較強的廣譜抗癌作用。用於卵巢癌、前列腺癌、睪丸癌等泌尿生殖系統惡性腫瘤,有較好療效。與長春新鹼、環磷醯胺、5-氟尿嘧啶聯用,對惡性淋巴瘤、乳腺癌、頭頸部鱗癌、甲狀腺癌成骨肉瘤等均能顯效。順鉑配合放療治療晚期非小細胞肺癌、鼻咽癌、食管癌等療效突出,對肝癌和軟組織肉瘤也有一定療效。順鉑為強蓄積性藥物,易產生腎毒性,消化道反應較常見,部分患者出現粒細胞減少,但停藥後7~14天內可恢復。
此外,本品對DNA的損傷還有可能在核內或細胞表面改變其抗原性,使原來隱蔽的表面抗原暴露,刺激抗體的免疫抑制而發揮其細胞毒作用。
.毒理研究
1、生殖毒性
本品孕婦套用可導致胎兒損害。小鼠實驗中本品表現出致畸性和胚胎毒性。若妊娠期間套用,或給藥期間發現懷孕,應告之患者其對胎兒的潛在危害性。應勸告有生育可能的婦女避免懷孕。有報導在人乳汁中檢測到本品,建議母親套用本品時中止授乳。
2、遺傳毒性
本品在細胞實驗中表現出致突變性,使組織培養的動物細胞出現染色體畸變。
3、致癌毒性
進行了BDIX(共50隻)給藥的致癌性實驗,本品腹腔給藥3周,1mg/kg/周,結果首次給藥的455天內,33隻動物死亡,其中13隻死於惡性腫瘤;12隻白血病,1隻為腎肝臟纖維肉瘤。
藥動學
[體內過程] DDP口服無效,靜脈注射後開始在肝、腎、大小腸及皮膚中分布最多,18~24小時後腎內積蓄最多,而腦組織中最少。在血漿中消失迅速,呈雙相型。開始血漿半衰期為25~49分鐘,分布後血漿半衰期為55~73小時。靜脈注射後1小時血漿含量為10%左右,90%與血漿蛋白等大分子結合。排泄較慢,1日內尿中排出19%~34%,4日內尿中僅排出25%~44%,但在全劑量注入後的5日內,僅有27%~43%的順鉑排出體外;膽道或腸道排出甚少,腹腔給藥時腹腔器官的藥物濃度相當於靜脈給藥的2.5~8倍,這對卵巢癌等治療有增效作用。
適應症
小細胞與非小細胞肺癌、睪丸癌、卵巢癌、宮頸癌、子宮內膜癌、前列腺癌、膀胱癌、黑色素瘤、肉瘤、頭頸部腫瘤及各種鱗狀上皮癌和惡性淋巴瘤的治療。
臨床套用
DDP具有抗癌譜廣、作用強、與多種抗腫瘤藥有協同作用、且無交叉耐藥等特點,為當前聯合化療中最常用的藥物之一。
(1) 生殖系統腫瘤:對卵巢癌及睪丸癌療效顯著。DDP與ADM的聯合化療可使40%以上的卵巢癌取得較好療效;DDP與BLM、VLB的聯合化療,對非精原細胞睪丸癌的有效率與治癒率分別達到80%和60%。亦可用於絨癌、宮頸癌等其他生殖系統腫瘤。
(2) 頭頸部癌:鼻咽癌、甲狀腺癌、喉癌等。
(3) 對膀胱癌、肺癌、惡性淋巴瘤、乳腺癌、腎細胞癌、前列腺癌、軟組織肉瘤、惡性黑色素瘤也有一定療效。
(4) 其他:惡性胸腹水;與放療並用,有放射增敏作用。
為治療多種實體瘤的一線用藥。與VP-16聯合(EP方案)為治療SCLC或NSCLC一線方案,聯合MMC、IFO(IMP方案),或NVB等方案為治療NSCLC常用方案,以DDP為主的聯合化療亦為晚期卵巢癌、骨肉瘤及神經母細胞瘤的主要治療方案,與ADM、CTX等聯用對多部位鱗狀上皮癌、移行細胞癌有效,如頭頸部、宮頸、食管及泌尿系腫瘤等。
“PVB”(DDP、VLB、BLM)可治療大部分IV期非精原細胞睪丸癌,緩解率50%~80%。此外,本品為放療增敏劑,國外廣泛用於IV期不能手術的NSCLC的局部放療,可提高療效及改善生存期。
禁忌
對順鉑和其它含鉑製劑過敏者、懷孕、哺乳期、骨髓機能減退、嚴重腎功能損害、失水過多、水痘、帶狀皰疹、痛風、高尿酸血症、近期感染及因順鉑而引起的外周神經病等患者禁用。
用法用量
靜脈注射或靜脈滴註:每次20~30mg,或20mg/m,溶於生理鹽水20~30mL中靜脈注射,或溶於5%葡萄糖注射液250~500mL中靜脈滴注,在第1天和第8天使用為1個周期,一般3~4周重複,可間斷用藥3~4個周期。
大劑量:80~120mg/m,每3周1次,同時注意水化,使患者尿量保持在2000~3000mL,也可加用甘露醇利尿。
胸腹腔注射:胸腔7~10日1次,每次30~60mg。腹腔每次100~160mg。
動脈注射:每次20~30mL,中由插管推注,連用5日為1周期,間隔3周可重複。動脈灌注主要用於頭頸部腫瘤。
不良反應
1、 腎臟毒性:單次中、大劑量用藥後,偶會出現輕微、可逆的腎功能障礙,可出現微量血尿。多次高劑量和短期內重複用藥,會出現不可逆的腎功能障礙,嚴重時腎小管壞死,導致無尿和尿毒症。
2、 消化系統:包括噁心、嘔吐、食慾減低和腹瀉等,反應常在給藥後1~6小時內發生,最長不超過24~48小時。偶見肝功能障礙、血清轉氨酶增加,停藥後可恢復。
3、 造血系統:表現為白細胞和(或)血小板的減少,一般與用藥劑量有關,骨髓抑制一般在3周左右達高峰,4~6周恢復。
4、 耳毒性:可出現耳鳴和高頻聽力減低,多為可逆性,不須特殊處理。
5、 神經毒性:多見於總量超過300mg/m的患者,周圍神經損傷多見,表現為運動失調、肌痛、上下肢感覺異常等;少數病人可能出現大腦功能障礙,亦可出現癲癇,球後視神經炎等。
6、 過敏反應:如心率加快,血壓降低、呼吸困難、面部水腫、變態性發熱反應等,都可能出現。
7、 其他:
高尿酸血症:常出現腿腫脹和關節痛。
血漿電解質紊亂:低鎂血症、低鈣血症、肌肉痙攣。
心臟毒性:少見心率失常、心電圖改變、心動過緩或過速、心功能不全等。
免疫系統:會出現免疫抑制反應。
牙齦變化:牙齦會有鉑金屬沉積。
患者接受動脈或靜脈注射的肢體可能出現局部腫脹。疼痛、紅斑及皮膚潰瘍、局部靜脈炎等少見。也有可能出現脫髮、精子、卵子形成障礙和男性乳房女性化等現象。
繼發性非淋巴細胞性白血病的出現與順鉑化療使用有關。
血管性病變,如腦缺血、冠狀動脈缺血、外周血管障礙類似Ravnaud綜合徵等副作用少見,但可能與順鉑使用有關。
注意事項
1、使用
(1)在運用較大劑量(80~120mg/m)時,必須同時進行水化和利尿。所謂水化療法即水化、利快活與增加尿中氯量,以降低腎臟毒性的一種治療方法。一般在大劑量DDP給藥前先給生理鹽水或葡萄糖溶解1000mL加氯釋後滴注。DDP用生理鹽水200mL稀釋後滴注。DDP給藥前,一次給20%甘露醇125mL,DDP滴完後再用125mL,以達到利尿之目的。一般每日液體總量3000~4000mL,輸液從DDP給藥前6~12小時開始,持續至DDP滴完後6小時為止;有的大劑量DDP一次給藥,則連續輸液3日,輸液中根據尿量,每次給速尿40mg靜脈衝入。
(2)為減輕毒副作用,用藥期間尚應多飲水;用藥前宜選用各類止吐藥;同時備用腎上腺素、皮質激素、抗組織胺藥,以便急救使用;用DDP後可肌肉注射安鈉咖以鞏固療效。
(3)在用藥前、中、後均應監測血、尿及肝腎功能。其停藥指片為:白細胞<3.5x10/L,血小板<75x 10/L持續性噁心,嘔吐;早期腎臟毒性如尿中白細胞10、紅細胞10、管型5/高倍視野以上者;血清肌酐>186~351mmol/L者;過敏反應;在用藥過程中發現有腎病史、腎功能不良及患有中耳炎的患者。若血清肌酐、尿素氮、白細胞、血小板等恢復到正常水平,一般情況良好,則可重複用藥。
(4)本品可減少BLM的腎排泄而增加其肺毒性;與氨基甙類抗生素合用可發生致命的腎衰,並可能加重耳的損害;抗級別織胺藥、吩噻嗪類等可能會掩蓋DDP的耳毒性。
(5)DDP在生理鹽水中溶解較慢,可加溫30℃左右振盪助溶,也可選用溶液製劑。
2、 下列患者用藥特別慎重:
即往有腎病史、造血系統功能不全、聽神經功能障礙、用藥前曾接受其它化療或放射治療、及非順鉑引起的外周神經炎等。
3、 治療前後,治療期間和每一療程之前,應作如下檢查:肝、腎功能、全血計數、血鈣以及聽神經功能、神經系統功能等檢查。此外,在治療期間,每周應檢查全血計數。通常需待器官功能恢復正常後,才可重複下一療程。
4、 化療期間與化療後,男女病人均需嚴格避孕。治療後若想懷孕,需事先進行遺傳學諮詢。
5、 順鉑可能影響注意力集中、駕駛和機械操作能力。
6、 本品應避免接觸鋁金屬(如鋁金屬注射針器等)。
7、 在化療期間與化療後,病人必需飲用足夠的水份。
孕婦及哺乳期婦女用藥
本品孕婦套用可導致胎兒損害,有報導在人乳汁中檢測到本品,故建議哺乳期婦女套用本品時中止授乳。孕婦禁用。
藥物相互作用
2、抗組胺藥、酚噻嗪類藥或噻噸類藥(thioxanthene)與順鉑合用,可能掩蓋耳毒性的症狀,如耳鳴、眩暈等。
3、順鉑誘發的腎功能損害可導致博來黴素(甚至小劑量)的毒性反應。
4、與各種骨髓抑制劑或放射治療同用,可增加毒性作用,用量應減少。
5、青黴胺或其它的蝥合劑、會減弱順鉑的活性。故本品不應與蝥合劑同時套用。
6、與異環磷醯胺合用,會加重蛋白尿,同時有可能會增加耳毒性。
7、順鉑化療期間,由於其它具有腎毒性或耳毒性藥物(例如頭孢菌素或氨基甙類)會增加順鉑的毒性,需避免合併使用。禁用諸如速尿等利尿劑以增加尿量。
8、病人接受順鉑化療後至少三個月,才可接受病毒疫苗接種。
藥物過量
藥物劑量超過120mg/m,其毒性增加,尤其是腎毒性、骨髓毒性。
物質毒性
編號 | 毒性類型 | 測試方法 | 測試對象 | 使用劑量 | 毒性作用 |
|---|---|---|---|---|---|
1 | 急性毒性 | 靜脈注射 | 成年男性 | 2140 μg/kg/5D-I | 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) |
2 | 急性毒性 | 靜脈注射 | 人類 | 1500 μg/kg/6D-I | 耳毒性——視力變化 腎、輸尿管和膀胱毒性——腎功能下降 血液毒性——骨髓發生變化 |
3 | 急性毒性 | 靜脈注射 | 人類 | 500 μg/kg/13D-I | 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) 腎、輸尿管和膀胱毒性——腎功能下降 血液毒性——其他變化 |
4 | 急性毒性 | 靜脈注射 | 人類 | 2500 μg/kg | 行為毒性——出現幻覺,感知扭曲 胃腸道毒性——噁心、嘔吐 腎、輸尿管和膀胱毒性——腎功能下降 |
5 | 急性毒性 | 靜脈注射 | 人類 | 72 mg/kg/25D-I | 胃腸道毒性——噁心、嘔吐 |
6 | 急性毒性 | Intradermal | 人類 | 40 ng/kg | 1皮膚和附屬檔案毒性——對皮膚有刺激性 (局部暴露後) 皮膚和附屬檔案毒性——皮膚腐蝕 (局部暴露後) |
7 | 急性毒性 | 腸外 | 成年男性 | 2140 μg/kg/5D-I | 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) |
8 | 急性毒性 | 未報告 | 兒童 | 19200 μg/kg/12W-I | 耳毒性——視力變化 |
9 | 急性毒性 | 口服 | 大鼠 | 25800 μg/kg | 行為毒性——運動行為發生變化(具體情況具體分析) 胃腸道毒性——運動過度、腹瀉 血液毒性——正細胞性貧血 |
10 | 急性毒性 | 腹腔注射 | 大鼠 | 6400 μg/kg | 詳細作用沒有報告除致死劑量以外的其他值 |
11 | 急性毒性 | 皮下注射 | 大鼠 | 8100 μg/kg | 肺部、胸部或者呼吸毒性——紫紺 胃腸道毒性——運動過度、腹瀉 腎、輸尿管和膀胱毒性——尿量增加 |
12 | 急性毒性 | 靜脈注射 | 大鼠 | 8 mg/kg | 腎、輸尿管和膀胱毒性——其他變化 |
13 | 急性毒性 | 肌肉注射 | 大鼠 | 9200 μg/kg | 行為毒性——運動行為發生變化(具體情況具體分析) 胃腸道毒性——運動過度、腹瀉 血液毒性——正細胞性貧血 |
14 | 急性毒性 | 未報告 | 大鼠 | >5 mg/kg | 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) |
15 | 急性毒性 | 口服 | 小鼠 | 32700 μg/kg | 肺部、胸部或者呼吸毒性——紫紺 胃腸道毒性——運動過度、腹瀉 腎、輸尿管和膀胱毒性——尿量增加 |
16 | 急性毒性 | 腹腔注射 | 小鼠 | 6600 μg/kg | 詳細作用沒有報告除致死劑量以外的其他值 |
17 | 急性毒性 | 皮下注射 | 小鼠 | 13 mg/kg | 詳細作用沒有報告除致死劑量以外的其他值 |
18 | 急性毒性 | 靜脈注射 | 小鼠 | 11 mg/kg | 詳細作用沒有報告除致死劑量以外的其他值 |
19 | 急性毒性 | 肌肉注射 | 小鼠 | 17900 μg/kg | 行為毒性——運動行為發生變化(具體情況具體分析) 胃腸道毒性——運動過度、腹瀉 血液毒性——正細胞性貧血 |
20 | 急性毒性 | 腸外 | 小鼠 | 22 mg/kg | 詳細作用沒有報告除致死劑量以外的其他值 |
21 | 急性毒性 | 未報告 | 小鼠 | 10900 μg/kg | 詳細作用沒有報告除致死劑量以外的其他值 |
22 | 急性毒性 | 靜脈注射 | 狗 | 2500 μg/kg | 胃腸道毒性——其他變化 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) 血液毒性——出現高鐵血紅蛋白、碳氧血紅蛋白 |
23 | 急性毒性 | 靜脈注射 | 猴 | 250 μg/kg | 詳細作用沒有報告除致死劑量以外的其他值 |
24 | 急性毒性 | 腹腔注射 | 豚鼠 | 9700 μg/kg | 耳毒性——視力變化 |
25 | 急性毒性 | 腸外 | 青蛙 | 17 mg/kg | 行為毒性——驚厥或癲癇發作閾值受到影響 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) |
26 | 急性毒性 | 靜脈注射 | 哺乳動物 | 8 mg/kg | 胃腸道毒性——噁心、嘔吐 |
27 | 慢性毒性 | 腹腔注射 | 大鼠 | 24 mg/kg/3D-I | 肝毒性——其他變化 腎、輸尿管和膀胱毒性——其他變化 營養和代謝系統毒性——金屬離子濃度發生變化 |
28 | 慢性毒性 | 腹腔注射 | 大鼠 | 9 mg/kg/5D-I | 胃腸道毒性——其他變化 生化毒性——抑制或誘導其他酶 |
29 | 慢性毒性 | 腹腔注射 | 大鼠 | 22680 μg/kg/35D-C | 腎、輸尿管和膀胱毒性——膀胱重量發生變化 內分泌毒性——胸腺重量變化 血液毒性——正細胞性貧血 |
30 | 慢性毒性 | 腹腔注射 | 大鼠 | 23296 μg/kg/26W-C | 肝毒性——肝重量發生變化 腎、輸尿管和膀胱毒性——尿中成分發生變化 內分泌毒性——胸腺重量變化 |
31 | 慢性毒性 | 腹腔注射 | 大鼠 | 14 mg/kg/7D-I | 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) 營養和代謝系統毒性——體重下降或體重增加速率下降 慢性病相關毒性——死亡 |
32 | 慢性毒性 | 腹腔注射 | 大鼠 | 18 mg/kg/5W-I | 周圍神經毒性——神經或神經鞘結構發生變化 慢性病相關毒性——死亡 |
33 | 慢性毒性 | 靜脈注射 | 大鼠 | 16200 μg/kg/26W-I | 心臟毒性——其他變化 腎、輸尿管和膀胱毒性——其他變化 內分泌毒性——其他變化 |
34 | 慢性毒性 | 腹腔注射 | 大鼠 | 18 mg/kg/9W-I | 周圍神經毒性——神經或神經鞘結構發生變化 |
35 | 慢性毒性 | 腹腔注射 | 大鼠 | 22800 μg/kg/6W-I | 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) 血液毒性——骨髓發生變化 骨骼肌毒性——其他變化 |
36 | 慢性毒性 | 靜脈注射 | 大鼠 | 22 mg/kg/4W-I | 血液毒性——血清成分發生變化 (如TP、膽紅素、膽固醇) 血液毒性——白細胞計數發生變化 血液毒性——血小板計數發生變化 |
37 | 慢性毒性 | 靜脈注射 | 大鼠 | 18 mg/kg/20D-I | 腎、輸尿管和膀胱毒性——其他變化 血液毒性——血清成分發生變化 (如TP、膽紅素、膽固醇) 生化毒性——抑制或誘導過氧化氫酶 |
38 | 慢性毒性 | 腹腔注射 | 小鼠 | 40 mg/kg/8W-I | 周圍神經毒性——三叉神經感官發生變化 營養和代謝系統毒性——體重下降或體重增加速率下降 慢性病相關毒性——死亡 |
39 | 慢性毒性 | 靜脈注射 | 小鼠 | 11 mg/kg/5D-I | 大腦毒性——腦重量發生變化 腎、輸尿管和膀胱毒性——膀胱重量發生變化 營養和代謝系統毒性——體重下降或體重增加速率下降 |
40 | 慢性毒性 | 靜脈注射 | 狗 | 10500 μg/kg/90D | 血液毒性——血小板減少 營養和代謝系統毒性——體重下降或體重增加速率下降 生化毒性——抑制或誘導磷酸酶 |
41 | 慢性毒性 | 靜脈注射 | 狗 | 10800 μg/kg/26W-I | 腎、輸尿管和膀胱毒性——膀胱重量發生變化 血液毒性——血小板計數發生變化 慢性病相關毒性——睪丸重量發生變化 |
42 | 慢性毒性 | 靜脈注射 | 狗 | 3750 μg/kg/5D-I | 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) 血液毒性——骨髓發生變化 慢性病相關毒性——死亡 |
43 | 慢性毒性 | 靜脈注射 | 猴 | 12500 μg/kg/5D-I | 胃腸道毒性——其他變化 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) 血液毒性——骨髓發生變化 |
44 | 慢性毒性 | 靜脈注射 | 猴 | 12500 μg/kg/12W-I | 周圍神經毒性——神經或神經鞘結構發生變化 胃腸道毒性——噁心、嘔吐 腎、輸尿管和膀胱毒性——腎小管發生變化 (包括急性腎功能衰竭,急性腎小管壞死) |
45 | 慢性毒性 | 腹腔注射 | 豚鼠 | 7500 μg/kg/15D-I | 耳毒性——視力變化 耳毒性——耳蝸結構或功能發生變化 慢性病相關毒性——死亡 |
46 | 慢性毒性 | 腹腔注射 | 豚鼠 | 18 mg/kg/9D-I | 血液毒性——血清成分發生變化 (如TP、膽紅素、膽固醇) 營養和代謝系統毒性——體重下降或體重增加速率下降 慢性病相關毒性——死亡 |
47 | 慢性毒性 | 腹腔注射 | 豚鼠 | 15 mg/kg/30D-I | 耳毒性——耳蝸結構或功能發生變化 |
48 | 突變毒性 | 鼠傷寒沙門氏菌 | 250 ng/plate | ||
49 | 突變毒性 | 鼠傷寒沙門氏菌 | 300 ng/plate | ||
50 | 突變毒性 | 鼠傷寒沙門氏菌 | 1 nmol/plate | ||
51 | 突變毒性 | 鼠傷寒沙門氏菌 | 10 mg/L/20H (持續) | ||
52 | 突變毒性 | 大腸埃希氏菌 | 25 μg/plate | ||
53 | 突變毒性 | 大腸埃希氏菌 | 3 mg/L | ||
54 | 突變毒性 | 大腸埃希氏菌 | 50 mol/L | ||
55 | 突變毒性 | 大腸埃希氏菌 | 125 ng/plate | ||
56 | 突變毒性 | 大腸埃希氏菌 | 50 μmol/L | ||
57 | 突變毒性 | 大腸埃希氏菌 | 35 mg/L | ||
58 | 突變毒性 | 大腸埃希氏菌 | 26600 nmol/L | ||
59 | 突變毒性 | 大腸埃希氏菌 | 250 μmol/L | ||
60 | 突變毒性 | 大腸埃希氏菌 | 1 μg/plate | ||
61 | 突變毒性 | 枯草芽孢桿菌 | 15 μmol/L/3H (持續) | ||
62 | 突變毒性 | 枯草芽孢桿菌 | 1 μg/plate | ||
63 | 突變毒性 | 微生物 | 250 mg/L | ||
64 | 突變毒性 | 微生物 | 1 mmol/L | ||
65 | 突變毒性 | 微生物 | 60 nmol/L | ||
66 | 突變毒性 | 微生物 | 1 mmol/L | ||
67 | 突變毒性 | 口服 | 果蠅 | 10 μmol/L | |
68 | 突變毒性 | 腸外 | 果蠅 | 200 μmol/L | |
69 | 突變毒性 | 腸外 | 果蠅 | 830 μmol/L | |
70 | 突變毒性 | 口服 | 果蠅 | 40 ppm | |
71 | 突變毒性 | 腸外 | 果蠅 | 200 μmol/L | |
72 | 突變毒性 | 粗糙脈孢菌 | 200 μmol/L | ||
73 | 突變毒性 | 釀酒酵母 | 50 mg/L | ||
74 | 突變毒性 | 釀酒酵母 | 50 mg/L | ||
75 | 突變毒性 | 鮭魚精子 | 10 mg/L | ||
76 | 突變毒性 | 人類淋巴細胞 | 8250 nmol/L | ||
77 | 突變毒性 | 人類白細胞 | 500 μg/L | ||
78 | 突變毒性 | 人類成纖維細胞 | 5 μmol/L | ||
79 | 突變毒性 | 人類白細胞 | 100 μmol/L | ||
80 | 突變毒性 | 人類卵巢 | 20 μmol/L | ||
81 | 突變毒性 | 人類 細胞 | 10 μmol/L | ||
82 | 突變毒性 | 人類卵巢 | 40 μmol/L | ||
83 | 突變毒性 | 人類卵巢 | 10 μmol/L | ||
84 | 突變毒性 | 人類 細胞 | 5 mg/L | ||
85 | 突變毒性 | 人類成纖維細胞 | 20 μmol/L | ||
86 | 突變毒性 | 人類 細胞 | 10 μmol/L | ||
87 | 突變毒性 | 人類 細胞 | 45 μmol/L | ||
88 | 突變毒性 | 人類淋巴細胞 | 12 μmol/L | ||
89 | 突變毒性 | 海拉細胞 | 5 μmol/L | ||
90 | 突變毒性 | 海拉細胞 | 5 μmol/L | ||
91 | 突變毒性 | 人類非 | 10 μmol/L | ||
92 | 突變毒性 | 人類 細胞 | 10 μmol/L | ||
93 | 突變毒性 | 人類 細胞 | 10 μmol/L | ||
94 | 突變毒性 | 人類 細胞 | 10 μmol/L | ||
95 | 突變毒性 | 人類成纖維細胞 | 10 μmol/L | ||
96 | 突變毒性 | 海拉細胞 | 500 nmol/L | ||
97 | 突變毒性 | 人類淋巴細胞 | 10 mg/L | ||
98 | 突變毒性 | 人類 細胞 | 5 μmol/L | ||
99 | 突變毒性 | 人類 細胞 | 5 μmol/L | ||
100 | 突變毒性 | 人類淋巴細胞 | 8250 nmol/L | ||
101 | 突變毒性 | 人類卵巢 | 5 μmol/L | ||
102 | 突變毒性 | 人類 細胞 | 20 μmol/L | ||
103 | 突變毒性 | 人類鼠傷寒沙門氏菌 | 24 mg/kg | ||
104 | 突變毒性 | 人類 細胞 | 10 μmol/L | ||
105 | 突變毒性 | 人類淋巴細胞 | 1 mg/L/24H | ||
106 | 突變毒性 | 人類 細胞 | 50 mg/L | ||
107 | 突變毒性 | 人類 細胞 | 3300 nmol/L | ||
108 | 突變毒性 | 人類淋巴細胞 | 250 ng/L/96H | ||
109 | 突變毒性 | 腹腔注射 | 大鼠 | 3500 μg/kg | |
110 | 突變毒性 | 大鼠 細胞 | 10 μmol/L | ||
111 | 突變毒性 | 靜脈注射 | 大鼠 | 8 mg/kg | |
112 | 突變毒性 | 腹腔注射 | 大鼠 | 5 mg/kg | |
113 | 突變毒性 | 腹腔注射 | 大鼠 | 4 mg/kg | |
114 | 突變毒性 | 靜脈注射 | 大鼠 | 8500 μg/kg | |
115 | 突變毒性 | 大鼠腎 | 10 μmol/L | ||
116 | 突變毒性 | 大鼠、鼠傷寒沙門氏菌 | 40 mg/kg | ||
117 | 突變毒性 | 腹腔注射 | 大鼠 | 650 μg/kg/5D | |
118 | 突變毒性 | 大鼠 細胞 | 1 μmol/L | ||
119 | 突變毒性 | 腹腔注射 | 小鼠 | 100 μg/kg | |
120 | 突變毒性 | 小鼠 細胞 | 62500 ng/L | ||
121 | 突變毒性 | 腹腔注射 | 小鼠 | 10 mg/kg | |
122 | 突變毒性 | 小鼠白細胞 | 4 mg/L | ||
123 | 突變毒性 | 靜脈注射 | 小鼠 | 20 mg/kg | |
124 | 突變毒性 | 小鼠 細胞 | 1 mg/L | ||
125 | 突變毒性 | 小鼠 細胞 | 1 mg/L | ||
126 | 突變毒性 | 小鼠乳腺 | 5 mg/L | ||
127 | 突變毒性 | 小鼠腹水瘤細胞 | 100 μmol/L | ||
128 | 突變毒性 | 小鼠腹水瘤細胞 | 100 μmol/L | ||
129 | 突變毒性 | 小鼠淋巴細胞 | 50 mg/L | ||
130 | 突變毒性 | 小鼠白細胞 | 1 mg/L | ||
131 | 突變毒性 | 小鼠 細胞 | 500 μg/L | ||
132 | 突變毒性 | 腹腔注射 | 小鼠 | 12 mg/kg | |
133 | 突變毒性 | 小鼠鼠傷寒沙門氏菌 | 2500 μg/kg | ||
134 | 突變毒性 | 腹腔注射 | 小鼠 | 500 μg/kg | |
135 | 突變毒性 | 小鼠 細胞 | 8 mg/kg | ||
136 | 突變毒性 | 小鼠白細胞 | 5 mg/L | ||
137 | 突變毒性 | 小鼠 細胞 | 2 mg/L | ||
138 | 突變毒性 | 靜脈注射 | 小鼠 | 1300 μg/kg | |
139 | 突變毒性 | 小鼠 細胞 | 4 μmol/L | ||
140 | 突變毒性 | 小鼠胚胎 | 100 nmol/L | ||
141 | 突變毒性 | 腹腔注射 | 小鼠 | 2500 μg/kg | |
142 | 突變毒性 | 小鼠大腸埃希氏菌 | 10 mg/L | ||
143 | 突變毒性 | 小鼠腹水瘤細胞 | 18200 μg/kg | ||
144 | 突變毒性 | 腹腔注射 | 小鼠 | 10 mg/kg | |
145 | 突變毒性 | 靜脈注射 | 小鼠 | 10 mg/kg | |
146 | 突變毒性 | 腹腔注射 | 倉鼠 | 1 mg/kg | |
147 | 突變毒性 | 倉鼠肺 | 680 nmol/L | ||
148 | 突變毒性 | 倉鼠卵巢 | 5 mg/L | ||
149 | 突變毒性 | 倉鼠腎 | 1 μmol/L | ||
150 | 突變毒性 | 倉鼠胚胎 | 100 nmol/L | ||
151 | 突變毒性 | 倉鼠卵巢 | 50 μmol/L | ||
152 | 突變毒性 | 倉鼠肺 | 11 μmol/L/2H | ||
153 | 突變毒性 | 倉鼠卵巢 | 1 μmol/L | ||
154 | 突變毒性 | 倉鼠 細胞 | 1 mmol/L | ||
155 | 突變毒性 | 倉鼠肺 | 30 μmol/L | ||
156 | 突變毒性 | 倉鼠卵巢 | 5 mg/L | ||
157 | 突變毒性 | 倉鼠卵巢 | 5 mg/L | ||
158 | 突變毒性 | 倉鼠肺 | 680 nmol/L | ||
159 | 突變毒性 | 倉鼠卵巢 | 5 mg/L | ||
160 | 突變毒性 | 倉鼠 細胞 | 330 nmol/L | ||
161 | 突變毒性 | 倉鼠肺 | 1 ng/L/2H | ||
162 | 突變毒性 | 倉鼠胚胎 | 100 nmol/L | ||
163 | 突變毒性 | 倉鼠卵巢 | 200 μg/L | ||
164 | 突變毒性 | 腹腔注射 | 倉鼠 | 10 mg/kg | |
165 | 突變毒性 | 倉鼠卵巢 | 1 μmol/L | ||
166 | 突變毒性 | 倉鼠肺 | 2 mg/L/2H | ||
167 | 突變毒性 | 哺乳動物淋巴細胞 | 100 μmol/L | ||
168 | 突變毒性 | 兔腎 | 5 mg/L/24H | ||
169 | 突變毒性 | 兔腎 | 5 mg/L/24H | ||
170 | 突變毒性 | 靜脈注射 | 兔 | 1250 μg/kg | |
171 | 突變毒性 | 兔淋巴細胞 | 100 μg/L | ||
172 | 致癌性 | 腹腔注射 | 小鼠 | 7500 μg/kg | 致癌性——腫瘤(根據RTECS標準) 皮膚和附屬檔案毒性——腫瘤 生殖毒性——胎盤腫瘤 |
173 | 致癌性 | 腹腔注射 | 小鼠 | 16 mg/kg/19W-I | 致癌性——致癌(根據RTECS標準) 肺部、胸部或者呼吸毒性——腫瘤 |
174 | 致癌性 | 腹腔注射 | 小鼠 | 16204 μg/kg/10W-I | 致癌性——腫瘤(根據RTECS標準) 肺部、胸部或者呼吸毒性——腫瘤 |
175 | 致癌性 | 腹腔注射 | 小鼠 | 32408 μg/kg/10W-I | 致癌性——腫瘤(根據RTECS標準) 肺部、胸部或者呼吸毒性——腫瘤 |
176 | 生殖毒性 | 腹腔注射 | 大鼠 | 4500 μg/kg,雌性受孕 17-22 天后 | 生殖毒性——影響新生兒活力指數(如在出生第4天還活著) |
177 | 生殖毒性 | 腹腔注射 | 大鼠 | 2750 μg/kg,雌性受孕 7-11 天后 | 生殖毒性——產生額外的胚胎結構 (如胎盤、臍帶) 生殖毒性——胎兒毒性(如胎兒發育不良,但不至死亡) 生殖毒性——影響新生兒活產指數 |
178 | 生殖毒性 | 腹腔注射 | 大鼠 | 9 mg/kg,雄性配種 3 天前 | 生殖毒性——睪丸,附睪,輸精管發生變化 |
179 | 生殖毒性 | 腹腔注射 | 大鼠 | 300 μg/kg,雌性受孕 6 天后 | 生殖毒性——肌肉骨骼系統發育異常 |
180 | 生殖毒性 | 腹腔注射 | 大鼠 | 13 mg/kg,雌性受孕 17-22 天后 | 生殖毒性——影響新生兒的行為 生殖毒性——新生兒身體變化 |
181 | 生殖毒性 | 腹腔注射 | 大鼠 | 3 mg/kg,雌性受孕 3 天后 | 生殖毒性——植入後死亡率增加 |
182 | 生殖毒性 | 皮下注射 | 大鼠 | 10 mg/kg,雄性配種 5 天前 | 生殖毒性——雄性生精功能異常 (包括遺傳物質,精子形態,精子活力和計數) 生殖毒性——睪丸,附睪,輸精管發生變化 生殖毒性——前列腺,精囊,考伯氏腺,附屬腺體發生變化 |
183 | 生殖毒性 | 皮下注射 | 大鼠 | 10 mg/kg,雄性配種 5 天前 | 生殖毒性——雄性生精功能異常 (包括遺傳物質,精子形態,精子活力和計數) 生殖毒性——睪丸,附睪,輸精管發生變化 生殖毒性——前列腺,精囊,考伯氏腺,附屬腺體發生變化 |
184 | 生殖毒性 | 靜脈注射 | 大鼠 | 4125 μg/kg,雌性受孕 7-17 天后 | 生殖毒性——胚胎或胎兒死亡 生殖毒性——新生兒死胎 生殖毒性——影響新生兒活力指數(如在出生第4天還活著) |
185 | 生殖毒性 | 靜脈注射 | 大鼠 | 660 μg/kg,雌性受孕 7-17 天后 | 生殖毒性——產生額外的胚胎結構 (如胎盤、臍帶) 生殖毒性——肌肉骨骼系統發育異常 生殖毒性——影響新生兒的行為 |
186 | 生殖毒性 | 靜脈注射 | 大鼠 | 1650 μg/kg,雌性受孕 7-17 天后 | 生殖毒性——胎兒毒性(如胎兒發育不良,但不至死亡) 生殖毒性——其他變化 |
187 | 生殖毒性 | 靜脈注射 | 大鼠 | 4125 μg/kg,雌性受孕 7-17 天后 | 生殖毒性——新生兒體重增加量減少 生殖毒性——新生兒身體變化 |
188 | 生殖毒性 | 未報告 | 大鼠 | 1 mg/kg,多代 | 生殖毒性——影響新生兒的行為 |
189 | 生殖毒性 | 口服 | 小鼠 | 8 mg/kg,雌性受孕 12 天后 | 生殖毒性——中樞神經系統發育異常 |
190 | 生殖毒性 | 腹腔注射 | 小鼠 | 8 mg/kg,雌性受孕 12 天后 | 生殖毒性——中樞神經系統發育異常 |
191 | 生殖毒性 | 腹腔注射 | 小鼠 | 3 mg/kg,雌性受孕 8 天后 | 生殖毒性——植入後死亡率增加 生殖毒性——影響產仔數 生殖毒性——胎兒毒性(如胎兒發育不良,但不至死亡) |
192 | 生殖毒性 | 腹腔注射 | 小鼠 | 1100 μg/kg,雄性配種 1 天前 | 生殖毒性——雄性生精功能異常 (包括遺傳物質,精子形態,精子活力和計數) |
193 | 生殖毒性 | 腹腔注射 | 小鼠 | 20 mg/kg,雌性受孕 13 天后 | 生殖毒性——影響胎兒或胚胎細胞遺傳物質 生殖毒性——中樞神經系統發育異常 |
194 | 生殖毒性 | 腹腔注射 | 小鼠 | 300 μg/kg,雌性受孕 8 天后 | 生殖毒性——胎兒毒性 (如胎兒發育不良,但不至死亡) |
195 | 生殖毒性 | 皮下注射 | 小鼠 | 350 mg/kg,雄性配種 5 周前 | 生殖毒性——雄性生精功能異常 (包括遺傳物質,精子形態,精子活力和計數) 生殖毒性——睪丸,附睪,輸精管發生變化 |
196 | 生殖毒性 | 靜脈注射 | 小鼠 | 1100 μg/kg,雄性配種 1 天前 | 生殖毒性——雄性生精功能異常 (包括遺傳物質,精子形態,精子活力和計數) |
197 | 生殖毒性 | 靜脈注射 | 兔 | 1625 μg/kg,雌性受孕 6-18 天后 | 生殖毒性——影響產仔數 生殖毒性——胚胎或胎兒死亡 |
安全信息
安全術語
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S39:Wear eye / face protection.
戴護目鏡或面具。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the label whenever possible.)
若發生事故或感不適,立即就醫(可能的話,出示其標籤)。
S53:Avoid exposure - obtain special instructions before use.
避免接觸,使用前須獲得特別指示說明。
風險術語
R25:Toxic if swallowed.
吞食有毒。
R41:Risk of serious damage to the eyes.
對眼睛有嚴重傷害。
R45:May cause cancer.
可能致癌。