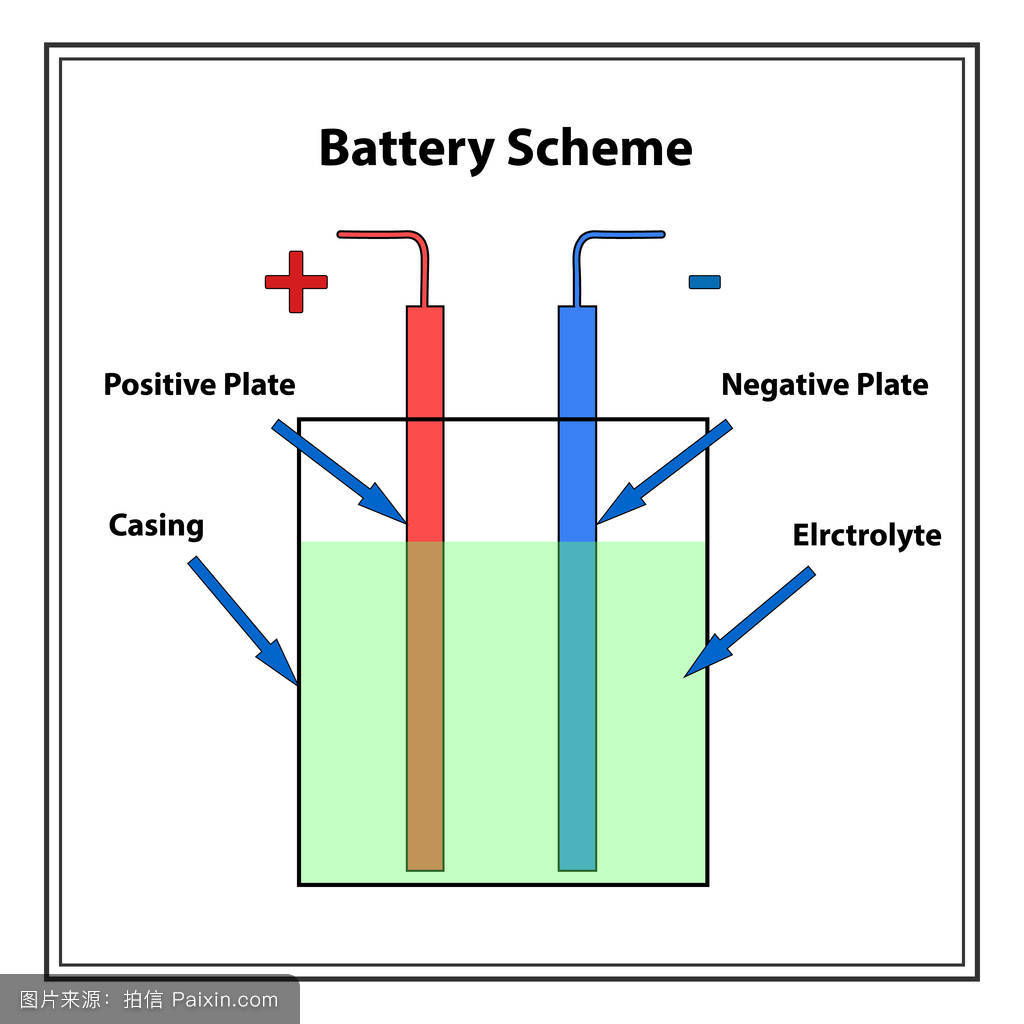
基本介紹
- 中文名:電化學勢
- 外文名:electrochemical potential
- 別稱:電化學位
- 性質:作用力
- 學科:冶金工程
- 領域:冶煉
簡介,“電位”和“電勢”,電化學勢的套用,導出電極與其電極液之間的電勢差,導出可逆電池電動勢與摩爾反應勢函式的關係,導出液體接界電勢,總結,
簡介
電化學勢是電化學中的基本概念,在大部分電化學專業書籍和部分物理化學教材中有介紹,在探討電化學問題的相關論文中也不斷被使用。但大都是為了說明相間電勢而引入,用來說明問題的一個最基本觀點是“一定溫度和壓力下,帶電粒子趨於從其電化學勢高的相移向其電化學勢低的相,平衡時各帶電粒子在各相中的電化學勢相等”。然而關於這一基本觀點都只是進行了定性的描述,作為過程方向判據,卻沒有從熱力學第二定律的高度進行進一步的說明。這就妨礙了人們對這一概念的深入理解,限制了這個概念的套用,甚至導致有些教師產生了對於電化學系統直接把熱力學第二定律的Gibbs判據中的化學勢改為電化學勢,然後將這個新判據仍然使用在恆溫恆壓沒有非體積功這樣的限制條件下去說明問題的錯誤做法。另外,也正是因為對於電化學勢理解的不深入,甚至有些講授物理化學幾十年的老教師,只承認有化學平衡(因為傳統的物理化學理論中有相應的平衡判據),不承認有電化學平衡(因為傳統的物理化學理論中沒有相應的平衡判據)。
“電位”和“電勢”
對於“電位”和“電勢”,我國一般書上“位”“勢”混用,不加分辨。但也有人認為應該進一步區分。按照物理學上的概念:空間某點的點位,是指將單位正電荷從無窮遠處(或以毫無任何力的作用的無窮遠的真空為參考點)移到該點所需的功。它具有絕對意義。“勢”則是空間兩點間的點位差(或點位降),具有相對意義。
電化學勢的套用
導出電極與其電極液之間的電勢差
當金屬電極插入到含有其離子的電極液中後,電極和溶液中的各種組分,由於其電化學勢在兩相中的不同而在兩相中進行分配。當分配達到平衡,即各組分在兩相中的電化學勢相等後,往往若一相帶上正電荷,另一相就會帶上負電荷,造成兩相的電勢也就不同,形成電勢差。
導出可逆電池電動勢與摩爾反應勢函式的關係
在傳統的物理化學教材中,電動勢和摩爾反應吉布斯函式(摩爾反應勢函式)是通過可逆過程的概念聯繫在一起的。即,按熱力學原理,在恆溫恆壓下系統吉布斯函式的減少等於其在可逆過程中所作的最大非體積功,電池系統所作的非體積功即電功。
因為電化學可逆過程是變化中處處都能達到電化學平衡的過程,所以可逆電池的結果實際上也是電池系統達電化學平衡的結果,因此也可以利用電化學勢的概念從平衡的角度導出。
導出液體接界電勢
兩種不同性質的溶液相接觸時,如果也能形成像電極/溶液界面那樣穩定的液/液界面,那么,由於兩種溶液中各組分的電化學勢不同,各組分將在兩相間進行分配,直至它們在兩相的電化學勢達到相等,分配達到平衡,這樣,也會在液/液界面形成雙電層,使兩相具有穩定的電勢差。這種發生在兩種不同性質的液體接界面上的電勢差稱為液體接界電勢。
總結
從熱力學第二定律的高度認識電化學勢判據,避免錯誤使用這一判據。強調電化學勢在電化學科學中重要的基礎地位。也就是說,對電化學勢概念有了深入了解後,對理解電化學平衡概念、理解電化學可逆過程、進而理解實現電化學可逆過程的工具—可逆電池概念應該大有益處。而大部分工科物化教材為了壓縮學時和內容,在電化學部分都不介紹電化學勢概念,讓人有無源之水無本之木的感覺。