基本介紹
- 中文名:雙電流滴定法
- 外文名:Biamperometric Titration
- 又稱:永停滴定法、雙安培滴定法
- 拼音:shuāng diàn liú dī dìng fā
- 優點:儀器簡單、操作方便、準確度高
- 學科:化學
基本原理,分類,滴定曲線,測量方法,優點,
基本原理
在氧化還原電對中同時存在氧化型及與其對應的還原型物質,如在I2/I溶液中含有I2和I,此時若同時插入兩支相同的鉑電極,因兩個電極的電位相等,電極間不發生反應,則沒有電流通過。若在兩個電極間外加一低電壓,在兩支鉑電極上即發生如下電解反應:
陽極:2I=I2 + 2e(可逆反應)
陰極:I2+ 2e =2I(可逆反應)
因此兩電極間就會有電流通過。像I2/I這樣的電對,在溶液中與兩支鉑電極組成電池,當外加一個低電壓時,一支電極發生氧化反應,另一支電極則發生還原反應,同時發生電解,並有電流通過。這樣的電對稱為可逆電對。
若溶液中的電對是S4O6/S2O3,在該電對溶液中同時插入兩支相同的鉑電極,同樣外加一低電壓,則在陽極上S2O3能發生氧化反應,而在陰極上S4O6不能發生氧化還原反應,不能進行電解,無電流通過,這樣的電對稱為不可逆電對。
分類
根據滴定過程中電流的變化情況,雙電流滴定可以分為以下三種情況:
- 標準溶液為不可逆電對,樣品溶液為可逆電對;
2.標準溶液為可逆電對,樣品溶液為不可逆電對;
3.標準溶液和樣品溶液均為可逆電對。
滴定曲線
下圖列出三種不同類型滴定的滴定曲線,並舉例說明了滴定終點的判斷。

不同類型的滴定曲線
測量方法
測量裝置根據滴定劑和被滴溶液所採用電對的可逆性,觀察滴定過程中電流指針的變化來判斷滴定終點(即指針突變點)。必要時也可以記錄加入標準溶液的體積(V)和相應的電流(I),繪製I-V滴定曲線來確定滴定終點。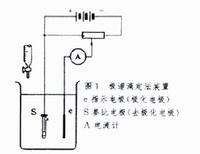

雙電流滴定法
優點
雙電流滴定法儀器簡單,操作方便,測定結果準確可靠;
雙電流滴定法要優於慣用的電流滴定法,後者的滴定曲線在等當點時極少甚至根本不出現破折;
雙電流滴定法能用於沉澱滴定,尤其適用於銀離子的沉澱滴定。

